Vid AL-amyloidos ses inlagring av lätta immunglobulinkedjor producerade av klonala plasmaceller.
AL-amyloidos med hjärtengagemang har mycket dålig prognos.
Vävnadsbiopsi krävs för att säkerställa diagnos.
Hos patienter utan betydande hjärtpåverkan kan behandling med cellgifter och autolog stamcellstransplantation bli aktuell.
Hos patienter med svår hjärtsvikt kan man i utvalda fall överväga hjärttransplantation för att möjliggöra efterföljande autolog stamcellstransplantation.
Amyloidos innebär att felveckade proteiner aggregerar till svårlösliga fibriller som inlagras i vävnader och orsakar organskada. Vid AL-amyloidos (A = amyloid, L = lätt immunglobulinkedja), som är den vanligaste systemiska amyloidosen, utgörs proteinerna av lätta immunglobulinkedjor producerade av klonala plasmaceller. AL-amyloidos är inte ärftlig, och det finns inga kända riskfaktorer. Den årliga incidensen uppskattas till 6–10/miljon invånare [1]. Medelåldern vid insjuknande är 65 år, med viss övervikt för kvinnor.
Den kliniska bilden avgörs av vilka organ som är drabbade; njur- och hjärtengagemang dominerar. Vid framträdande hjärtengagemang är prognosen som regel dålig [2-5]. För säker diagnos krävs vävnadsbiopsier från benmärg och bukfett. Vid misstanke om hjärtamyloidos kan myokardbiopsi tillföra ytterligare information men är inte obligat om bukfettsbiopsi är positiv och det inte föreligger några andra differentialdiagnostiska överväganden avseende hjärtpåverkan.
Behandling som riktar sig mot plasmacellsklonen har förbättrat överlevnaden, särskilt hos patienter med lågrisk- och mellanriskamyloidos. Trots dessa framsteg dör vissa patienter inom bara månader efter diagnos, särskilt de med hjärtengagemang [2-6]. Vid säkerställd AL-amyloidos utan betydande hjärtpåverkan kan högdosbehandling med cytostatika följd av autolog stamcellstransplantation övervägas för att uppnå remission. Hos yngre patienter med grav hjärtpåverkan kan hjärttransplantation övervägas för att möjliggöra senare autolog stamcellstransplantation [7].
Vi beskriver här två fall av AL-amyloidos där patienterna hade svår hjärtsvikt och efter noggrann utredning accepterades för hjärttransplantation med efterföljande autolog stamcellstransplantation. Denna behandling är mycket krävande men potentiellt botande och kan komma i fråga i utvalda fall. Efter dessa två patienter har ytterligare en patient med AL-amyloidos genomgått samma behandling på Sahlgrenska universitetssjukhuset i Göteborg med gott resultat.
Fallbeskrivningar
Fall 1
En 50-årig kvinna drabbades av en mindre hjärtinfarkt 2007 som behandlades med PCI (perkutan koronarintervention). Hon utvecklade asymmetrisk vänsterkammarhypertrofi och lätt nedsatt ejektionsfraktion. Hon remitterades till kardiologen på Sahlgrenska universitetssjukhuset i Göteborg i juni 2009 på grund av tilltagande hjärtsviktssymtom. Förnyat ultraljud av hjärtat visade ejektionsfraktion ca 35 procent, och undersökning med magnetresonanstomografi ingav misstanke om inlagringssjukdom.
Vid hjärtkateterisering noterades restriktiv hjärtsvikt med höga fyllnadstryck biventrikulärt. Myokardbiopsi visade uttalad amyloidinlagring. Benmärgsaspiration och -biopsi visade måttligt ökad plasmacellshalt, och i serum och urin förekom förhöjda nivåer av lätta immunglobulinkedjor av lambdatyp. Efter kompletterande bukfettsbiopsi ställdes diagnosen AL-amyloidos.
Njurfunktionen var något sänkt med GFR 49 ml/min × 1,73 m2. På grund av uttalad hjärtsvikt med ett konditionstal (maximalt O2-upptag) på endast 10,8 ml/kg kroppsvikt/min bedömdes behandling med högdos cytostatika och autolog stamcellstransplantation vara för riskfylld. Patienten accepterades av en multidisciplinär transplantationskonferens för hjärttransplantation med avsikt att utföra efterföljande autolog stamcellstransplantation 3–6 månader efter hjärttransplantationen.
Hjärttransplantationen genomfördes framgångsrikt i augusti utan föregående hematologisk behandling, och patienten erhöll sedvanlig immunsuppression med takrolimus, mykofenolatmofetil och prednisolon. Efter någon månad drabbades hon av diarréer, och koloskopi med biopsi bekräftade amyloidinlagring. Dessutom försämrades hennes njurfunktion i snabb takt, varför den planerade stamcellstransplantationen tidigarelades. Upprepade myokardbiopsier visade inga tecken till avstötning eller återkomst av amyloidinlagring.
I november 2009 påbörjades stamcellstransplantationen med stamcellsskörd följd av högdosbehandling med cytostatika och stamcellsinfusion. Patienten skrevs ut relativt välmående efter 3 veckors vårdtid som komplicerats av bukbesvär, melena och nutritionssvårigheter.
I juli 2010 sågs åter aktivitet i grundsjukdomen med förhöjd halt lambdakedjor i serum. Behandling inleddes i november med en proteosomhämmare (bortezomib) och kortison i 5-veckorscykler och kunde avslutas i april 2011 då komplett remission uppnåtts.
Vid senaste årskontroll 8 år efter hjärt- och stamcellstransplantationerna bedömdes patienten vara i NYHA-funktionsklass I (New York Heart Association) och fortsatt hematologisk remission. Hennes GFR uppmättes till 36 ml/min × 1,73 m2.
Fall 2
En tidigare frisk 60-årig man remitterades i juni 2013 till kardiolog på grund av hjärtsvikt. EKG visade låg QRS-amplitud. På ultraljud sågs hypertrofi av kammarväggarna med restriktivt fyllnadsmönster och pulmonell hypertension. Koronarangiografi visade normala fynd. MR-undersökning av hjärtat ingav misstanke om inlagringssjukdom, och i augusti utfördes såväl benmärgs- som bukfettsbiopsi, som vid histologisk analys gav diagnosen AL-amyloidos. Under oktober inleddes behandling med bortezomib och kortison via hematologmottagning. Autolog stamcellstransplantation ansågs vara för riskabel på grund av dålig hjärtfunktion.
Patienten remitterades till Sahlgrenska universitetssjukhusset för kompletterande hjärtutredning. Han var i NYHA-funktionsklass III A, men klarade att arbeta någon timme per dag. Högersidig hjärtkateterisering bekräftade bilden av restriktiv kardiomyopati, och i myokardbiopsier fann man uttalad amyloidinlagring (Figur 1). Njurfunktionen var måttligt nedsatt med GFR 56 ml/min × 1,73 m2. Patienten accepterades för hjärttransplantation för att möjliggöra senare stamcellstransplantation. Man beslutade att fortsätta bortezomibbehandlingen fram till hjärttransplantationen för att hålla tillbaka grundsjukdomen så mycket som möjligt.
Patienten genomgick hjärttransplantation i mars 2014 med okomplicerat efterförlopp. Han behandlades med sedvanlig immunsuppression med takrolimus, mykofenolatmofetil och prednisolon. Han skrevs ut välmående och följdes upp med kontroller och hjärtbiopsier enligt ordinarie schema. Efter bara ett par månader hade hans fysiska funktionsförmåga återhämtat sig i det närmaste helt.
Autolog stamcellstransplantation planerades initialt till juni 2014 men fick skjutas upp flera gånger, eftersom patienten trots profylax utvecklade en primär cytomegalovirusinfektion, överförd från hjärttransplantatet. Infektionen var svårbehandlad och svarade först på tredje linjens behandling med foskarnet. I början av oktober 2014 genomgick patienten stamcellstransplantation med väsentligen komplikationsfritt förlopp förutom njursvikt och reaktivering av cytomegalovirusinfektion med påföljande foskarnetbehandling.
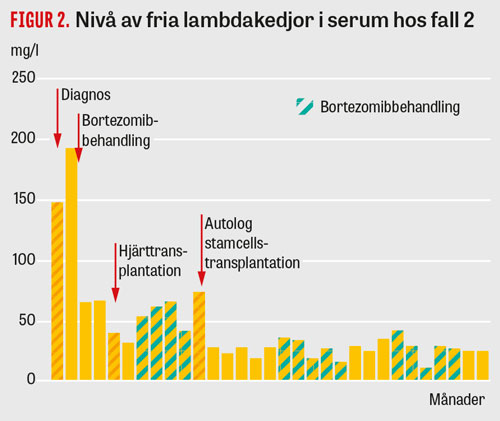
För att underlätta återhämtning av njurfunktionen gjordes i mars 2015 justering av immunsuppressionen genom tillägg av everolimus och minskad dos takrolimus. Under hösten 2016 sågs förhöjd halt lambdakedjor i serum, och patienten erhöll ett par cykler med bortezomibbehandling, varvid nivåerna av lambdakedjor normaliserades (Figur 2).
Vid 3-årskontroll efter hjärttransplantationen var patienten välmående och i NYHA-funktionsklass I. Njurfunktionen var stabilt låg med GFR 36 ml/min × 1,73 m2. Halten av fria lambdakedjor i serum var inom normala gränser.
Diskussion
Vid AL-amyloidos avgörs prognosen av ålder, grad av organengagemang och svar på behandling. Hjärtamyloidos av AL-typ orsakar restriktiv kardiomyopati med typisk koncentrisk väggförtjockning och diastolisk dysfunktion som leder till hjärtsvikt. Behandlingen är mestadels symtomatisk och styrs av vilka manifestationer som dominerar. Hjärtsviktsbehandling är en utmaning, eftersom det inte finns tydlig evidens som stöder sedvanlig behandling med neurohormonell blockad. Tvärtom är erfarenheten att patienterna ofta blir kliniskt sämre av sådan behandling.
Riktad behandling
Behandlingen inriktas på att minska produktionen av monoklonala lätta kedjor i serum, men många patienter hinner utveckla uttalad organdysfunktion innan diagnosen ställs, och mortaliteten är hög. Det finns i nuläget ingen etablerad behandling som kan lösa upp eller minska befintlig amyloidinlagring. Forskning pågår kring alternativa behandlingsmetoder som syftar till att motverka aggregering och inlagring av lätta immunglobulinkedjor [8].
Biomarkörer som NTproBNP (N-terminalt prohormon till peptid av B-typ) och troponin T är viktiga vid riskstratifiering, och ett biomarkörbaserat graderingssystem har utvecklats [9, 10]. Nivån på de fria lätta kedjorna kan ytterligare förfina riskstratifieringen [11]. En grupp med gynnsam prognos utgörs av patienter utan hjärtengagemang (återspeglas av låga nivåer av biomarkörer), låga nivåer av fria lätta kedjor och liten plasmacellsklon. I den gruppen har man med hjälp av högdos cytostatika och efterföljande autolog stamcellstransplantation [12] kunnat visa ökad överlevnad. I andra änden av prognosspektrumet finns patienter med höga nivåer av biomarkörer där medianöverlevnaden är <6 månader [11].
Patienter med avancerad AL-hjärtamyloidos tolererar inte de kraftfulla cytostatika som ges i samband med stamcellstransplantation. Dessa och äldre och skörare patienter, som inte är aktuella för autolog stamcellstransplantation, kan ges traditionell behandling med lågdos cytostatika och steroider. Under de senaste åren har proteosomhämmare och immunmodulerande läkemedel introducerats i behandlingsarsenalen med viss framgång [13-15].
Hjärttransplantation vid AL-amyloidos har länge varit kontroversiell på grund av risken för återfall av sjukdomen i transplantatet och risken för sjukdomsprogress i andra organ. Innan stamcellstransplantation var en etablerad behandling vid AL-amyloidos prövades hjärttransplantation enbart i några fall, men utfallet var dåligt med återfall i transplantatet och en 5-årsöverlevnad <30 procent [16]. De initialt dystra resultaten blev betydligt bättre då autolog stamcellstransplantation introducerades som sekventiell behandling efter hjärttransplantation, och 5-årsöverlevnaden steg till 65 procent [7, 17, 18].
Patientselektion och tajmning av transplantationerna
De urvalskriterier för hjärttransplantation som använts i studierna och som också vi tillämpat är avancerad hjärtsvikt, ålder <60 år och frånvaro av myelom och avancerad extrakardiell amyloidos. Patienter med avancerad hjärtamyloidos löper stor risk för plötslig hjärtdöd, och snabb listning för hjärttransplantation bör därför övervägas i syfte att möjliggöra efterföljande stamcellstransplantation. I de fall där man bedömer att det finns risk för lång väntan på lämpligt organ kan försiktig dosering av bortezomib i kombination med steroider övervägas under väntetiden. Sådan behandling gavs till patienten i fall 2.
Tidpunkten för autolog stamcellstransplantation efter hjärttransplantation är en avvägning mellan att å ena sidan lägga den så nära inpå som möjligt för att stoppa produktionen av lätta kedjor och förhindra ytterligare sjukdomsprogress och å andra sidan patientens mycket intensiva immunsuppression och därmed högre infektionsrisk under perioden direkt efter hjärttransplantation, vilket talar för att vänta med stamcellstransplantation. Internationellt startas oftast behandling med stamcellstransplantation inom 6–8 månader efter hjärttransplantation [7, 17].
I vårt första patientfall valde vi att påbörja behandling med stamcellstransplantation redan efter 3 månader på grund av progressiv systemisk amyloidos med hög risk för amyloidinlagring i det nya hjärtat.
Konklusion
Hjärttransplantation vid AL-amyloidos bör efterföljas av stamcellstransplantation för att få amyloidproduktionen att upphöra. För optimalt omhändertagande och selektion av dessa patienter krävs multidisciplinär erfaren kompetens i form av transplantationskardiologer, infektionsläkare, toraxkirurger, hematologer och koordinatorer.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.