Patienter med okomplicerad typ 2-diabetes kan utveckla svår ketoacidos.
En ny klass av antidiabetiska läkemedel, SGLT2-hämmare (natriumglukossamtransportör 2), förefaller i vissa fall framkalla eller förvärra ketoacidos, troligen genom att öka glukagonfrisättningen.
Denna typ av diabetisk ketoacidos är normoglykemisk och därför svår att misstänka.
Vi presenterar två fall av typ 2-diabetes av kort duration där vi bedömer att LCHF-kost utlöst och SGLT2-hämmare och metformin kan ha bidragit till intensivvårdskrävande ketoacidos.
Av de ca 450 000 personer som diagnostiserats med diabetes i Sverige har 85–90 procent typ 2-diabetes. Förekomsten av typ 2-diabetes ökar kraftigt och kryper dessutom nedåt i åldrarna [1].
Bihormonell kontroll av glukoshomeostasen
Nivåerna av glukos i plasma regleras hos friska personer huvudsakligen av de båda pankreashormonerna insulin och glukagon [2]. Kort efter födointag tas glukos upp i pankreas betaceller, och via oxidativ metabolisering börjar en kedjereaktion som leder till insulinutsöndring [3]. På liknande sätt hämmar glukos frisättningen av glukagon från pankreas alfaceller [4, 5]. Dessa två pankreashormoner är varandras motsatser, där insulin fungerar anabolt och anaplerotiskt [3] medan glukagon stimulerar katabolism och katapleros [4, 5], inte bara vad gäller glukosomsättningen utan även lipid- och proteinmetabolismen.
Jämvikten rubbad vid diabetes
Hos patienter med typ 2-diabetes ses tidigt hämmad glukoskänslig insulinfrisättning [6]. Den relativa insulinbristen, oftast i kombination med perifer insulinresistens hos överviktiga individer, leder till defekt upptag av glukos i framför allt skelettmuskulatur och fettväv. Vid typ 2-diabetes, även av kort duration, råder också en oproportionerlig hyperglukagonemi [2, 4, 5, 7, 8]. Denna bidrar inte bara till hyperglykemi – främst genom att stimulera leverns glukosproduktion – utan även till att ketogenesen stimuleras genom glukagonets lipolytiska effekter (Figur 1).
Diabetisk ketoacidos
Diabetisk ketoacidos drabbar vanligtvis patienter med typ 1-diabetes, t ex vid sjukdomsdebuten eller vid otillräcklig insulintillförsel i förhållande till aktuellt behov [9]. Eftersom patienter med typ 2-diabetes har egenproduktion av insulin anses det allmänt att de inte kan drabbas av diabetisk ketoacidos annat än i speciella undantagsfall, t ex vid kraftigt katabola situationer.
Dock är typ 2-diabetes en sjukdom med progressiv förlust av insulinproducerande betaceller [10], vilket medför att många patienter efter lång sjukdomsduration utvecklar insulinopeni liknande den vid typ 1-diabetes och således behöver tilläggsbehandling med insulin. Dessa patienter kan av denna anledning ha ökad benägenhet att utveckla diabetisk ketoacidos vid kraftigt katabola situationer med snabbt och kraftigt ökat insulinbehov. Dessutom förekommer recidiverande diabetisk ketoacidos hos patienter med »Flatbush-diabetes«, även kallad ketosbenägen typ 2-diabetes, som är en vanlig form hos individer av icke-europeisk etnicitet och som karakteriseras av såväl episodisk insulinopeni som rubbningar i glukagonproduktionen [11].
Vi presenterar här två patienter av europeiskt ursprung med typ 2-diabetes av kort duration som utvecklat intensivvårdskrävande diabetisk ketoacidos.
Fallbeskrivningar
Den första patienten var en 43-årig man med typ 2-diabetes av ca 5 års duration och fetma (BMI >33), som inkom med Kussmauls andning, illamående, kräkningar, buksmärta, polydipsi, polyuri och acetonlukt. Artärblodgasanalys visade pH 7,15, basöverskott –24,7 mmol/l, pO2 17,3 kPa, pCO2 1,3 kPa, P-glukos 22,1 mmol/l, B-laktat 1,1 mmol/l, B-ketoner 5,1 mmol/l, P-kreatinin 88 µmol/l, CRP 8 mg/l och LPK 8,6 × 109/l. Patienten hade tidigare behandlats med metformin men fått mag–tarmbiverkningar och därför avslutat behandlingen på eget bevåg.
Patienten vårdades initialt på intensivvårdsavdelningen med sedvanlig behandling av diabetisk ketoacidos och därefter på internmedicinsk akutvårdsavdelning. Vid utskrivning fick patienten sulfonylureapreparatet glimepirid mot sin typ 2-diabetes.
En månad senare insjuknade han ånyo med liknande symtom. Artärblodgasanalys visade pH 7,14, basöverskott –24 mmol/l, pO2 17,8 kPa, pCO2 1,5 kPa, P-glukos 11,5 mmol/l, B-laktat 0,9 mmol/l och B-ketoner 7,0 mmol/l. Notabelt är att hyperglykemin denna gång, trots uttalad ketoacidos, endast var måttlig. Efter första vårdtillfället hade, via primärvården, glimepirid ersatts med en kombination av metformin och SGLT2-hämmaren (natriumglukossamtransportör 2) empagliflozin (Synjardy). Patienten inlades återigen på intensivvårdsavdelningen för behandling av diabetisk ketoacidos. Patientens endogena insulinproduktion var synnerligen kraftfull, med en koncentration av C-peptid i serum på 2,7 nmol/l trots pågående behandling med höga doser insulin intravenöst.
Vid detaljerat anamnestagande framkom att patienten även före första vårdtillfället och därefter ätit lågkolhydrat-/högfettkost (LCHF). Han hade de facto intensifierat detta efter utskrivningen, eftersom han ville gå ner i vikt genom att »bränna fett«. Nivån av kolhydratfattigt transferrin (CDT) var normal, vilket talade emot alkoholorsakad ketoacidos [12] som bidragande faktor. Patienten informerades om riskerna med LCHF-kost vid diabetes och skrevs ut med metformin, GLP-1-receptoragonisten (glukagonlik peptid 1) liraglutid och insulin glargin.
Den andra patienten var en 55-årig man med 2 års duration av typ 2-diabetes behandlad med metformin i lågdos. Han hade hereditet för typ 2-diabetes och bukfetma (midjemått 147 cm). Han behandlades med flukloxacillin via primärvården på grund av infektion i ljumsken, men sökte akut till följd av utebliven förbättring och hade vid ankomsten kraftig hypotoni (blodtryck 70/46 mm Hg), takykardi (puls 109/min) och diabetisk ketoacidos med pH 7,21, basöverskott –18 mmol/l, pO2 12,6 kPa, pCO2 1,9 kPa, P-glukos 46,0 mmol/l, B-laktat 1,6 mmol/l och B-ketoner 5,6 mmol/l, P-kreatinin 248 µmol/l, CRP 221 mg/l och LPK 9,7 × 109/l.
Patienten lades in på intensivvårdsavdelningen med septisk chock och diabetisk ketoacidos. Utöver sedvanlig behandling av diabetisk ketoacidos med bl a insulin intravenöst i höga doser var patienten i behov av vasopressorstöd med noradrenalin.
Även denna patient hade ätit LCHF-kost i bantningssyfte samtidigt som han medicinerade med metformin. Efter det att ketoacidosen hävts vårdades patienten på akutvårdsavdelning och skrevs därefter ut med enbart höga doser insulin i basal bolusregim som antidiabetisk terapi.
Diskussion
Gemensamt för dessa båda patienter är typ 2-diabetes och ketogen LCHF-kost. Denna kostregim innebär ett oförändrat intag av proteiner och minskad mängd kolhydrater till förmån för ökat fettintag. Bantning med LCHF-kost förekommer hos patienter med typ 2-diabetes, eftersom dessa patienter vanligtvis fått sin diabetes just till följd av övervikt [1]. Vetenskapligt underlag för gynnsamma långtidseffekter av LCHF-kost saknas dock, liksom analyser av de risker som kan vara förknippade med ökat fettintag. Genom sitt höga fettinnehåll är denna kost ketogen, något som är välkänt i LCHF-kretsar. Nivåer av B-ketoner uppemot 5 mmol/l förekommer vid strikt LCHF-kost, medan samtidig acidos (ketoacidos) däremot är sällsynt om inte insulinbrist också föreligger [13-17].
Bägge våra patienter uppvisade uttalad ketos, vilket brukar anses som mycket ovanligt bland patienter med typ 2-diabetes och kvarvarande egen insulinproduktion. Vi bedömer att LCHF-kosten varit drivande i dessa patienters ketos.
Det är emellertid viktigt att betänka att insulinbrist inte behöver vara absolut, utan kan vara relativ till för stunden rådande behov i en dynamisk process där bl a balansen mellan insulin och glukagon kan vara avgörande [7, 8]. Utöver LCHF-kost är noradrenalinbehandling och pågående kraftig infektion katabola processer och får, tillsammans med metformin, anses ytterligare ha bidragit till den ketogena situationen som utlöst diabetisk ketoacidos hos patient 2.
Den senaste klassen antidiabetiska läkemedel mot typ 2-diabetes, SGLT2-hämmare [18, 19], har genom övertygande positiva effekter på hårda utfallsvariabler [20] mycket rättmätigt fått starka rekommendationer av olika läkemedelsmyndigheter globalt.
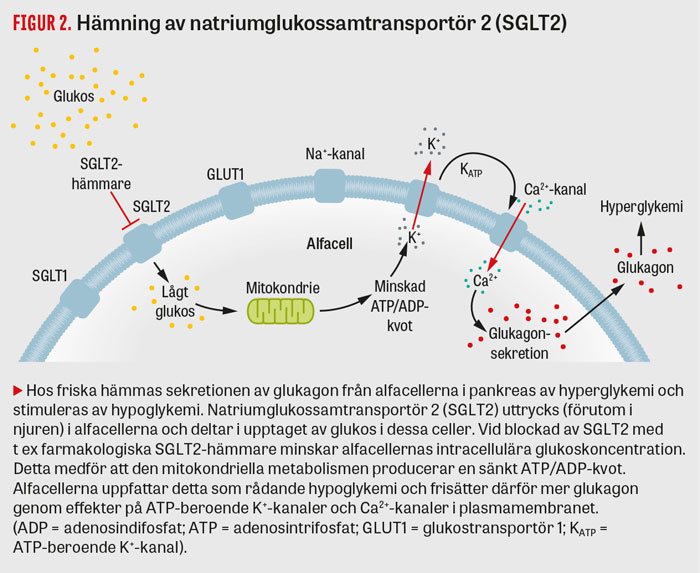
SGLT2-hämmare minskar reabsorptionen av glukos i njurarna, vilket medför ökad glukosuri, och glykemin reduceras därigenom oberoende av insulin [18, 19]. Denna läkemedelsklass har i vissa fall visats vara förknippad med normoglykemisk diabetisk ketoacidos hos patienter med såväl typ 1-diabetes som typ 2-diabetes vid olika stressituationer [20-22]. Mekanismerna för denna oväntade effekt började nystas upp efter att man funnit ökad endogen glukosproduktion hos patienter med typ 2-diabetes som behandlades med SGLT2-hämmaren dapagliflozin [23]. Man fann bl a att SGLT2 uttrycks i de glukagonproducerande alfacellerna och att hämning av SGLT2 kan resultera i ökad glukagonsekretion [24, 25] (Figur 2). Detta glukagonöverskott i förhållande till låga koncentrationer av insulin anses kunna inducera och driva ketosen hos patienter som behandlas med SGLT2-hämmare.
Då SGLT2-hämning samtidigt leder till sänkning av P-glukos på grund av ökad glukosuri, utvecklas en atypisk – normoglykemisk – ketoacidos som av just denna anledning kan vara svår att misstänka kliniskt. De vanliga symtomen på ketoacidos – illamående, kräkningar, uttalad trötthet och dyspné på grund av Kussmauls andning – förekommer men kan i frånvaro av förväntad hyperglykemi lätt negligeras.
Eftersom patient 1 mellan första och andra vårdtillfället påbörjat behandling med SGLT2-hämmare och hade mer uttalad ketonemi vid andra vårdtillfället (7,0 mmol/l jämfört med 5,1 mmol/l), trots avsevärt mycket lägre P-glukos (11,5 mmol/l jämfört med 22,1 mmol/l), får det anses sannolikt att SGLT2-hämning bidragit till att aggravera patientens ketoacidos, som var nära normoglykemisk. Även metformin kan naturligtvis ha bidragit. Det är också intressant att notera att denna patients ketoacidos utvecklades trots synnerligen kraftfull insulinproduktion.
Trots mångårig förskrivning och erfarenhet av metformin ska man inte glömma dess baksidor och kontraindikationer, många relaterade till läkemedlets favorisering av anaerob metabolism. Det är välkänt att metformin bör utsättas vid svåra infektioner, intorkning och undersökningar med kontrast, eftersom det tenderar att öka redan stegrade kreatininvärden. Laktacidos är sällsynt men kan uppträda då metformin ackumuleras till följd av akut försämrad njurfunktion.
Ovanstående fall ska inte tas till intäkt för minskad användning av SGLT2-hämmare vid typ 2-diabetes. Tvärtom bör dessa, i ljuset av mycket positiva resultat på hårda effektmått [20], definitivt förskrivas i enlighet med nationella riktlinjer [26, 27]. Dock tillråds försiktighet hos patienter med långvarig (potentiellt insulinopen) typ 2-diabetes och/eller samtidig LCHF-kost samt vid kraftigt katabola situationer. SGLT2-hämmare, liksom metformin, bör undvikas vid alla tillstånd med ökad ketosbenägenhet, även vid fasta (t ex vid ramadan), allvarliga infektioner samt intorkning.
Det är naturligtvis viktigt att veta hur man bäst mäter ketos och vad det, mer precist, är man egentligen mäter. De tre ketonkroppar som har humanpatologisk relevans är betahydroxibutyrat, acetoacetat och aceton. Betahydroxibutyrat är den keton som förekommer i cirkulationen och som mäts som B-ketoner. Koncentrationen hos friska vuxna efter en natts fasta underskrider normalt 0,2 mmol/l. Acetoacetat utsöndras i urinen och är den keton som detekteras med U-sticka. Aceton metaboliseras och elimineras huvudsakligen via lungorna. Om en frisk person fastar mer än 4 dagar genom att sänka sitt kolhydratintag till <20 g per dag används kroppens glukosdepå. I fasta bildas acetylkoenzym A, som via ketogenes bildar ketonerna acetoacetat, betahydroxibutyrat och aceton [14].
Man mäter således olika ketoner i blod respektive urin, vilket inte är allom känt, och detta har relevans även ur ett tidsperspektiv. Analys av B-ketoner ger en ögonblicksbild, medan däremot U-ketoner ackumuleras över längre tid. Situationen är analog med mätning av P-glukos jämfört med U-glukos. Varje akutmottagning, akutvårdsavdelning, intensivvårdsavdelning, ambulans och primärvårdsenhet ska ha tillgång till B-ketonmätare (inklusive stickor). Dessa är numera enkla och billiga, och åtskilliga diabetespatienter med labil glykemi har själva sådana mätare i hemmet.
Potentiella bindningar eller jävsförhållanden: Peter Magnusson och Åke Sjöholm har uppburit föreläsnings- och konsultarvoden från Boehringer-Ingelheim, som tillverkar SGLT2-hämmaren empagliflozin.