Kreatininhalten i plasma/serum och eventuell förekomst av proteinuri har länge utgjort grundstenarna vid diagnos och uppföljning av njursjukdom.
Dessa analyser är föråldrade och bör ersättas av nya, med bättre diagnostisk precision.
U-albumin/kreatininkvoten informerar om både reversibel och irreversibel glomerulär skada.
U-protein HC/Kreatininkvoten informerar om tubulär skada,
Estimerad GFR (eGFR), i form av medelvärdet av eGFR baserad på cystation C respektive kreatnin ger den hittills bästa uppskattningen av GFR och innebär att 90–95 procent av alla GFR-skattningar ligger inom ±30 procent av GFR uppmätt med invasiva clearancemetoder med användning av t ex johexol eller 51Cr-EDTA.
Njurarna har många funktioner, varav en av de viktigaste är att filtrera bort småmolekyler från blodet. Denna funktion mäts som glomerulär filtrationshastighet (GFR, glomerular filtration rate). Att känna till en patients GFR är väsentligt för att bedöma patientens allmänna njurstatus, hur ett njurutsöndrat läkemedel ska doseras och hur mycket njurutsöndrade kontrastmedel som ska ges vid en undersökning, och för att bedöma risken för att en aktuell njursjukdom ska progrediera. Sänkt GFR är också kopplad till ökad risk för kardiovaskulär sjukdom och komplikationsrisk vid kontrastmedelsinjektioner och större kirurgiska ingrepp. Den utbredda kunskapen om vikten av att känna till GFR hos en patient avspeglas genom att en av de analyser inom klinisk kemi som används för att skatta GFR, plasmahalten av kreatinin, är en av de två mest frekvent beställda analyserna i Sverige, och i de flesta andra länder. Den andra är B-hemoglobin.
Trots att det ur många synvinklar är viktigt att känna till en patients GFR är det kanske ännu viktigare att känna till patientens urinutsöndring av albumin, eftersom denna kunskap inte bara identifierar irreversibla njurskador utan också tidiga, reversibla njurskador. Även vikten av kunskap om en patients urinalbuminutsöndring avspeglas i det faktum att den vanligaste urinanalys som utförs i Sverige gäller just urinens innehåll av albumin.
Abnormt urinproteinmönster
Den första rapporten om abnormt urinproteinmönster (proteinuri, Fakta 1) kom för cirka 2 400 år sedan från Hippokrates och hans lärjungar [1] som noterade att »när det bildas bubblor på urinens yta visar detta på njursjukdom«. Det dröjde sedan ungefär 2 100 år innan nästa framsteg gjordes av Frederik Dekkers, som år 1694 publicerade en artikel om hur »mjölk« kan mätas i urin genom värmning och tillsats av stark syra, vilket ledde till utfällning av urinens proteiner [2].
Före Dekkers uppträdde under medeltiden s k »pisseprofeter« som, genom att studera utfällningsmönstret i urin som fått stå i nattkärlet under några timmar, ansåg sig kunna uttala sig om ett flertal sjukdomar; ett kvacksalveri som den tidens läkare kände till och varnade för [3]. Läkarna själva hade ingen annan möjlighet att analysera abnormt urinproteinmönster än den metod som beskrivits av Hippokrates. Syrafällningsmetoden används än i dag, 300 år efter Dekkers’ beskrivning, av många laboratorier för att identifiera abnormt urinproteinmönster (totalprotein, Fakta 2), trots att det alltsedan Bence Jones’ arbeten på 1860-talet [4] står helt klart att mätning av specifika proteiner i urin har mycket bättre diagnostisk potential än mätning av totalprotein.
Hyperalbuminuri
I dag är det uppenbart att specifik immunkemisk mätning av albuminutsöndringen i urin är den mätning av proteinuri som har störst klinisk relevans. Albuminhalten i urin bör inte mätas som en masskoncentration (t ex mg/l), utan som en kvot mellan urinhalterna av albumin och kreatinin, d v s en U-albumin/kreatininkvot uttryckt som t ex mg/mmol. U-albumin/kreatininkvoten (ACR, albumin-creatinine ratio) kallas i Sverige också, något felaktigt, U-albumin–kreatininindex. Den diagnostiska överlägsenheten hos kvoten beror på att urinalbuminhalten uttryckt som mg/l varierar mer med patientens diures än med njursjukdomen [5-9]. U-albumin/kreatininkvoten varierar däremot väsentligen endast med graden av patientens njursjukdom.
Det är ett väletablerat faktum att det finns ett signifikant och exponentiellt samband mellan en individs U-albumin/kreatininkvot och risken för utveckling av allvarlig njursjukdom, dialysberoende och insjuknande i hjärtinfarkt, liksom med ökad risk för sjukhusinläggning och död [10]. Sådana samband är betydligt svagare om urinalbuminhalten mäts som mg/l [7]. Sambanden med U-albumin/kreatininkvoten är däremot så starka att de gäller även inom normalområden för kvoten [10]. Kvalitetssäkringsorganisationen Equalis har visat att även flera patientnära instrument kan leverera pålitliga kvoter, och primärvårdscentraler kan och bör således mäta urinalbuminhalten som U-albumin–kreatininkvot.
Albuminhalten bör alltid mätas med immunkemisk metodik, eftersom färgbindningsmetoder är mindre precisa och störs av andra proteiner. Kreatininhalten i urin kan mätas framgångsrikt även med enkla s k Jaffe-metoder, eftersom den relativa halten av pseudokreatininer är låg i urin. När det gäller referensvärden för U-albumin/kreatininkvoten uppnås bäst diagnostisk sensitivitet och specificitet om man ger separata referensvärden för män och kvinnor, och för morgonurinprov respektive urinprov från andra tidpunkter på dygnet [11]. Man kan med gott diagnostiskt resultat använda gränsen under 3 mg albumin/mmol kreatinin som referensvärde för de olika kategorierna.
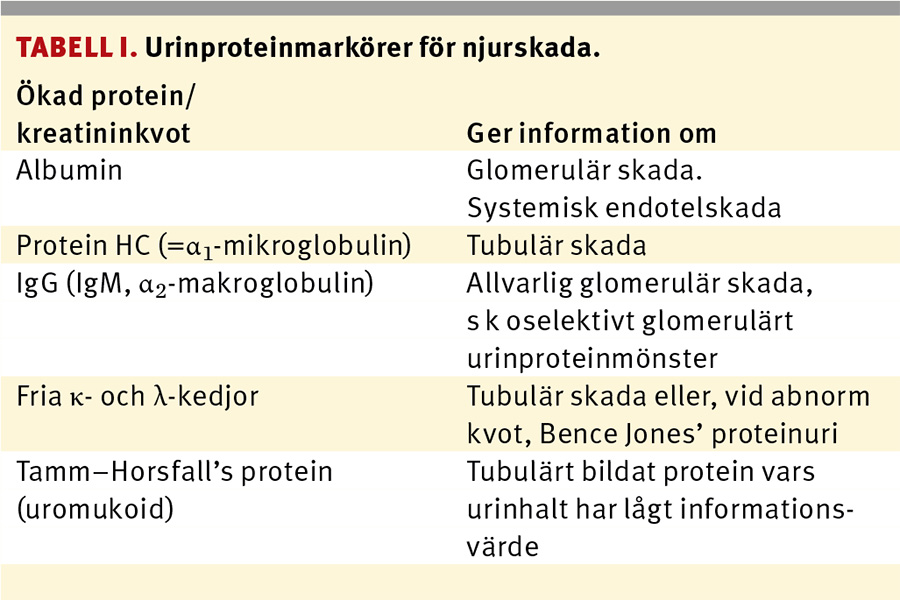
Specifika abnorma urinproteinmönster
För att öka det diagnostiska utbytet kan man, förutom U-albumin/kreatininkvoten, också mäta urinutsöndringen av protein HC (α1-mikroglobulin), IgG och fria lätta immunglobulinkedjor, d v s fria κ- och λ-kedjor (Tabell I). Även utsöndringen av dessa bör mätas som kreatininkvoter, av samma skäl som för albumin/kreatininkvoter [11]. Ökad U-protein HC/kreatininkvot (tubulärt urinproteinmönster) informerar om tubulära/interstitiella njurskador, ökad U-IgG/kreatininkvot visar tillsammans med ökad U-albumin/kreatininkvot (s k oselektivt glomerulärt proteinurimönster) på värre glomerulära skador än vid enbart ökad U-albumin/kreatininkvot (s k selektivt glomerulärt urinproteinmönster). Parallellt ökade kreatininkvoter för de båda typerna av fria lätta immunglobulinkedjor visar, liksom ökad U-protein HC/kreatininkvot, på tubulära/interstitiella njurskador. Däremot påvisar selektivt ökad kreatininkvot för endast den ena typen av fri lätt immunglobulinkedja (Bence Jones’ proteinuri) vanligen malign plasmacellsproliferation, t ex vid myelomatos, och behöver inte indikera njurskada, även om njurskada ofta uppkommer vid Bence Jones’ proteinuri.
I stället för att mäta urinutsöndringen av de proteiner som nämnts som en kreatininkvot i ett stickprov urin kan man med i princip samma diagnostiska potential mäta dygnsutsöndringen av proteinerna uttryckt som t ex mg/dygn [12]. Dock har det visat sig att det är mycket svårt att i praktiken samla in och mäta en dygnsmängd urin. Därför är mätningar av specifika proteiner som mg/mmol kreatinin i stickprov av urin att föredra i de flesta kliniska situationer.
Mätning och estimering av GFR
Mätning av GFR. GFR kan aldrig mätas direkt, eftersom det inte går att mäta mängden primärurin producerad per tidsenhet genom att kanylera de 1–2 miljoner nefron som utgör njurarna. Det bästa måttet på GFR får man därför genom att göra så kallade renala clearanceundersökningar. I dessa injiceras intravenöst en substans som endast utsöndras genom glomerulär filtration och inte återresorberas eller utsöndras i nefronens övriga segment. Genom mätning dels av mängden av substansen i urin utsöndrad under en viss tidsrymd, dels av substansens medelkoncentration i plasma, kan GFR beräknas i ml/min.
Inulin (en polysackarid på cirka 5 000 Da) var det första ämne som säkert påvisades ha dessa egenskaper och renal inulinclearance som etablerades av Homer William Smith i början av 1930-talet anses därför av tradition vara den bästa metoden att mäta GFR [13, 14]. Det är också den metod alla senare clearancemetoder jämförs med när deras duglighet att mäta GFR ska bedömas.
För att bestämma renal inulinclearance ger man patienten en hög intravenös dos av inulin, och därefter en kontinuerlig venös infusion, så att plasmahalten är konstant under de tidsperioder då man samlar urin. Detta gör man för att kunna räkna ut hur mycket inulin som utsöndras under dessa perioder. Att bestämma renal inulinclearance är en invasiv, långsam, svåranalyserad och dyr procedur som numera sällan används. I stället använder man förenklade procedurer och mer lätthanterliga markörer för att mäta GFR. I Sverige används framför allt johexol [15] och 51Cr-EDTA [16]. Det finns också andra markörer som kan användas för att mäta GFR. En uttömmande vetenskaplig värdering av alla hittills använda metoder har nyligen gjorts av SBU [17].
Studier av humana njurar av Rehberg m fl på 1920- och 1930-talen [18] indikerade att plasmahalten av kreatinin och/eller s k endogen kreatininclearance kunde användas som indikatorer för GFR, och det föreslogs att endogen kreatininclearance t o m kunde jämställas med renal inulinclearance som mått på GFR. Dock klarlade Shannon redan år 1935 att kreatinin utsöndras inte bara genom glomerulär filtration utan också genom tubulär sekretion. Endogen kreatininclearance kunde därför inte vara ett lika gott mått på GFR som renalt inulinclearance [19]. GFR mätt som endogen kreatininclearance visade bl a en genomsnittlig övervärdering av GFR på 39 procent i dessa tidiga studier. Trots det är endogen kreatininclearance den i Sverige mest använda metoden för att mäta GFR. Senare studier har tydligt visat att den tubulära utsöndringen av kreatinin ökar med sänkningen av GFR [20]och att den påverkas av många läkemedel. En omfattande utvärdering av förmågan hos endogen kreatininclearance att mäta GFR har nyligen genomförts av SBU [17].
Estimering med kreatinin. I dag är kreatininhalten i plasma eller serum fortfarande den vanligast använda markören för GFR trots att kreatininhalten påverkas av (förutom GFR) muskelmassa, en varierande tubulär kreatininutsöndring, köttinnehåll i kosten samt läkemedel som påverkar den tubulära utsöndringen av kreatinin [21-23]. Kreatininhalten speglar inte heller dygnsvariationen av GFR, eftersom dygnsvariationen av den tubulära utsöndringen av kreatinin är invers mot GFR-dygnsvariationen [24]. För att förbättra kreatininhalten som mått på GFR har man sedan 1970-talet använt olika s k GFR-prediktionsekvationer för att minska/kompensera muskelmassans inflytande på kreatininhalten. Dessa olika prediktionsekvationer, exempelvis Cockcroft–Gault, MDRD (Modification of diet in renal disease), CKD-EPI (Chronic Kidney Disease Epidemiology), LM (Lund–Malmö) kompenserar dock inte för andra icke-GFR-relaterade faktorer [25-30].
Ett ytterligare problem är att de, eftersom de använder parametrar som kön, ålder och etnicitet, endast korrigerar för medelmuskelmassan hos en individ av en viss ålder, ett visst kön och etniskt ursprung i den population ur vilken man genererar prediktionsekvationen. Den fungerar med andra ord inte för individer av samma ålder, kön och etniskt ursprung om de har en muskelmassa som avviker från medelmuskelmassan [23, 31], vilket gäller t ex vid låg muskelmassa i samband med anorexi, paralys, malnutrition eller neoplastisk kakexi.
En annan svårighet med prediktionsekvationer är att de blir specifika för medelmuskelmassan hos just den population av individer som använts för att generera den aktuella prediktionsekvationen. MDRD baseras på en population av njursjuka individer som har en mindre medelmuskelmassa än en population av njurfriska. Därför underestimerar MDRD-ekvationen GFR hos njurfriska med cirka 30 procent [31]. CKD-EPI baseras liksom LM-ekvationen på en population av både njursjuka och friska individer.
Ytterligare en svårighet med kreatininbaserade ekvationer är att de, för optimalt resultat, kräver att läkaren eller patienten själv korrekt identifierar patientens etnicitet. Etnicitetsbegreppets vaghet och svaga vetenskapliga förankring gör en sådan identifiering osäker/omöjlig [23]. Det är också etiskt problematiskt att försöka fastställa någons etnicitet.
Ännu en svårighet med alla kreatininbaserade GFR-prediktionsekvationer, frånsett LM-ekvationen, är att de kräver speciella GFR-prediktionsekvationer för barn (t ex Schwartz, Counahan–Barratt) [30, 32-33].
Estimering med cystatin C. Sedan 1979 är det känt att även plasma- och serumhalten av cystatin C är en markör för GFR [23, 34-37]. Cystatin C-halten varierar betydligt mindre än kreatininhalten med patientens muskelmassa, etniska bakgrund och ålder, och inte alls med tubulär sekretion, tubuluspåverkande läkemedel eller köttinnehållet i måltider. Därför kan cystatin C-baserade GFR-prediktionsekvationer av den enkla typen GFR = A × cystatin C-B, där A och B är konstanter, användas med lika god diagnostisk förmåga som betydligt mer komplicerade kreatininbaserade GFR-prediktionsekvationer som innehåller etnicitetstermer [23]. Dock måste man vara uppmärksam på att höga doser av kortikosteroider ökar syntesen av cystatin C så att cystatin C-halten i dessa fall inte korrekt återspeglar GFR [23, 38].
Fram till år 2010 [39] fanns ingen internationellt fastställd kalibrator för cystatin C, vilket försvårat användningen av och möjligheten att jämföra olika metoder att mäta cystatin C-halten. För närvarande pågår ett standardiseringsarbete bland de bolag som tillverkar reagens för bestämning av cystatin C-halter som bl a innebär att alla ska basera sina bestämningsmetoder på den internationella cystatin C-kalibratorn ERM-DA471/IFCC. Arbetet har ännu inte resulterat i en minskad spridning mellan de metoder som är i bruk i Sverige, men förväntas göra det under 2013.
Estimering med både cystatin C och kreatinin. För att karakterisera den diagnostiska förmågan hos en GFR-prediktionsekvation brukar man ange hur många procent av estimerat GFR som hamnar inom ± 30 procent av GFR mätt med en invasiv metod (t ex inulin-, johexol- eller 51Cr-EDTA-clearance) hos alla individer i en relevant population; t ex de patienter vars GFR mätts på ett visst laboratorium på läkares ordination. För de bästa cystatin C- och kreatininbaserade GFR-prediktionsekvationerna (eGFRcystatin C och eGFRkreatinin) uppgår denna andel till 80–85 procent [23]. De bästa GFR-prediktionsekvationerna är dock de som baseras på samtidig bestämning av både cystatin C- och kreatininhalter (eGFRcystatin C + kreatinin) = eGFmedel, där 90–95 procent av samtliga uppskattningar ligger inom ± 30 procent av uppmätt GFR [23, 40]. Sådana ekvationer kan vara kombinationsekvationer, där termer för både cystatin – C- och kreatininhalter ingår (förutom mått som kön, ålder och etnicitet), eller medelvärdesekvationer, där eGFR beräknas som medelvärdet av eGFRcystatin C och eGFRkreatinin [23, 41]. En fördel med den senare modellen är att man genom att jämföra eGFRcystatin C och eGFRkreatinin kan göra en bedömning av hur säker estimeringen av GFR är [23, 42]. Ju närmare eGFRcystatin C och eGFRkreatinin ligger varandra, desto säkrare är medelvärdet som estimering av GFR [42].
Vid laboratorier där både cystatin C- och kreatininbaserade GFR-prediktionsekvationer använts under många år noteras inte sällan att de invasiva procedurerna för mätning av GFR ger värden som markant avviker från eGFRcystatin C och eGFRkreatinin trots att dessa estimeringar visar god inbördes överensstämmelse. I samtliga fall där bakgrunden kunnat utrönas har det visat sig att det varit tekniska fel, eller svårigheter med den invasiva GFR-mätningen, som legat bakom skillnaderna i uppmätt och estimerat GFR [23].
Mot bakgrund av vetenskap och beprövad erfarenhet är U-albumin/kreatininkvot och eGFRcystatin C + kreatinin = eGFRmedel de bästa basanalyserna för att diagnostisera och följa njursjukdom. Kvaliteten av GFR-estimeringen bör samtidigt bedömas från kunskapen om eGFRcystatin C och eGFRkreatinin.
Kostnaderna för analyserna är inom Labmedicin Skåne 19 kronor för U-albumin/kreatininkvot och 33 kronor (24 + 9 kronor) för eGFRcystatin C + eGFRkreatinin. Det kan jämföras med att kostnaden för datortomografi av njure med kontrast inom Region Skåne är ca 2 500 kronor, och att ett års sjukvårdkostnader för hemodialysbehandling beräknas till ca 600 000 kronor.
Det har länge tagits för givet, men inte visats vetenskapligt, att uppmätt GFR bäst indikerar både njurfunktion och risk för uppkomst av relaterade händelser som hjärtinfarkt, hemodialysberoende, sjukhusinläggning och död. Flera studier under senare år pekar tydligt på att så inte är fallet. Det är därför sannolikt att eGFRmedel kommer att användas för att bedöma njurfunktion och för att dosera njurutsöndrade kontrast- och läkemedel, medan eGFRcystatin C eller endast cystatin C-halten, tillsammans med U-albumin/kreatininkvoten, kommer att vara den bästa parametern för att prognostisera hjärtinfarkt, hemodialysberoende, sjukhusinläggning och död [43-47].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Proteinuri
Begreppet proteinuri härstammar från den tid då analysmetodernas känslighet var så låg att endast ökad halt av totalprotein i urin kunde upptäckas.
Moderna immunkemiska analysmetoder visar att alla människor, friska som sjuka, har mätbara mängder av en lång rad olika proteiner i urinen och att både abnormt låga och abnormt höga halter av dessa kan indikera njursjukdom.
Begreppsparet ingen proteinuri–proteinuri borde därför bytas mot normalt proteinurimönster–abnormt proteinurimönster med specificeringar som selektivt (oselektivt) glomerulärt och tubulärt urinproteinmönster.
Fakta 2. Totalprotein
Begreppet totalprotein härstammar från den tid då det inte fanns metoder för att mäta enskilda proteiner i urin.
Reproducerbar mätning av totalprotein, och överensstämmande värden mellan olika laboratorier, omöjliggörs genom att olika metoder för totalprotein ger olika värden för en och samma mängd protein och genom att det saknas en internationell kalibrator för totalprotein.