Antalet anmälda fall av invasiva infektioner orsakade av grupp A-streptokocker, såsom nekrotiserande fasciit och streptokocktoxiskt chocksyndrom, har under 2012 varit det högsta sedan 2004, och ökningen har fortsatt under 2013.
Dödligheten vid invasiv infektion med grupp A-streptokocker är hög, och det är av yttersta vikt att diagnostisera och behandla infektionen tidigt.
Ökad incidens kräver ökad vaksamhet, och därför är klinisk anmälan och laboratorieanmälan enligt smittskyddslagen viktig.
Vissa undertyper av grupp A-streptokocker ger oftare svår sjukdom, och epidemiologisk typning kan förbättra övervakningen.
Förebyggande behandling av kontakter till allvarliga fall är sällan indicerad, men kan övervägas, t ex om man identifierat flera allvarliga fall inom en grupp.
Betahemolytiska streptokocker grupp A (grupp A-streptokocker, GAS, Streptococcus pyogenes) är hos människa en vanlig patogen som kan ge varierande symtombild, från lindrig faryngit och impetigo till allvarliga sjukdomstillstånd som nekrotiserande fasciit och streptokocktoxiskt chocksyndrom (STSS; streptococcal toxic shock syndrome). Bärarskap ska normalt inte behandlas, och en behandlingsrekommendation för faryngotonsillit togs fram av Läkemedelsverket och Smittskyddsinstitutet hösten 2012 [1].
Förr associerades bakterien med framför allt barnsängsfeber, scharlakansfeber och postinfektiösa tillstånd som reumatisk feber och akut glomerulonefrit. I västvärlden i dag är det framför allt invasiva infektioner, inkluderande nekrotiserande fasciit och STSS, som är visserligen ovanliga men mycket allvarliga konsekvenser av GAS-infektion.
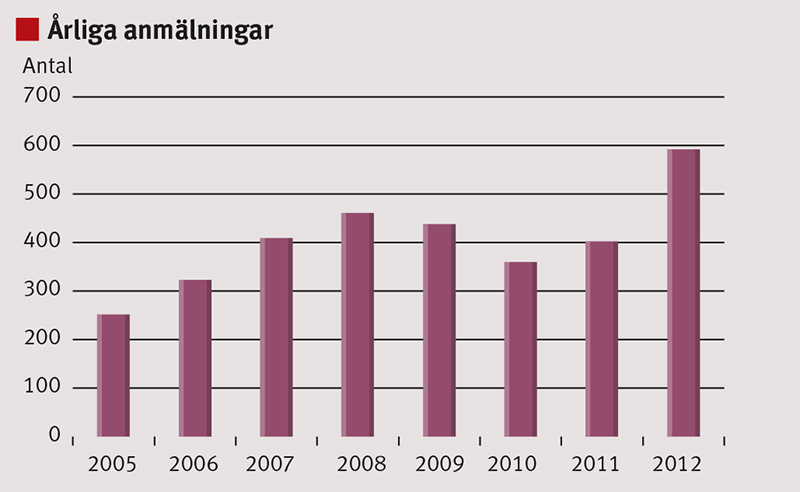
Allvarliga infektioner av GAS rapporteras varje år i låg frekvens men vissa år i ökat antal. Under 2012 anmäldes 584 fall, det högsta antalet sedan invasiv GAS-infektion blev anmälningspliktig 2004, och ökningen har fortsatt under början av 2013.
Allvarliga fall väcker frågor kring invasiv GAS-infektion
I Fakta 1 beskrivs två mycket allvarliga infektionsförlopp av invasiva GAS, kopplade till en tydlig smittspridning i förskolemiljö. Dessa fall aktualiserar flera frågor.
- Hur goda är våra behandlingsmöjligheter vid dessa mycket svåra infektionstillstånd, som kan drabba tidigare helt friska unga individer, ibland med stympande ingrepp som följd?
- Vad kan vi göra för att hotande, svåra infektioner ska kunna identifieras tidigt i förloppet?
- Hur vanligt är det att vi ser flera invasiva GAS-infektioner kopplade till en familj eller annan grupp, eller till annan synlig smittspridning?
- Finns det möjligheter till, och evidens för, profylaktiska åtgärder?
- Hur vanlig är invasiv GAS-infektion, och har vi rapportering och typning som ger en fullständig bild av problemet?
- Hur kan vi förbättra övervakningen av dessa infektioner?
Nedan försöker vi belysa en del av dessa frågor.
Chocksyndrom relativt nyligen uppmärksammad sjukdom
Under slutet av 1980-talet rapporterades ett ökat antal svåra sjukdomstillstånd orsakade av invasiva GAS-infektioner i västvärlden. Första fallet av ett STSS-liknade syndrom rapporterades 1987 [2], och 1993 publicerades en klassificering av GAS-infektioner och falldefinition av STSS [3].
Definitionen av STSS [3] (Fakta 2) är klinisk hypotoni (systoliskt blodtryck under 90 mm Hg hos vuxna) i kombination med påverkan på två eller flera organ. Hit räknas påverkan på njurfunktion, leverfunktion, koagulation eller lungor (med akut svår andningsinsufficiens [ARDS; acute respiratory distress syndrome). Dessutom uppträder ibland ett skarlatiniformt exantem och smultrontunga, vilket kan följas av fjällning. Även nekrotiserande mjukdelsinfektion som nekrotiserande fasciit, myosit eller gangrän räknas som organpåverkan.
För att konfirmera ett misstänkt fall av STSS krävs växt av GAS i en steril lokal. Trots det allvarliga förloppet finner man växt i blododlingar i endast 60 procent av fallen [2, 4]. I de fall där man finner växt av GAS endast i en icke-steril lokal vid klinisk bild förenlig med STSS sätts diagnosen trolig STSS. Även trolig STSS ska anmälas enligt smittskyddslagen.
Den vanligaste fokala manifestationen vid invasiv GAS-infektion är hud- och mjukdelsinfektion [5]. Ofta rör det sig om äldre individer med erysipelas/cellulit kombinerat med positiv blododling. Omvänt är blododling positiv i under 5 procent vid erysipelas/cellulit [6]. Även ytliga hudinfektioner kan utgöra fokus för invasiv GAS-infektion. Nekrotiserande fasciit är relativt ovanlig som utgångsfokus vid invasiv GAS-infektion, ofta mindre än 10 procent. Vanligare är bakteriemi utan identifierat fokus.
Pneumoni förekommer oftare hos barn än hos vuxna, ibland med utveckling av empyem. Faryngotonsillit eller annan övre luftvägsinfektion är ovanlig som utgångsfokus vid invasiv GAS-infektion [1]. Utveckling av STSS ses oftare hos patienter med nekrotiserande fasciit, pneumoni eller bakteriemi utan identifierat fokus [5].
Patogenesen vid invasiv GAS-infektion och streptokocktoxiskt chocksyndrom är inte fullt klarlagd. Såväl värdfaktorer, som ålder och underliggande sjukdomar, som bakteriella toxiner och immunitet mot dessa har betydelse [2, 4, 5]. GAS producerar både ytproteiner som försvårar fagocytos och exotoxiner med flera olika angreppsmekanismer, bl a som superantigener med stor betydelse för inflammatoriska reaktioner. Superantigener binder till MHC II-receptorer och T-cellsreceptorer samtidigt utan konventionell antigenpresentation och ger därmed upphov till massiv aktivering av T-celler och produktion av cytokiner [2].
Snabbt insatt terapi är nödvändig
GAS är alltid helt känsliga för penicillin. Ingen penicillinresistens finns rapporterad. Men vid stora infektionsinokulat kan bakterierna bli långsamväxande och gå in i en stationär fas, varvid penicillinbindande proteiner på cellytan nedregleras [7]. Därmed minskar effekten av penicillin. Vid stora mängder av GAS i vävnaden, som vid nekrotiserande fasciit, har därför penicillin inte lika bra klinisk effekt som vid lindrigare streptokockinfektioner.
Klindamycin anses ha gynnsam effekt i sådana situationer och påverkas inte av inokulatets storlek. Klindamycin hämmar den bakteriella proteinsyntesen. Detta kan minska produktionen av toxiner och M-protein, vilket i sin tur underlättar fagocytos. Andra faktorer som kan bidra till god effekt av klindamycin är längre halveringstid än penicillin och intracellulär effekt [4]. Klindamycin rekommenderas därför som tillägg till penicillin vid svår invasiv GAS-infektion. Resistens mot klindamycin är ovanlig, men resistensbestämning av GAS-isolatet rekommenderas.
Det finns flera rapporter om god effekt av högdos intravenöst immunglobulin (ivIg) vid svår invasiv GAS-infektion. Ökad överlevnad, snabbare återhämtning från organsvikt och minskat behov av kirurgiska ingrepp har rapporterats [8, 9]. En randomiserad multicenterstudie av ivIg som tilläggsbehandlig vid STSS fick avbrytas på grund av att för få patienter kunde inkluderas. Överlevnaden var större i gruppen som fick ivIg, men skillnaden var inte statistiskt signifikant [8]. I Storbritannien rekommenderas ivIg om patienten inte svarar på aktiv behandling, fokus inte går att revidera eller om patienten har kvarstående oliguri och lungödem [2].
I behandlingsrekommendationer för svår sepsis och septisk chock från Läkemedelsverket 2004 anges ivIg som möjlig tilläggsbehandling vid misstänkt GAS-infektion och septisk chock [10].
ivIg verkar genom flera mekanismer, bl a genom att neutralisera superantigener, hämma komplementaktivering och underlätta opsonisering av bakterier. Genom att lägga till ivIg i behandlingen minskas den inflammatoriska kaskaden [8].
Tidig diagnos och behandling är av stor betydelse. Tydliga fokala symtom kan saknas vid invasiv GAS-infektion och STSS, och tillståndet kan misstolkas som en viral infektion. Vissa patienter har initialt kräkningar och diarré som huvudsymtom, vilket kan misstolkas som gastrointestinal infektion. Vid nekrotiserande fasciit är kardinalsymtomet svår lokal smärta med ofta sparsamma eller inga lokala statusfynd. Feber kan saknas, och tillståndet kan misstolkas som annat smärttillstånd. Detta kan fördröja kirurgi, som är livräddande vid nekrotiserande fasciit.
Profylax kan behöva ges till kontakter
Det är väl känt att GAS ofta sprids till närkontakter, och det finns ökad risk för sekundärfall vid invasiv sjukdom. Ett fåtal studier rapporterar mellan 19 och 200 gånger ökad relativ risk för invasiv GAS-infektion bland närkontakter, men den absoluta risken är mycket låg [11]. Studier som utvärderar antibiotikaprofylax saknas. Många patienter med invasiv GAS-infektion är äldre individer med mjukdelsinfektioner av typ erysipelas/cellulit med positiv blododling, och någon smittkälla eller smittspridning kan som regel inte identifieras.
Rutinmässig profylax till närkontakter rekommenderas därför inte, utan hushållskontakter bör informeras och rekommenderas att söka sjukvård vid symtom [11]. I vårt beskrivna fall fanns emellertid en tydlig koppling mellan två mycket allvarliga fall av invasiv GAS-infektion. Förskolan bedömdes i detta fall vara likställd med ett hushåll beträffande risken för sekundärfall. Detta föranledde beslutet att identifiera och behandla samtliga med symtom och dessutom ge profylax brett till övriga kontakter för att begränsa den risken.
Invasiv streptokockinfektion anmälningspliktig 2004
GAS är vanligt förekommande och koloniserar framför allt svalget hos barn. Asymtomatiskt bärarskap anses förekomma hos mellan 3 och 30 procent och genomsnittligt hos cirka 12 procent av barn och ungdomar under 18 år [1].
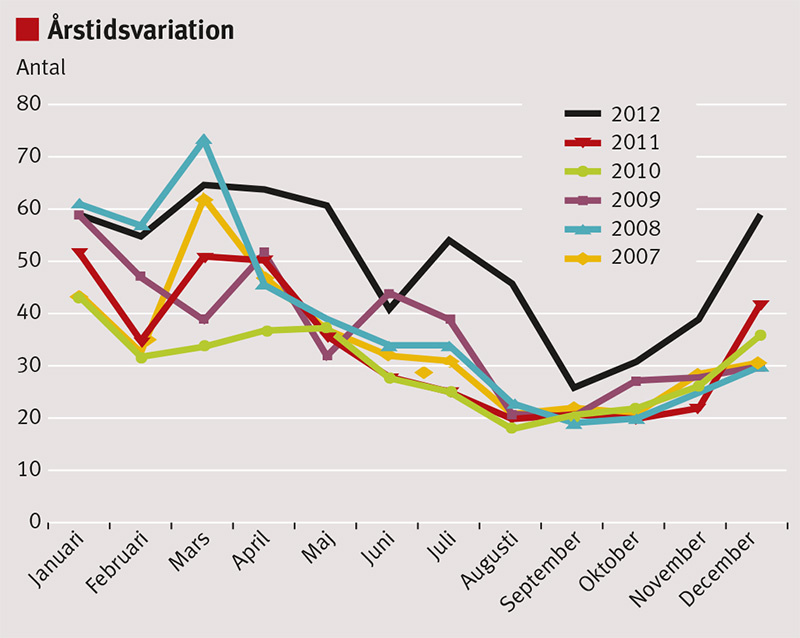
Invasiva streptokockinfektioner blev anmälningspliktiga i Sverige 2004. Mellan 2006 och 2011 varierade antalet anmälda fall mellan 252 och 461, med det högsta antalet 2008 (Figur 1). Under 2012 var antalet fall högre än tidigare år, 584 fall, med runt 55–60 fall per månad (Figur 2). Under januari 2013 rapporterades 92 fall. Ökningen i antal fall under 2012 var jämfört med tidigare år störst hos barn 0–19 år och hos äldre >80 år. Numerärt ökade antalet fall/100 000/år från 1,2 år 2006 till 2,1 år 2012 hos barn i åldrarna 0–19 år och från 13,4 till 26,8 hos äldre >80 år [12]. Den årliga incidensen i Sverige beräknades under 1990-talet till ca 3/100 000/år [5] men har de senaste åren varit 4–6/100 000 invånare/år [13].
Flera internationella studier har belyst epidemiologin vid invasiva infektioner. Under 2003–2004 gjordes en jämförande studie av invasiv GAS-infektion i 11 europiska länder med insamling av såväl bakteriella som kliniska data. En mortalitet på 19 procent vid sju dagar noterades. Mortaliteten var dock betydligt högre vid mer allvarliga sjukdomsmanifestationer som nekrotiserande fasciit (32 procent) och STSS (44 procent). Incidens och mortalitet varierade mellan länderna, vilket delvis kunde förklaras av skillnader i vilka GAS-typer som var vanligast förekommande [13, 14].
Mikrobiologisk typning viktig vid allvarliga infektioner
GAS typas traditionellt med T- eller M-serotypning. Den senare är numera vanligen ersatt av sekvensbaserad emm-typning, och fler än 150 emm-typer är i dag identifierade. Framför allt är M/emm 1, 3 och 6 vanliga bland allvarliga invasiva infektioner som orsakar nekrotiserande fasciit och STSS [15]. Både T- och M-proteinet finns på cellytan och förekommer i vissa givna kombinationer där flera M/emm-typer kan återfinnas inom samma T-typ. T-typ 1 är dock så gott som alltid även M/emm 1 [14, 16].
Också inom Sverige har olika GAS-typer varierat över tid. I slutet av 1980-talet, under pågående utbrott av allvarliga infektioner, var 80 procent av fallen M1-/T1-typ [17]. Åren 1996–1997 dominerade i stället emm28/T28 (29 procent) och under 2002–2004 utgjorde emm89 och emm81 de mest frekventa serotyperna [18, 19]. Under början av 2007 såg vi återigen en ökning av allvarliga GAS-infektioner i landet, och 45 procent av de invasiva stammarna under årets sju första månader var T1. År 2009 gjordes en ny nationell insamling av invasiva GAS-isolat, återigen var T1 vanligast (27 procent) följt av T28 (21 procent) [13].
Alla serotyper kan ge upphov till allvarliga invasiva GAS-infektioner. Omvänt gäller att även stammar av serotyper som anses ha högre virulens, t ex emm1/M1/T1, oftast endast orsakar asymtomatiskt bärarskap. Värdfaktorer har således stor betydelse.
Rutiner för anmälan och typning kan förbättras
Typning av GAS görs av epidemiologiska skäl. För handläggning av den individuella patienten saknar typningen betydelse. Men övervakning av invasiva GAS-infektioner kombinerad med typning kan ge en tydligare bild av vilka GAS-stammar som är mest frekventa och om en ökning av antalet fall domineras av en viss stam. I kombination med kliniska rapporter kan det ge indikationer om en viss stam är kopplad till ökad morbiditet eller mortalitet. Detta ger i sin tur underlag för bättre information till vården.
År 2004 blev invasiva GAS-infektioner och andra allvarliga GAS-infektioner anmälningspliktiga, och 2006 fastställdes falldefinitionen för rapportering av Socialstyrelsen (Fakta 2). Invasiva isolat ska anmälas från både laboratoriet och kliniken. Anmälan görs i anmälningssystemet SmiNet.
En brist i övervakningen, som är mer påtaglig för GAS än för andra sjukdomar, är att många fall anmäls bara av de mikrobiologiska laboratorierna, baserat på fynd av GAS i material från »normalt steril lokal«. Klinisk anmälan fanns bara för 66 procent av de laboratorieanmälda fallen 2012. Många kliniskt verksamma läkare kan vara omedvetna om anmälningsplikten för invasiv GAS-infektion och att även fall av STSS och nekrotiserande fasciit med fynd av GAS i material från icke-steril lokal ska anmälas som troligt fall av invasiv GAS-infektion, enligt Socialstyrelsens falldefinition.
I de kliniska anmälningarna saknas också ofta information om allvarliga symtom, som streptokocktoxiskt chocksyndrom eller nekrotiserande fasciit. Detta kan anges på anmälningsblanketten som en kommentar i en fritextruta, men sådan kommentar saknas vanligen. En förbättrad anmälningsblankett med fält för information om allvarlig klinisk bild har nu tagits fram vid Smittskyddsinstitutet. Detta kombinerat med utökad typning av invasiva isolat kan göra det lättare att identifiera utbrott av svår sjukdom och spridning av aggressiva stammar.
Fakta 1. Två fall med anknytning till förskola
En tidigare väsentligen frisk man i 45-årsåldern sökte i februari 2012 vård på grund av hög feber, hosta, kräkningar och diarré sedan fyra dagar. Hustrun och några av parets barn var samtidigt sjuka med feber och luftvägssymtom. Ankomstdagen hade mannen på eftermiddagen försämrats med värk över bröstet, hosta och snabbt påkommen andnöd.
I status vid ankomsten klockan 22 noterades: Vaken och lucid, ej nackstel, högfebril, kraftigt andningspåverkad med andningsfrekvens 45/min, 70 procents syresaturation på luft, omätbart blodtryck, takykardi ca 150/min, ingen rodnad i svalget, petekier i armveck och ljumskar.
Laboratorieprov var derangerade med CRP 432 mg/l, kreatinin 321 μmol/l, LPK 1,8 × 109/l, TPK 111 × 109/l, APT-tid 47 s, PK/INR 1,1 och laktat 9,1 mmol/l.
På akutmottagningen fick patienten syrgas och vätska samt efter blododling antibiotika i form av meropenem. Odling togs också från nasofarynx, svalg och urin. Prov för pneumokock- och legionellaantigen i urin togs liksom nasofarynxaspirat för influensadiagnostik. Lungröntgen visade bilaterala underlobsinfiltrat. Patienten fick tillägg av moxifloxacin och överfördes till IVA.
Under natten progredierade den respiratoriska insufficiensen, och patienten intuberades. Trots massiv inotropi och tillägg av kortison blev han cirkulatoriskt försämrad. På morgonen undersöktes patientens hustru och barn på akutmottagningen, och ett av barnen hade positivt snabbtest för GAS. Snabbtest för GAS på patienten var också positivt, och tillståndet bedömdes som STSS. Intravenöst gammaglobulin gavs (0,5 g/kg kroppsvikt). Strax därefter fick patienten hjärtstopp, som man lyckades häva. ECMO-behandling (extrakorporeal membranoxygenering) initierades, och klindamycin lades till antibiotikabehandlingen.
I odlingar från blod, svalg och nasofarynx samt bronksköljvätska växte GAS. Stammarna sändes till Smittskyddsinstitutet och typades senare till T1/emm1. Patienten visade sig också vara positiv för influensa A (ej H1N1). I svalgodlingar från patientens barn växte samma typ av GAS.
Patientens tillstånd var fortsatt mycket kritiskt och krävde behandling på ECMO-enheten i en dryg vecka innan han överfördes till brännskadeintensiven på grund av svåra hudnekroser. Dessa ledde senare till amputation av höger lårben, vänster underben och höger underarm. Efter 10 veckors intensivvård följd av fortsatt vård och rehabilitering skrevs patienten hem efter drygt 7 månaders sjukhusvistelse.
Ytterligare ett fall
Tidigt i förloppet framkom att en kvinna med barn på samma förskola som patientens barn nyligen vårdats på IVA med allvarlig sepsis som krävde ECMO-behandling. Ingen växt påvisades i blododling, men den kliniska bilden överensstämde med streptokocksepsis, och i svalgodling växte GAS, som dock inte typades. Hennes tillstånd stabiliserades snabbt, och hon kunde skrivas ut efter ett par veckors vård.
Förebyggande åtgärder på förskolan
I februari 2012 informerades smittskyddsläkaren om att dessa båda personer insjuknat i allvarlig invasiv GAS-infektion. Det framkom att båda hade barn i samma förskola. Smittskyddsläkaren bedömde att smittspridning av en virulent GAS-stam förekom på förskolan och beslöt att antibiotikabehandla samtliga familjer med barn i förskolan, liksom personal och deras familjer, för att förhindra ytterligare allvarliga sjukdomsfall.
Ett informationsmöte för föräldrar och personal hölls på förskolan. Samtliga familjemedlemmar listades med namn, personnummer, vikt och eventuell överkänslighet/allergi. Listorna lämnades till de vårdcentraler där familjerna var listade. Verksamhetschef och smittskyddsansvarig läkare/sköterska på respektive vårdcentral informerades och ansvarade för klinisk bedömning av personer med symtom, provtagning och receptförskrivning enligt smittskyddsläkarens direktiv.
Symtomfria personer behandlades med penicillin V i 5 dagar utan föregående provtagning. Personer med symtom undersöktes av läkare, odlades från svalg och fick 10 dagars behandling med penicillin V. Läkemedlen skrevs ut kostnadsfritt för patienten enligt smittskyddslagen. Behandlingarna påbörjades samtidigt en fredag, och barn och personal bedömdes vara smittfria då förskolan öppnade igen på måndagen. Sedvanliga hygienråd vid streptokockutbrott gavs.
Sammanlagt svalgodlades 28 personer med luftvägssymtom och/eller feber. Av dessa odlingar var 8 positiva med växt av GAS;
7 barn på förskolan (5 flickor och 2 pojkar, 2–5 år gamla) och en kvinna, 64 år, mor till en av personalen. Samtliga isolat typades på Smittskyddsinstitutet, och alla var typ T1/emm1. Misstanken om spridning av en specifik stam på förskolan kunde därmed bekräftas. Inga ytterligare fall av invasiv GAS-infektion med anknytning till förskolan har rapporterats.
Fakta 2. Invasiv GAS-infektion är anmälningspliktig
Socialstyrelsens falldefinition för anmälan av invasiv infektion av betahemolytiska grupp A-streptokocker (GAS, Streptococcus pyogenes) [20].
Misstänkt fall. Klinisk bild förenlig med STSS (streptokocktoxiskt chocksyndrom), nekrotiserande fasciit eller puerperal sepsis + påvisande av Streptococcus pyogenes i (annan än nedan angiven) relevant lokal.
Bekräftat fall. Laboratorieverifierat fall.
Laboratoriekriterier för diagnos. Isolering av Streptococcus pyogenes (GAS) från blod, likvor eller annan normalt steril lokal.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.