Förkalkning av kärl och hjärtklaffar är mycket vanligt vid avancerad kronisk njursvikt.
Det finns flera orsaker till att vaskulär förkalkning är vanligt
i den uremiska miljön, bl a hyperfosfatemi, diabetes, adynamisk bensjukdom, oxidativ stress, dyslipidemi och inflammation.
Aktuella studier visar att även brist på vitamin K kan bidra till vaskulär förkalkning genom att hämma matrix-Gla-protein (MGP).
Eftersom warfarin verkar kunna öka risken för kärlförkalkning och kalcifylaxi och dessutom
(i nordamerikanska registerstudier) visat sig vara associerat med ökad risk för stroke finns det i dag inga starka skäl för att behandla denna mycket förkalkningskänsliga patientgrupp med warfarin – om inte absoluta indikationer för behandling föreligger.
Medan de stora folkhälsoproblemen diabetes, cancer, hjärt–kärlsjukdom och fetma har rönt stort allmänt intresse har den epidemi av kronisk njursvikt som man börjat observera runt om i världen rönt mindre allmänt intresse [1]. Aktuella epidemiologiska rapporter visar att 10–13 procent av befolkningen har tecken på kronisk njursvikt, och man anser att denna ofta »tysta« kroniska sjukdom kan vara en orsak till ökad kardiovaskulär morbiditet och mortalitet – något som går att påverka med screening och tidig intervention [2].
Patienter med kronisk njursvikt har, i relation till sin kronologiska ålder, en påtagligt ökad vaskulär ålder med ökad kardiovaskulär morbiditet och mortalitet som följd [3]. Dessutom uppvisar denna patientgrupp många andra tecken på prematurt åldrande, som osteoporos, hypogonadism, inflammation, oxidativ stress, insulinresistens, depression, kognitiv dysfunktion, minskad muskelmassa, försämrad sårläkning och vaskulär förkalkning [4].
Även om många kroniskt njursjuka patienter har ökad prevalens av etablerade riskfaktorer, såsom hypertoni, dyslipidemi och diabetes mellitus, kan dessa inte ensamma förklara den uppemot 15-faldigt ökade risken för kardiovaskulär dödlighet som man rapporterat hos dialyspatienter jämfört med njurfriska [5]. Andra icke-traditionella riskfaktorer, som inflammation, oxidativ stress och hyperfosfatemi, är vanligt förekommande i den uremiska fenotypen och anses spela en betydande roll för prematurt åldrande av hjärta och kärl.
Vaskulär förkalkning vanligt hos njursjuka, även yngre
Vaskulär förkalkning kan observeras hos diabetiker och äldre, men hos patienter med avancerad kronisk njursvikt kan denna kärlstelhet, eller »åderförkalkning på riktigt«, ofta påvisas även hos yngre patienter [6]. I en studie av 161 hemodialyspatienter fann man att hela 83 procent hade kärlförkalkningar synliga på vanlig slätröntgen [7]. Medan förkalkning av mitralis- och aortaklaffar förekommer hos
Epidemiologiska studier har visat att kärlförkalkning är associerad med ökad mortalitet [9]. En metaanalys har visat att risken för koronara händelser ökar 3,4 gånger om patienten har tecken på vaskulär förkalkning [10], och mängden kalcium i koronarkärlen anses vara en bättre prediktor för kardiovaskulära händelser än de klassiska riskfaktorerna [11]. Epidemiologiska studier har även visat att njursjuka patienter med uttalad kärlförkalkning ofta har lägre bentäthet och ökad risk för frakturer [12]. Naves et al [13] visade att progredierande vaskulär förkalkning under fyra år i normalbefolkningen var associerad inte bara med ökad förlust av benmassa utan också med ökad risk för frakturer.
Den dokumenterat starka relationen mellan bensjukdom och kärlförkalkning föranledde stiftelsen Kidney Disease: Improv-ing Global Outcomes (KDIGO) att år 2006 anta en ny nomen-klatur, CKD-(chronic kideny disease) MBD (mineral and bone disorder), för att beskriva ett vid kronisk njursvikt vanligt syndrom som inkluderar rubbad mineralmetabolism, vaskulär förkalkning, bensjukdom och ökad mortalitet [14].
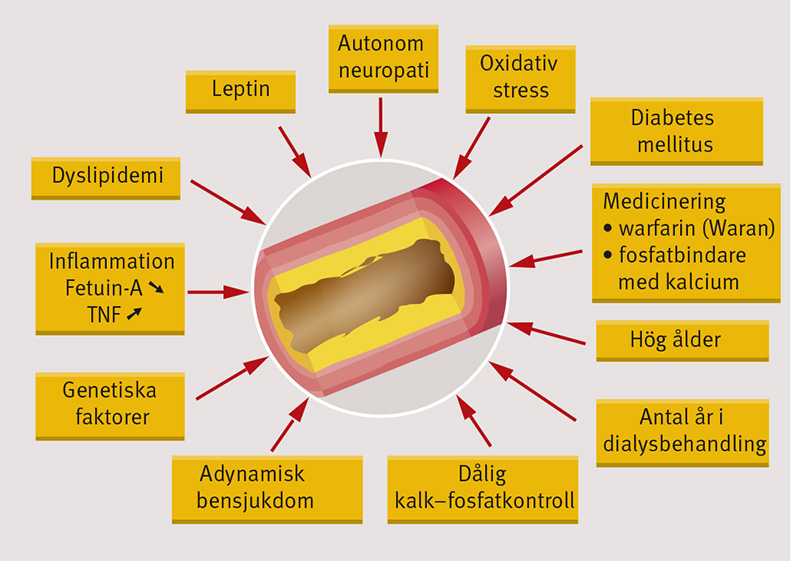
Orsaker till vaskulär förkalkning hos dialyspatienter
Det finns flera orsaker till att vaskulär förkalkning är ett så vanligt fenomen i den uremiska miljön (Figur 1). Retention av fosfat är sannolikt den viktigaste enskilda orsaken till en snabbare förkalkningsprocess när njurfunktionen sviktar [15]. En metaanalys visade att av fosfat, kalcium och paratyreoideahormon (PTH) var det bara fosfat som oberoende predicerade kardiovaskulära händelser och mortalitet [16]. Man anser numera att högt fosfat inte bara är en kardiovaskulär riskfaktor [17] utan också kan påskynda åldrandeprocessen [4]. Man har tidigare trott att höga fosfatnivåer ökar risken för vaskulär förkalkning, i första hand genom passiva mekanismer beroende på övermättning. Nu har man emellertid funnit att fosfat aktivt stimulerar den vaskulära förkalknings- eller, snarare, förbeningsprocessen i glatt muskulatur in vitro genom differentiering av osteoblaster [18].
I förkalkade kärl har man även identifierat ett ökat uttryck av flera benrelaterade proteiner som stimulerar förkalkningsprocessen, t ex osteonektin och osteokalcin [19]. Eftersom förkalkningsprocessen styrs av balansen mellan stimulerare och hämmare av förkalkning leder minskat uttryck och därmed tillgång till ämnen som hämmar förkalkningsprocessen i kärl, såsom fetuin-A, matrix-Gla-protein (MGP), pyrofosfat och osteopontin, till ökad förkalkning.
På senare år har man visat att även kroniskt låggradig inflammation, som är vanligt hos kroniskt njursjuka [20], är en riskfaktor för vaskulär förkalkning. Tvärsnittsstudier har visat på starka samband mellan kärl- och klafförkalkningar och olika inflammatoriska parametrar hos njursjuka [21]. Även vid andra tillstånd med kronisk inflammation, t ex SLE och reumatoid artrit, har man funnit en hög-re prevalens av förkalkade kärl och klaffar hos patienterna än i normalbefolkningen [22].
Av ett flertal inflammatoriska variabler som kan påverka förkalkningsprocessen har den cirkulerande hämmaren av förkalkning, leverproteinet fetuin-A, väckt mycket intresse. Låga nivåer av denna negativa akutfasreaktant predicerar inte enbart ökad mortalitet hos dialyspatienter [23, 24] utan är även associerad med ökad kärlstelhet hos patienter i CKD-stadium 3–4 [25]. Eftersom fetuin-A binder kalcium och fosfat i små cirkulerande partiklar (s k calciprotein particles) i den uremiska miljön leder brist på detta protein vid kronisk inflammation till ökad risk för förkalkning [26].
Vitamin K kan skydda mot förkalkning
Vitamin K är ett fettlösligt protein, som består av fyllokinon (K1) och flera menakinoner (K2). Det upptäcktes 1929 av dansken Henrik Dam när kycklingar som fick fettfri diet utvecklade blödningar. Henrik Dam delade år 1943 Nobelpriset med amerikanen Edward Doisy för upptäckten av vitamin K och dess betydelse för koagulationen. Denna grupp av vitaminer har betydelse inte bara för koagulationsprocessen (framför allt K1) utan också för optimal syntes av MGP, ett protein som återfinns i bl a ben, hjärta och njurar och som reglerar benomsättning och förhindrar vaskulär förkalkning. För normal MGP-aktivitet krävs ständigt tillskott av vitamin K, som verkar som ett koenzym för ett karboxylas som ökar karboxylering av gammakarb-oxiglutamat (Gla) (Figur 2).
Upptäckten att MGP-knockoutmöss utvecklar en dramatisk förkalkning av aorta (som kan leda till aortaruptur vid 6–8 veckors ålder) illustrerar vilken betydelsefull hämmare av förkalkningsprocessen detta protein är [27]. Viktiga källor för vitamin K1 är vissa grönsaker (framför allt spenat, broccoli och brysselkål), medan vitamin K2 finns i bl a fermenterade sojaprodukter (natto), ost (mögel- och fetaost), kyckling och gåslever.
Vitamin K-brist medför en hög andel icke-karboxylerat MGP och är vanligt hos dialyspatienter. Det kan delvis bero på otillräckligt intag av K-vitaminrika födoämnen [28]. Många av de födoämnen som man rekommenderar att dialyspatienter ska vara försiktiga med (på grund av högt kalium- eller fosfatinnehåll) innehåller vitamin K. Att dialyspatienter ofta kräver ca 20 procent lägre doser av warfarin för att bibehålla INR inom målområdet talar indirekt för att denna patientgrupp lider brist på vitamin K [29]. Eftersom osteokalcin bara är karboxylerat till ca 70 procent antyder det att intaget av vitamin K är otillräckligt även i normalbefolkningen [30].
Epidemiologiska studier har på senare år visat på samband mellan låga vitamin K-nivåer, bensjukdom och vaskulär förkalkning [31]. Man har i normalbefolkningen funnit samband mellan lågt intag av vitamin K1, risk för höftfrakturer [32] och lägre benmassa [33]. Hög konsumtion av natto, ett traditionellt japansk livsmedel som består av fermenterade sojabönor med mycket högt vitamin K2-innehåll (Figur 3), är associerad med högre benmassa [34].
En tvärsnittsstudie på 200 friska kvinnor visar samband mellan MGP-aktivitet, vitamin K och koronarkärlsförkalkning [35]. Även i Rotterdamstudien (som inkluderar 4 087 patienter) har man funnit att högt intag av vitamin K2 var associerat med minskad risk för aortaförkalkningar och även med minskad risk för kardiovaskulär mortalitet [36]. I en treårig observationsstudie på 387 hemodialyspatienter rapporterade man att vitamin K1-brist var den starkaste riskfaktorn för kotfraktur, medan brist på vitamin K2 (menakinon 4) var en riskfaktor för vaskulär förkalkning [37].
Warfarin tycks påskynda vaskulär förkalkning
Eftersom vitamin K har en skyddande roll i förkalkningsprocessen kan man fråga sig om kronisk behandling med warfarin ökar risken för vaskulär förkalkning och osteoporos i den inflammerade och hyperfosfatemiska uremiska miljön. Eftersom warfarinmedierad hämning av vitamin K minskar karboxyleringen och inaktiveringen av vitamin K-beroende faktorer i levern (Figur 2) och även minskar karboxyleringen av osteokalcin och MGP i andra vävnader bör warfarin teoretiskt sett kunna accelerera den vaskulära förkalkningsprocessen.
Hos råttor har man mycket riktigt funnit att warfarininducerad underdekarboxylering av MGP medför förkalkning av aorta [38]. Koos et al [39] rapporterade att behandling med warfarin leder till ökad förkalkning av aortaklaffar hos patienter med lindrig eller ingen kronisk njursvikt. I en annan studie på 108 hemodialyspatienter fann man en korrelation mellan antalet månader med warfarinbehandling och grad av förkalkning av aortaklaffarna [40].
Det finns även fallbeskrivningar (Figur 4) som rapporterar snabbt progredierande kärlförkalkningar hos njursjuka patienter som påbörjar warfarinbehandling [41]. I en aktuell studie visar Schurgers et al [42] att patienter som behandlas med warfarin har signifikant mer förkalkade koronarplack än patienter (matchade för ålder och Fram-inghamrisk-fak-torer) utan sådan behandling. I denna studie rapporterades även att tio veckors warfarinbehandling av aterosklerosbenägna s k ApoE(–/–)-möss förändrade morfologin i de aterosklerotiska placken och ökade deras vulnerabilitet [42].
Kärlförkalkningar kopplas till osteoporos [43]. Det är därför inte förvånande att warfarinbehandling även associeras med minskad bentäthet [44]. Eftersom låga nivåer av karboxy-lerat MGP har visat sig predicera ökad mortalitet hos hemo-dia-lyspatienter [45], och behandling med vitamin K2 ökar karboxyleringsgraden [46], planeras en europeisk randomi-serad studie med vitamin K-behandling på dialyspatienter. Även effekten av vitamin K på uremiska patienters bentäthet bör undersökas då studier av osteoporotiska patienter utan njursvikt har visat att vitamin K2 ökar bentätheten och minskar risken för kotkompression [47].
Förmaksflimmer är en vanlig rytmrubbning hos njursjuka (prevalens 15–20 procent) och liksom i normalbefolkningen förenat med ökad risk för stroke, varför nefrologer och kardiologer ofta behöver ta ställning till om behandling med warfarin ska initieras. Då nordamerikanska registerstudier har visat att warfarinbehandling snarast verkar vara förenad med ökad risk för stroke hos dialyspatienter med förmaksflimmer finns det i dag inga starka skäl för war-farin-behandling på denna indikation [48, 49].
Med hänsyn tagen till att antalet patienter med förmaksflimmer förväntas bli dubblerat till år 2050 [50] behövs nya orala antikoagulantia, som också kan användas av den snabbt ökande gruppen patienter med avancerad kronisk njursvikt [2]. Då det i dag inte finns bevis för att warfarin ger behandlingsfördelar för patienter med avancerad njursvikt har intresset för trombin- och faktor Xa-hämmare ökat [51]. Tyvärr är denna grupp av läkemedel kontraindicerad eller ännu inte godkänd för behandling av avancerad kronisk njursvikt.
Sammanfattning och rekommendationer
Förkalkning av kärl och hjärtklaffar är vanligt vid avancerad njursvikt och associerat med osteoporos, frakturer och ökad mortalitet. Etiologin till denna »ossifiering« av kärl i den toxiska uremiska inre miljön är multifaktoriell. Det har diskuterats om alla patienter med njursvikt (GFR mindre än 60 ml/min) eller bara riskpatienter ska screenas för vaskulär förkalkning [52]. enligt riktlinjer från kdigo [53] kan man ännu inte rekommendera allmän screening av kroniskt njursjuka patienter då det saknas dokumenterat effektiv behandling som påverkar morbiditet och mortalitet till följd av kärlförkalkningar.
Om man ska undersöka om en njursjuk patient har tecken på kärl- och klafförkalkningar bör slätröntgen (sidobild av ländryggen), ekokardiografi eller koronar-DT väljas i förs-ta hand. Med utvecklingen av mer känsliga metoder kan man dock redan i dag diskutera om inte den mest fullständiga kartläggningen av en patients förkalkningsgrad enklast sker med DT torax–buk (utan kontrast).
Hyperfosfatemi och kronisk inflammation, med utarmning av cirkulerande förkalkningshämmare, synes vara viktiga orsaker till kärlförkalkning. På senare år har man även uppmärksammat den roll som vitamin K spelar för förkalkningsprocessen via karboxylering av MGP. Man har visat att warfarinbehandling hos dialyspatienter kopplas till ökad risk för stroke och blödningskomplikationer. Behandlingen kan också bidra till kärlförkalkningar [40] och utlösa det sällsynta, men livshotande, tillståndet kalcifylaxi [54].
Innan randomiserade studier har genomförts som bevisar att warfarin är en behandlingseffektiv terapi även vid avancerad njursvikt avråder därför de flesta [48, 55-58] men inte alla [59] från profylaktisk behandling med warfarin vid förmaksflimmer. Eftersom en aktuell dansk registerstudie [61] visade att behandling med warfarin var associerad med minskad risk för stroke och tromobembolism även hos kroniskt njursjuka patienter kan man spekulera över om bättre kontroll av INR i de nordiska länderna delvis förklarar varför warfarin (i motsats till nordamerikanska registerstudier) inte är associerat med ökad strokerisk. Naturligtvis kvarstår även i denna patientgrupp vissa absoluta indikationer för kronisk warfarinbehandling, såsom mekaniska klaffproteser eller upprepade lungembolier. Eftersom de flesta dialyspatienter har brist på vitamin K bör man noggrant monitorera INR om warfarinbehandling initieras.





![Figur 2. Warfarin hämmar kinonreduktas och vitamin K-epoxidreduktas. Detta leder till lägre nivåer av vitamin K och vitamin K-hydrokinin i vävnaderna, vilket i sin tur medför att karboxyleringsreaktionen, som katalyseras av glutamylkarboxylas, blir ineffektiv. Man får då koagulationsfaktorer som inte har tillräckligt med Gla. Efter Stafford, 2005 [60].](https://lakartidningen.se/wp-content/uploads/EditorialFiles/MW/%5bCCMW%5d/2012KV1221_fig2.jpg)
![Figur 3. Natto är ett kletigt och (enligt vissa) inte särskilt angenämt doftande traditionellt japanskt livsmedel. Det är baserat på fermenterade sojabönor och äts ofta till frukost. Över 700 000 ton natto produceras årligen i Japan, och enligt traditionen medför intag av natto, som använts i mer än 1 000 år, ökad styrka. Man har nu funnit att natto är rikt på vitamin K2 (menakinon 7) och mycket riktigt att det finns ett samband mellan ökat vitamin K2-intag via natto och ökad benstyrka hos japanska män [34].](https://lakartidningen.se/wp-content/uploads/EditorialFiles/MW/%5bCCMW%5d/2012KV1221_3_B.jpg)

![Figur 4 B. Efter warfarinbehandling finner man uttalade kärlförkalkningar. Del av bild reproducerad från Hristova et al, 2010 [41].](https://lakartidningen.se/wp-content/uploads/EditorialFiles/MW/%5bCCMW%5d/2012KV1221_4_B.jpg)
















