Modern onkologisk behandling har förbättrat prognosen vid olika cancerdiagnoser, men kardiovaskulära biverkningar är relativt vanliga.
Cancerbehandling i kombination med obehandlade kardiovaskulära riskfaktorer kan leda till hjärtsjukdom hos en patient som har botats från sin cancer.
Överdriven försiktighet för hjärtats skull kan leda till att patienten undanhålls potentiellt livräddande onkologisk behandling.
Nära samarbete mellan kardiologer och onkologer kan ge förbättrad vård för patienter med cancer.
Modern onkologisk behandling har förbättrat prognosen vid många cancerdiagnoser, men kardiovaskulära biverkningar (kardiotoxicitet) bidrar till en del av den kvarvarande mortaliteten och morbiditeten [1-4]. Barn med cancer har i dag bättre överlevnad än för 20 år sedan, men de kan på sikt utveckla hjärtsjukdom som unga vuxna. Hos vuxna patienter med diagnosen dilaterad kardiomyopati finns en överrepresentation av patienter som har genomgått onkologisk behandling i barndomen [3, 5, 6] eller senare i livet.
I Sverige är de vanligaste cancerformerna bröstcancer (190/100 000 kvinnor), prostatacancer (202/100 000 män) och koloncancer (45/100 000 individer) [7]. Medelåldern hos patienter som drabbas av bröstcancer är 60 år, prostatacancer 73 år och koloncancer 65 år [8]. Tioårsöverlevnaden vid dessa cancerformer är ca 83 procent för bröstcancer och prostatacancer, medan motsvarande siffra för koloncancer är 58 procent för män och 62 procent för kvinnor [8].
Eftersom kardiotoxicitet kan innebära risk för dödlighet och sjuklighet som ibland överstiger dödligheten och sjukligheten av cancersjukdomen, måste behandlingsvinsten vägas mot riskerna med behandlingen [9]. Adekvat behandling av kardiovaskulära riskfaktorer samt tidig detektion och behandling av kardiotoxicitet ökar chanserna för att kunna genomföra potentiellt livräddande onkologisk behandling.
Vi vill belysa att nära samarbete mellan kardiologer och onkologer kan ge förbättrad vård för många patienter med cancer.
Kardiovaskulära och andra riskfaktorer
Kardiotoxicitet kan utvecklas i en akut eller subakut fas i anslutning till behandlingen eller som kronisk manifestation. Den exakta förekomsten av kardiotoxicitet vid onkologisk behandling är okänd, men rapporteras i olika studier vara 0,5–28 procent [10].
Det är känt att risken för kardiotoxicitet ökar om patienten har kardiovaskulära riskfaktorer eller samtidig hjärtsjukdom vid behandlingsstart, vilket är viktigt eftersom cancerbehandling numera även ges till äldre patienter som i högre utsträckning än yngre är sköra och har fler kardiovaskulära riskfaktorer.
Även behandlingsval och administrationssätt såsom läkemedelstyp, dosering per behandlingscykel, infusionstakt, kumulativ dos samt vid kombinationer av olika cancerbehandlingar påverkar risk för kardiotoxicitet [1-4, 11].
Bedömning av riskfaktorer för kardiotoxicitet (Fakta 1) bör ingå i planeringen av onkologisk behandling, där cancertyp, riskfaktorer, känd hjärtsjukdom och uppföljning diskuteras ingående som del i ett kardio-onkologiskt samarbete [1, 3, 9, 12].
Onkologisk behandling
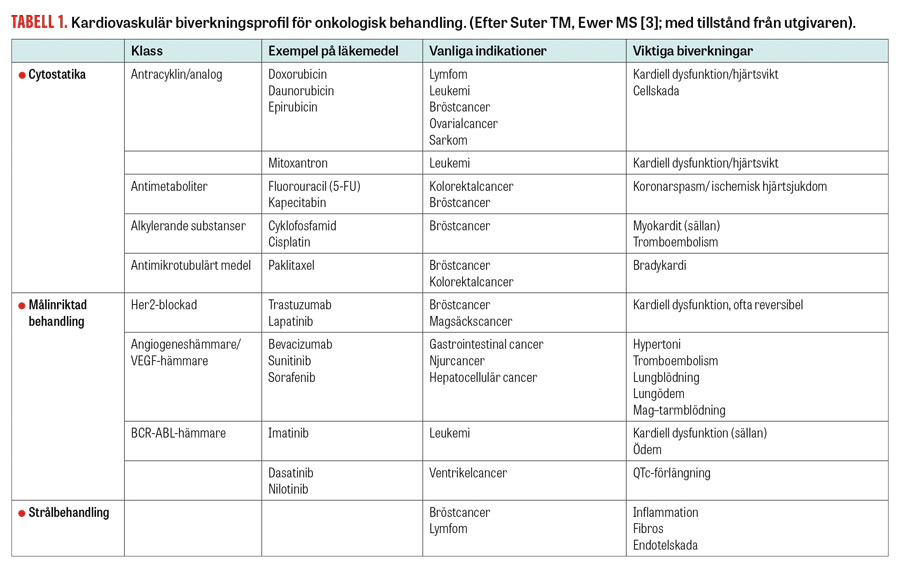
De kardiotoxiska effekterna varierar mellan olika onkologiska behandlingar (Tabell 1). Kardiotoxicitet kan uppträda direkt men också månader eller längre tid efter avslutad behandling. Cytostatika såsom antracykliner eller alkylerare kan ge akut cellskada och/eller orsaka inflammation i hjärtmuskel eller perikardium. Målinriktad cancerbehandling, t ex trastuzumab, utövar sin effekt genom påverkan av intracellulära signalvägar och är därigenom kardiotoxisk. Andra läkemedel, t ex vissa multikinashämmare, har en mer indirekt påverkan på hjärtat och kärlsystemet genom påverkan på koagulation och endotel, vilket bidrar till hypertoni och tromboembolisk sjukdom [13, 14].
Strålbehandling kan potentiellt skada alla delar av hjärtat, hjärtsäcken, klaffapparaten och kranskärlen från epikardiell till mikrovaskulär nivå. Dessa effekter utvecklas över tid och kan även uppträda efter avslutad behandling [1]. Mediastinal strålbehandling kan orsaka fibrosbildning i hjärtmuskeln med ökad styvhet som följd, vilket kan leda till diastolisk dysfunktion med eller utan symtom. Ökad fibrosbildning i klaffar ses ibland efter strålbehandling och kan leda till uppkomst av stenoser med eller utan insufficiens. Strålskador på endotelceller kan påverka kranskärlen och bidra till uppkomst av kranskärlssjukdom [15]. Risken för strålskada ökar om stråldosen överskrider 30 Gy, vilket tidigare var aktuellt vid s k mantelstrålbehandling vid Hodgkins lymfom.
Även om modern strålbehandling är utformad på ett skonsammare sätt uppträder strålbehandlingsorsakad hjärtsjukdom 20–30 år efter strålbehandling, vilket innebär att dessa patienter fortfarande dyker upp i klinisk praxis [10, 15]. Strålbehandling mot bröstkorgen (t ex vid bröstcancer eller lymfom) kan leda till dels perikardit och orsaka fibrös förtjockning av perikardiet och perikardvätska, dels konstriktiv perikardit.
Kardiotoxicitet
Hypertoni. Hypertoni är den vanligaste biverkan av onkologisk behandling och förknippas i första hand med användningen av målinriktade behandlingar som påverkar endotelfunktionen [16]. Högt blodtryck vid behandlingsstart är också en stark riskfaktor för att utveckla kardiotoxicitet. Blodtrycket bör kontrolleras före och under pågående behandling, och högt blodtryck ska behandlas enligt gällande riktlinjer och målvärden.
Hjärtsvikt. Antracykliner kan ge irreversibel tid- och dosrelaterad kardiomyocytskada, som kan leda till hjärtsvikt [3, 4]. Femårsöverlevnaden vid hjärtsvikt på grund av kardiotoxicitet är lägre än vid hjärtsvikt av annan etiologi, såsom tidigare hjärtinfarkt [17]. Patienter som utvecklar hjärtpåverkan bör behandlas enligt gällande riktlinjer för hjärtsviktsbehandling [2, 3, 17, 18], och många patienter kan återuppta sin onkologiska behandling under pågående hjärtsviktsbehandling.
Om cancern betraktas som behandlingsbar och patienten har en förväntad överlevnad som överskrider 1 år bör man överväga att erbjuda patienten sviktpacemaker (CRT) med eller utan primärprofylaktisk implanterbar defibrillator (CRT-D) om det finns indikation för dessa behandlingar. Även potentiellt livräddande behandling såsom mekaniskt cirkulationsstöd för långtidsbruk (LVAD; left ventricular assist device) kan vara aktuell för vissa patienter [18, 19].
Koagulationsrubbningar. Koagulationssystemen hos patienter med cancer är ofta aktiverade, och risken för venös eller arteriell tromboembolisk sjukdom är förhöjd [3]. Cytostatika som cisplatin och gemcitabin samt antihormonell behandling som tamoxifen och leuprorelin ökar risken ytterligare [3, 13]. Profylaktisk antikoagulationsbehandling och behandling av tromboser rekommenderas enligt gällande riktlinjer.
Vasospasm och kranskärlssjukdom. Vid behandling med antimetaboliten 5-fluorouracil (5-FU) och dess orala prekursor kapecitabin finns det risk för utveckling av akut kranskärlssjukdom hos ca 1,6–7,6 procent av patienterna [1, 11]. Nitroglycerin och kalciumkanalblockerare kan vara effektiva om spasminslaget är stort, men patienten bör i övrigt få behandling enligt gällande primär- och sekundärprofylaktiska riktlinjer vid kranskärlssjukdom inklusive ballongdilatation (PCI; perkutan koronarintervention) [3]. Behandling med trombocythämning kan trots förbättrad korttidsöverlevnad i vissa fall ge ökad blödningsrisk för patienter med trombocytopeni eller med nyligen genomgången kirurgi. Huruvida dessa patienter har ökad risk för restenos i koronarkärlsstent efter PCI är inte klarlagt [3].
Rytmrubbningar. Arytmier som kan uppstå under cancerbehandling behandlas enligt riktlinjer. Taxaner kan orsaka sinusbradykardi, som dock sällan är behandlingskrävande. 5-FU kan leda till rytmrubbningar, även kammartakykardi, på grund av den koronarspasm som induceras [11]. QT-förlängning kan förekomma vid målinriktad behandling, t ex sunitinib, och kan förvärras av elektrolytrubbningar, vilket kan medföra risk för livshotande ventrikulära arytmier. För att minska denna risk är det viktigt att undvika annan QT-förlängande läkemedelsbehandling såsom vissa psykofarmaka och antiemetika [3]. Samtidigt är det dock viktigt att inte undvika potentiellt botande onkologisk behandling på grund av riskerna för QT-förlängning [17]. EKG-övervakning kan i vissa fall behövas för att genomföra behandlingen.
Diagnostiska hjälpmedel vid kardiotoxicitet
EKG. Elektrokardiografi med bedömning av rytm, QT-tid och övrigt utseende bör ingå i den basala utredningen inför cancerbehandling. Antracykliner kan ge akuta EKG-förändringar av ospecifik karaktär, t ex ospecifika ST–T-(repolarisations)förändringar. Det finns också hållpunkter för att minskad QRS-amplitud efter antracyklinbehandling kan vara korrelerad till försämrad systolisk funktion, men det diagnostiska värdet av EKG för tidig detektion av kardiotoxicitet är lågt på grund av låg specificitet och sensitivitet. Däremot är EKG förutsättningen för bedömning av QT-tiden, vilken kan förlängas av både antracyklin och annan cancerbehandling [20].
Ekokardiografi. Hjärtfunktionen utvärderas vanligen med ekokardiografi och oftast genom mätning av vänsterkammarens ejektionsfraktion (LVEF). Kardiotoxicitet kan definieras som en minst 15-procentig minskning av LVEF eller en minskning med ≥10 procent till ett värde <50 procent (normalvärde är >55 procent) [21]. Tidig minskning av LVEF under onkologisk behandling anses predicera utveckling av hjärtsvikt på längre sikt [3, 22]. Om LVEF är sänkt (<55 procent) redan vid behandlingsstarten löper patienten ökad risk att drabbas av hjärtsvikt under eller efter den onkologiska behandlingen. Det finns belägg för att diastoliska parametrar (t ex diastoliskt flödesmönster över mitralklaffen, E/A-kvot, decelerationstid för E-vågen och isovolumetrisk relaxationstid) påverkas tidigare än LVEF under cancerbehandling [3]. Nyare ekokardiografiska metoder såsom deformationsmätning mätt med 2D kan också vara tidigare och känsligare mått än mätning av LVEF [1, 3, 22-25]. I Sverige görs ekokardiografiska kontroller rutinmässigt hos patienter som erhåller adjuvant Her2-blockad (1 års behandling före start av behandlingen och efter 3 och 9 månader samt efter avslutad behandling).
Biomarkörer. Det finns inga specifika tillförlitliga biomarkörer som predicerar risken att drabbas av kardiotoxicitet. Men vanliga markörer för myokardskada (troponiner) och nedsatt hjärtfunktion (NT-proBNP/ BNP) kan vara användbara för tidig detektion. Mindre studier har visat viss nytta av screening med vanliga markörer för myokardskada (troponiner) och hjärtsvikt (NT-proBNP/BNP) hos patienter som genomgår cytostatikabehandling med potentiellt kardiotoxiska läkemedel [26, 27]. Andra biomarkörer, t ex myeloperoxidas (MPO), placentatillväxtfaktor (PlGF) och tillväxtdifferentieringsfaktor 15 (GDF-15) kan vara av värde för tidig detektion av kardiotoxicitet, men de är otillräckligt validerade i kliniska studier [28].
Myokardbiopsi i höger kammare. Myokardbiopsi ingår vanligtvis inte i utredningen av misstänkt kardiotoxicitet men kan övervägas för vissa patienter, särskilt om annan genes till hjärtsvikt misstänks, t ex myokardit [1, 18].
Prevention av kardiotoxicitet
Kardiovaskulära riskfaktorer, t ex rökning, hypertoni, höga blodfetter och diabetes mellitus, ökar risken för kardiotoxicitet [26] och bör behandlas enligt sedvanliga riktlinjer, liksom befintlig hjärt- eller tromboembolisk sjukdom. Tidigt eller profylaktiskt insatt behandling med t ex ACE-hämmare respektive betablockerare har i mindre studier tenderat minska risken att utveckla hjärtsvikt vid antracyklin- och/eller trastuzumabbehandling hos patienter med förhöjd risk. Säker evidens för huruvida profylaktisk behandling kan förhindra uppkomst av kardiotoxicitet finns dock inte i dag [1, 3, 4, 29, 30].
Nyligen rapporterades att kandesartan förbättrar LVEF jämfört med kontrollbehandling när det ges i samband med bröstcancerbehandling (PRADA-studien). Studien var relativt liten och med begränsad uppföljningstid, men resultaten är lovande [31].
Det finns i dag både kardiologiska och onkologiska kliniska behandlingsrekommendationer samt expertråd för kardio-onkologi [1, 2, 18, 32], men det saknas evidensbaserade riktlinjer för handläggande av kardiotoxicitet.
Uppföljning
Onkologisk behandling bör alltid betraktas som en riskfaktor för hjärtsjukdom, både i samband med behandlingen och senare i livet. Trots detta finns i Sverige ingen tydlig konsensus för hur uppföljningen av symtomfria patienter, inklusive barn, som genomgått onkologisk behandling ska se ut. Internationellt finns däremot strukturerad uppföljning efter barncancer, t ex vid Mayo-kliniken, med tydliga algoritmer för individuell handläggning före, under och efter onkologisk behandling och med tydlig riskvärdering utifrån behandling och underliggande kardiovaskulära risker [10].
Forskning och utveckling
Kardiotoxicitet är ett aktuellt ämne vid internationella hjärt- och onkologikonferenser, området växer och mera kunskap behövs. Vi är övertygade om att Sverige behöver kardio-onkologiska centrum som kan fungera som kunskapscentrum och multidisciplinära patientmottagningar inför, under och efter cancerbehandling.
Vid genomgång av remisser till hjärtmottagningen vid Karolinska universitetssjukhuset, Solna, hade ca 4 procent en primärt kardio-onkologisk frågeställning. Vårt intryck är att remissflödet ökar allteftersom medvetenheten och kunskapen om kardiotoxicitet ökar bland behandlande onkologer. Vid nydebuterad hjärtsvikt är det också allt vanligare att genomgången cancerbehandling, såväl strålbehandling som cytostatika, kopplas samman med hjärtsviktsdiagnosen.
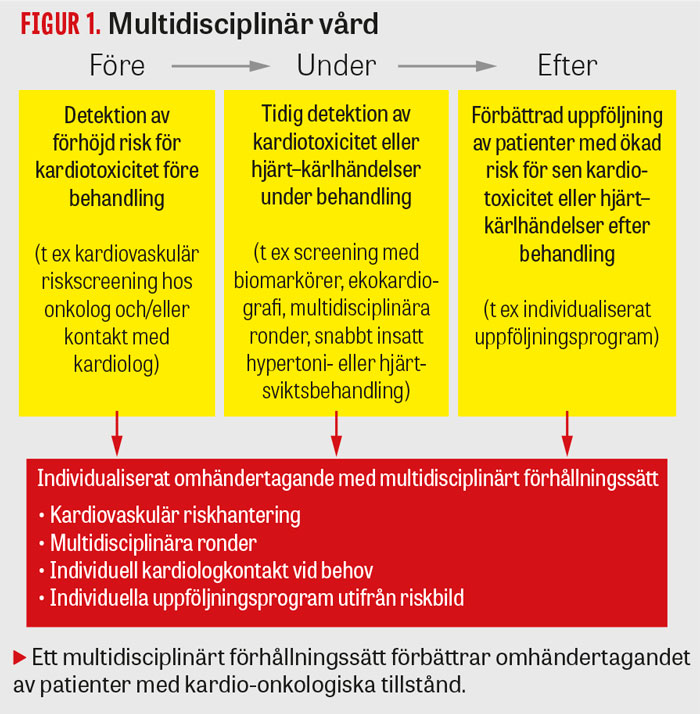
Ett kardio-onkologiskt kunskapscentrum har etablerats i samarbete mellan hjärtkliniken och onkologiska kliniken vid Karolinska universitetsjukhuset i Stockholm. Vi har initierat multidisciplinära behandlingskonferenser och gemensam handläggning vid misstanke om kardiotoxicitet. Vår förhoppning är att en modell för multidisciplinär vård (Figur 1) med kliniska fysiologer, hjärtläkare, onkologer, barnonkologer och radioterapeuter kan utarbetas, vilken sedan kan appliceras även på andra sjukhus i Sverige.
En kardio-onkologisk arbetsgrupp inom ramen för Svenska kardiologföreningens sektion för hjärtsvikt och klaffsjukdomar byggs för närvarande upp och har som mål att föra fram kardio-onkologiska frågor nationellt.
Parallellt med detta pågår en nationell prospektiv randomiserad klinisk studie (Cardio-oncology breast cancer, COBC) i samarbete mellan Universitetssjukhuset i Linköping och Karolinska universitetssjukhuset i Stockholm för att studera nyttan av biomarkörer för hjärttoxicitet, behandling av kardiovaskulära riskfaktorer samt tidig diagnostik och behandling av kardiotoxicitet hos bröstcancerpatienter.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Riskfaktorer för kardiotoxicitet
Behandlingsrelaterade
- Tidigare antracyklinbehandling
- Pågående antracyklinbehandling
- Tidigare strålbehandling mot bröstkorgen
- Pågående strålbehandling mot bröstkorgen
- Kombinationsbehandling med Her2-blockerare
Patientrelaterade
- Tidigare känd hjärtsjukdom
- Hypertoni
- Tromboembolisk sjukdom
- Diabetes mellitus
- Hyperlipidemi
- Rökning
- Hög respektive låg ålder (>65 och <15 år)
- Alkohol- eller drogmissbruk
- Nedsatt njurfunktion