Risken för epilepsi efter stroke är cirka 5–12 procent.
Riskfaktorer är blödning, stor stroke, stroke innefattande hjärnbarken och anfall i nära anslutning till stroke.
Risken för fler anfall är lägre vid anfall inom en vecka efter stroke än vid senare anfall.
Lamotrigin eller levetiracetam är ofta lämpliga behandlingsalternativ. Tolerabiliteten är god och signifikanta interaktioner med vaskulär sekundärprofylax saknas.
I en svensk studie var epilepsi efter stroke associerad med sämre överlevnad.
Den vanligaste dödsorsaken är vaskulär sjukdom.
Aktuell forskning rör epilepsiförebyggande behandling och huruvida debut av epilepsi efter medelåldern ska föranleda behandling av kardiovaskulära riskfaktorer.
Det nära sambandet mellan cerebrovaskulär sjukdom och epilepsi finns beskrivet genom hela den moderna neurologiska litteraturen. De senaste åren har epilepsi efter stroke (postapoplektisk epilepsi, poststrokeepilepsi) ådragit sig ett allt större intresse, och litteraturen växer. Utvecklingen sammanfaller med ökat fokus på etiologi inom all epilepsiforskning och höjda ambitioner i strokesjukvården. Förutsättningarna för korsbefruktning mellan kunskapsområden kan också ha ökat i och med att neurologer i större omfattning involveras i strokesjukvård.
I denna översikt sammanfattas den viktigaste utvecklingen – med särskilt fokus på nya rön av betydelse för klinisk handläggning. Bland dessa märks en ökad insikt om att epilepsi efter stroke är vanligt, att nyare antiepileptika är bättre behandlingsalternativ än äldre sådana och att sjukvårdens ambitioner vad gäller anfallsfrihet och vaskulär sekundärprevention förmodligen kan höjas.
Patofysiologi
Varför uppstår epileptisk benägenhet efter stroke? Svaret saknas, men ledtrådar finns. Skadans art och grad har betydelse. Stor stroke, blödning, kortikal lokalisation och epileptiska anfall vid insjuknandet ökar risken för senare epilepsi [1]. Låg ålder har varit associerad med ökad risk i vissa studier [2, 3], men huruvida detta speglar överlevnad eller neurobiologi är oklart. Efter trombolys verkar en något större andel patienter få epilepsi än efter stroke i allmänhet, men detta verkar avspegla allvarligare stroke och inte att trombolys i sig ökar risken för epilepsi [4, 5]. I typfallet finns en viss latens mellan stroke och uppträdandet av epileptiska anfall. Under denna tid tänker man sig att ärrbildning eller andra processer ger upphov till epileptisk benägenhet i en ännu ofullständigt förstådd process som benämns epileptogenes. Mediantiden mellan stroke och epilepsi är omkring ett år, och över 80 procent av de patienter som utvecklar epilepsi gör det inom två år [6, 7].
Djurmodeller av epilepsi efter stroke är en tilltalande tanke och skulle möjliggöra försök med förebyggande behandling. I praktiken har modellering visat sig svår, delvis till följd av stor experimentell variabilitet [8]. Avstängning av arteria cerebri media eller fototrombos (där laser aktiverar ljuskänslig färg i blodbanan som ger tromboser och påföljande infarktutveckling) är modeller som verkar ge upphov till epileptiska anfall. Likheter med mänskliga tillstånd är ännu ofullständigt klarlagda.
Epidemiologi
Cerebrovaskulär sjukdom är den vanligaste identifierbara orsaken till epilepsi och ligger bakom 14–21 procent av alla nya fall av epilepsi i Europa [9]. Uppskattningar av risken för epilepsi efter stroke varierar med uppföljningstid, i studien inkluderade stroketyper och studiedesign. Tre aktuella europeiska studier fann kumulativa risker om 5,6 till 12,4 procent efter upp till tio år [2, 10, 11]. En svensk studie fann en kumulativ incidens om 7,3 procent (12,4 procent efter blödning och 6,7 procent efter infarkt) hos patienter som insjuknat i stroke 2005–2010 efter en genomsnittlig uppföljningstid om 4,8 år [6]. De flesta studier finner en ungefär fördubblad risk för epilepsi efter blödning jämfört med infarkt, vilket stämmer med resultatet i en aktuell metaanalys där oddskvoten för epilepsi vid blödning var 2,41 med 95 procents konfidensintervall [95KI] 1,57–3,69 [1].
När har patienten epilepsi?
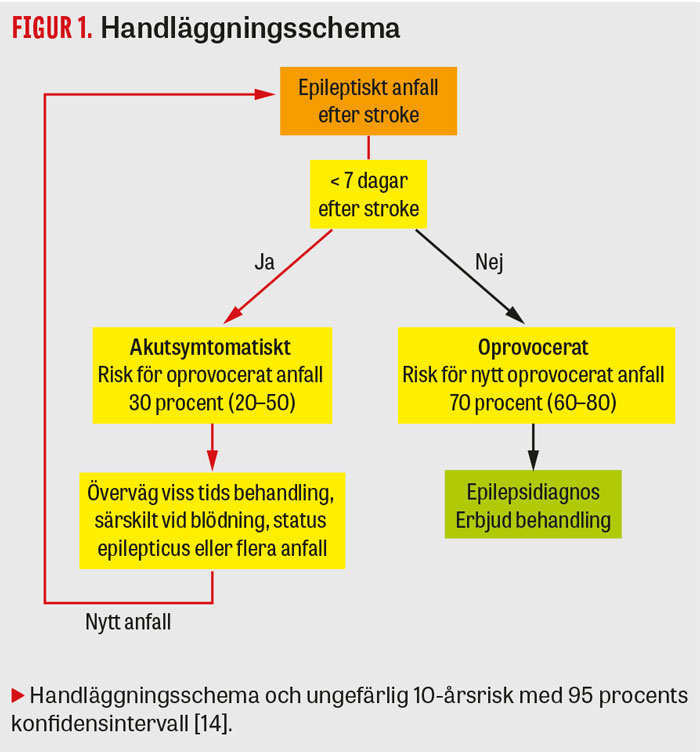
Epileptiska anfall inom första veckan efter stroke antas bero på akut hjärnpåverkan snarare än utvecklad epileptisk benägenhet [12]. Sådana anfall benämns akutsymtomatiska eller provocerade [13] och medförde i en av studierna med längst uppföljningstid en risk för ett efterföljande oprovocerat epileptiskt anfall inom tio år på 33 procent, med 95KI 20,7–49,9 procent [14]. Studien redovisade inte proportioner av stroketyper, men risken förefaller större vid blödningar än vid infarkt [3]. Risken (kumulativ incidens) för epilepsi efter akutsymtomatiska anfall har rapporterats som 22–38 procent vid blödning [15, 16] och 6–32 procent vid infarkt [3, 7, 17-19], men studiedesign och uppföljningstid varierar avsevärt.
Enligt den internationella epilepsiorganisationen ILAE (International Leagne Against Epilepsy) kan epilepsi anses föreligga om patienten haft två oprovocerade epileptiska anfall eller ett epileptiskt anfall och en risk för ytterligare anfall de närmaste tio åren som bedöms motsvara den som ses efter två oprovocerade anfall [20]. Vid ett oprovocerat anfall mer än en vecka efter stroke är risken för fler anfall 71,5 procent (95KI 59,7–81,9 procent) [14]. Denna risk är i nivå med den som föreligger efter två oprovocerade anfall utan strukturell patologi. Epilepsidiagnos kan ställas.
Klinisk anfallsdiagnostik
Det förekommer inte sällan att epileptiska anfall tolkas som ny stroke – differentialdiagnostiken är svår [21]. Anfall är ofta fokala och kan ha begränsade uttryck. Man kan försöka vara extra vaksam vid accentuerad svaghet i en redan paretisk extremitet och fråga patient och vittnen om initiala retningsfenomen (tonusökning, ryckningar), vilket dock inte är obligat. Övergående medvetandepåverkan är inte vanlig vid stroke i en storhjärnshemisfär [22], men mycket vanlig vid icke-konvulsiva anfall. Akut EEG kan bistå vid diagnostik av icke-konvulsivt status epilepticus. Avancerad avbildning kan vara av värde [23], men litteraturen ger i dag en spretig bild av hur perfusionsundersökning och MR-diffusion ska tolkas, och specificitet och sensitivitet för radiologiska fynd ännu är oklara [24-26]. Metoderna kan trots dessa begränsningar tillföra information när man överväger differentialdiagnoser till stroke eller vid misstanke om att ett epileptiskt anfall är symtom på en ny stroke [27].
Avseende klassificering av ett anfall som akutsymtomatiskt eller ej kan svårigheter uppstå vid anfall som inträffar något mer än en vecka efter en initial stroke. Den cerebrovaskulära situationen kan ha varit instabil, och det kan vara svårt att avgöra om stroken förvärrats vid en senare tidpunkt än det ursprungliga insjuknandet eller om det funnits en annan provocerande faktor. Som grundregel gäller att patienten inte ska anses ha epilepsi innan man är övertygad om att det förelegat minst ett oprovocerat epileptiskt anfall – alltså ett anfall väl utanför den akutsymtomatiska fasen.
Antiepileptisk behandling
Antiepileptisk behandling kan användas både efter akutsymtomatiska anfall och vid epilepsidiagnos (Figur 1). Under den tid man behandlas är risken för anfall lägre, men det finns inga bevis för att tidig behandling påverkar risken för eller lindrar senare epilepsi.
Behandling efter akutsymtomatiska anfall
Efter akutsymtomatiska anfall är praxis att behandla en kort period om man bedömer det angeläget att hindra ytterligare akutsymtomatiska anfall [28, 29]. Bedömningen är individuell. Faktorer som i författarens tycke talar för behandling är en skör klinisk situation, kortexnära blod eller upprepade anfall. Levetiracetam är lättanvänt i sammanhanget. Vid en besvärlig anfallssituation kan preparatet sättas in i terapeutisk dos direkt, och det interagerar inte med vaskulär sekundärprofylax [30]. Andra läkemedel med möjlighet till snabb insättning är exempelvis fenytoin, valproat eller lakosamid, men dessa är sällan optimala val för strokepatienter. Status epilepticus behandlas enligt sedvanliga rutiner.
Behandlingstiden efter akutsymtomatiska anfall brukar vara kort, främst eftersom antiepileptiska läkemedel inte tros påverka risken för senare epilepsi och har biverkningar. Praxis varierar avsevärt [28, 29]. I USA finns en tradition av att behandla profylaktiskt vid blödning (trots att det går emot amerikanska riktlinjer), och man har därför studerat effekten av antiepileptika på rehabilitering. Behandling med äldre antiepileptika har i vissa studier varit associerad med sämre prognos, men samma utfall har inte setts i senare studier där levetiracetam var vanligare [31-33]. I en mindre studie randomiserades patienter med blödning till profylaktiskt valproat eller placebo i en månad. Studien visade ingen effekt på risk för epilepsi, men däremot ett bättre neurologiskt utfall efter rehabilitering i behandlingsgruppen [34].
En andel av alla patienter med akutsymtomatiska anfall kommer senare att få epilepsi. De högsta rapporterade riskuppskattningarna ligger omkring 30 procent [7, 14, 16], en nivå som inte överstiger risken efter ett enstaka oprovocerat anfall utan neurologisk sjukdom eller avvikande EEG [35]. Precis som i den situationen är det bra om patienten informeras om att epilepsidiagnos inte ställts, men att en viss risk för upprepade anfall finns. Man kan fortsätta behandlingen en längre tid om patienten finner risken för nya anfall oacceptabel, men inga data visar att sådan behandling förebygger epilepsi. Vid akutsymtomatiskt status epilepticus kan risken för epilepsi vara högre, men litteraturen är än så länge begränsad [36, 37].
Vid bedömning av lämplighet för bilkörning behöver såväl resttillstånd efter stroke som risker för ny stroke och epileptiska anfall beaktas. Ett första anfall där epilepsidiagnos inte ställs medför normalt sex månaders körförbud för personbil. Vid ett akutsymtomatiskt anfall finns möjlighet till kortare observationstid efter individuell bedömning, dock minst tre månader.
Behandling av epilepsi
Vid antiepileptisk behandling efter stroke behöver hänsyn ofta tas till polyfarmaci, kardiovaskulär sjuklighet, annan komorbiditet och hög ålder. Det traditionella valet var länge karbamazepin, men sedan minst femton år påtalas i litteraturen substansens nackdelar utifrån ovanstående aspekter. Karbamazepin ger ofta yrsel och hyponatremi. Det är enzyminducerande och interagerar med vaskulär sekundärprofylax – koncentrationerna av simvastatin minskas med 75 procent [38] och effekten av NOAK försämras, för att nämna några exempel. Därtill kan en rad läkemedel, såsom vissa kalciumflödeshämmare och antibiotika, påverka metabolismen av karbamazepin och öka risken för biverkningar. Mindre lyckade läkemedelskombinationer med karbamazepin är trots detta fortsatt vanliga [39].
Äldre antiepileptiska läkemedel kan också ha negativa effekter i sig. Blodfetter påverkas negativt av valproat, fenytoin och karbamazepin [40]. I en studie visades nyligen att natriumkanalblockerande läkemedel medför en ökad risk för plötslig hjärtdöd [41]. Den reella betydelsen av långtidsbiverkningar för äldre patienter med kort förväntad överlevnad är oklar, men de negativa effekterna av äldre antiepileptika är teoretiskt bekymmersamma. Det ter sig på hela taget rimligt att i första hand välja andra preparat.
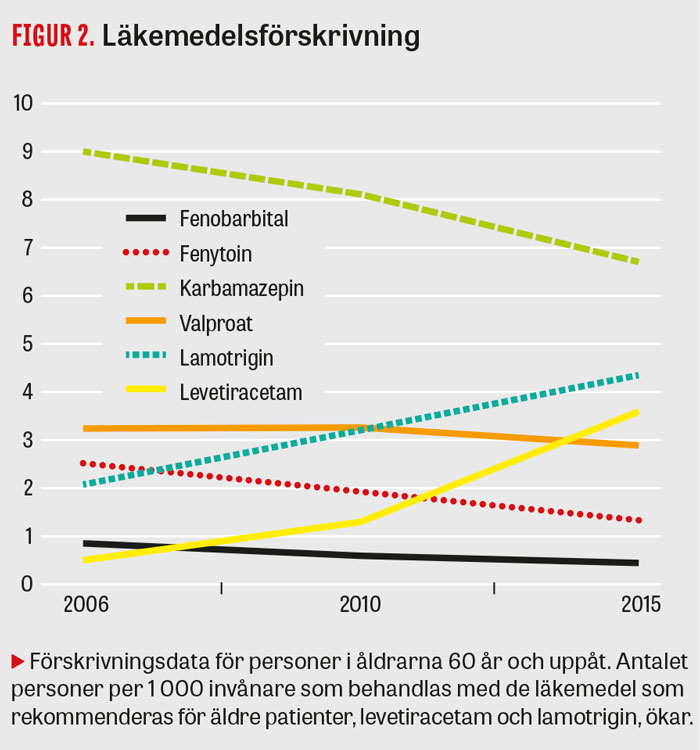
Såväl lamotrigin som levetiracetam har relativt låg risk för biverkningar vid behandling av äldre personer, och båda preparaten tolereras bättre än karbamazepin vid epilepsi efter stroke [1, 42-46]. De mest aktuella internationella riktlinjerna är för närvarande de skotska, som rekommenderar lamotrigin och levetiracetam samt gabapentin som behandling vid fokal epilepsi hos äldre [47]. Gabapentin har inte varit föremål för någon jämförande studie med patienter med epilepsi efter stroke, utan endast rapporterats ha god effekt i en icke-randomiserad prospektiv studie [48]. Förskrivningsdata visar att levetiracetam och lamotrigin även i Sverige ökar i popularitet hos äldre patienter (Figur 2).
I författarens tycke bör karbamazepin reserveras för svårbehandlade fall, främst på grund av dess interaktioner med sekundärprofylax efter stroke. Flera andra preparat kan vara bättre alternativ att prova dessförinnan, när standardpreparaten lamotrigin och levetiracetam inte fungerar.
Behandlingens längd
Utsättning av antiepileptiska läkemedel är ett område med svag evidens. Risken för anfall är i allmänhet ungefär dubbelt så stor vid utsättning som vid fortsatt terapi hos patienter som varit anfallsfria i några år. Studiernas absoluta resultat varierar, måhända beroende på vilka patienter man inkluderat, men fokala anfall, avvikande neurologiskt status och en identifierbar orsak till epilepsi har i vissa studier ökat risken för anfall efter utsättning [49, 50]. Vid epilepsi efter stroke verkar det utifrån nuvarande kunskapsläge bäst att vara återhållsam med utsättningsförsök.
Prognos för epilepsi
Epilepsi efter stroke anses lättbehandlad, och i flera översiktsartiklar beskrivs hur tillståndet enkelt bemästras med monoterapi [1, 51]. I de prospektiva studier (inte alltid randomiserade kontrollerade prövningar) man genomfört med olika preparat har anfallsfrihet (varierande definitioner) inte sällan uppnåtts hos 70–90 procent av patienterna [42-45, 48]. Detta kontrasterar i viss mån mot retrospektiva data från rutinsjukvård, där endast strax över hälften av patienterna uppnår anfallsfrihet [52-54]. De små studiestorlekarna gör konfidensintervallen vida, men skillnaderna i utfall väcker frågan om inte högre ambitioner kan vara på sin plats vad gäller anfallsfrihet i patientgruppen.
Prognos för överlevnad
Påverkas överlevnad eller neurologisk funktion av epilepsi efter stroke? Avseende överlevnad är risken att dö av epileptiska anfall i allmänhet störst för patienter med okontrollerad epilepsi med hög frekvens av generaliserade anfall. Då epilepsi efter stroke anses svara bra på antiepileptisk behandling borde tillståndet inte påverka överlevnad i någon större utsträckning. Anfallsrelaterad död är emellertid inte den enda möjliga inverkan epilepsi skulle kunna ha på prognos. Läkemedelsbiverkningar skulle kunna försvåra rehabilitering, och en besvärlig anfallssituation förhindrar rimligen fysisk aktivitet. Antiepileptiska läkemedel kan interagera med vaskulär sekundärprofylax, och epilepsi är förknippat med allvarlig komorbiditet som depression.
Vissa studier har funnit att epilepsi är oberoende associerat med sämre neurologiskt utfall eller kortare överlevnad efter stroke [4, 55, 56]. I vår svenska registerstudie på patienter med stroke 2005–2010 medförde efterföljande epilepsi riskökning för död (hazardkvot [HR] 1,69; 95KI 1,64–1,74), även vid försök till korrigering för strokens svårighetsgrad (HR 1,36; 95KI 1,20–1,55). De relativa talen är små, men man bör då beakta att den absoluta dödligheten efter stroke är betydande. Möjligheten finns att den observerade riskökningen står för cerebrovaskulär sjuklighet snarare än epilepsi, exempelvis en ökad benägenhet för upprepad stroke. Man kan dock inte utesluta att epilepsi eller dess behandling i sig påverkar prognosen. Om detta i så fall är kopplat till anfall, läkemedelsbehandling eller måhända komorbiditet återstår att se. Dödsorsaker vid strukturell epilepsi är ofta relaterade till orsaken till epilepsi, även vid epilepsi efter stroke där vaskulär sjukdom är en vanlig dödsorsak.
Pågående forskning
Två utvecklingslinjer i forskningen om epilepsi och cerebrovaskulär sjukdom förtjänar särskild uppmärksamhet. För det första finns en pågående diskussion om huruvida statiner möjligen kan minska risken för epilepsi efter stroke. En stor registerstudie visade att statinanvändning var förenad med lägre risk för epilepsi efter stroke [57], och nyligen sågs en liknande effekt i en klinisk studie av patienter med akutsymtomatiska anfall – alltså en högriskgrupp för epilepsi [7]. Statiner har länge varit av intresse i djurmodeller av förvärvad epilepsi, men om effekten i människa beror på att läkemedlet förebygger anfall, epilepsi eller fler vaskulära lesioner är oklart.
Ytterligare ett intressant område är huruvida epilepsi efter en viss ålder ska ses som debutsymtom för behandlingskrävande vaskulär sjuklighet – alltså en sorts TIA-ekvivalent [58]. Såväl vaskulära riskfaktorer som radiologiska tecken på cerebrovaskulär sjukdom är vanligare hos medelålders eller äldre patienter med nydebuterad epilepsi än hos friska kontroller. Epilepsi efter 60 års ålder medförde i en stor retrospektiv journalstudie med mer än 4 000 patienter och lika många kontroller från Storbritannien en hazardkvot för stroke på 2,89 (95KI 2,45–3,91) [59]. Inte sällan skrivs i riktlinjer och översikter att vaskulära riskfaktorer ska eftersökas och behandlas hos äldre patienter med nydebuterad epilepsi [47, 58]. Klargörande studier om hur den behandlingen ska se ut kommer förhoppningsvis i framtiden.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Läs även författarintervjun med Johan Zelano.