Genterapi som koncept introducerades för 45 år sedan, men det är de senaste 5–10 åren som behandlingar blivit framgångsrika.
Genterapipreparat utgörs vanligen av rekombinanta virus som bär på en terapigen.
Exempel på sjukdomar med fungerande behandling är primär immunbrist och hemofili.
I vissa fall består behandling av genmodifierade celler exempelvis används T-lymfocyter som bär på syntetiska chimärreceptorer vid leukemi.
En annan form av genetisk terapi är behandling med korta oligonukleotider.
Redigering av arvsmassa var för några år sedan ren utopi, men utförs nu i kliniska studier.
En vanlig uppfattning inom läkarkåren är nog att genterapi inte fungerar, men den stämmer inte längre. Genterapi har gått från att vara en förhoppning och ibland övertro, som när fältet sammanfattades för Läkartidningen för 16 år sedan [1], till att bli något som är till verklig nytta för patienter med svåra sjukdomar. Det gäller fortfarande till största delen experimentella behandlingar, men vid flera åkommor har terapieffekter uppnåtts och utvecklingen går nu fort, i synnerhet för en del medfödda sjukdomar och vissa former av cancer.
Kort historik
Det är 45 år sedan begreppet genterapi introducerades [2]. Den första kliniska genöverföringen utfördes 1989, och år 2000 kom det stora terapeutiska genombrottet då forskare i Paris kunde visa att patienter med svår kombinerad immunbrist (SCID-X1) efter genterapi fick ett normalt fungerande immunsystem (Fakta 1) [2-9]. Tyvärr medförde dåtidens genterapivektorer ofta aktivering av endogena onkgener, vilket ledde till att flera patienter drabbades av leukemi, varav en avled. Utvecklingen har dock lett till att man i dag använder nya, säkrare metoder, som efter flera års uppföljning inte orsakat några sådana biverkningar.
Monogena sjukdomar (orsakade av mutation i ett enda arvsanlag) har länge varit attraktiva för experimentell klinisk genterapi. I dag är dock cancer den dominerande sjukdomsgruppen. Globalt har fler än 2 000 kliniska genterapiprövningar med tusentals patienter genomförts.
Begrepp
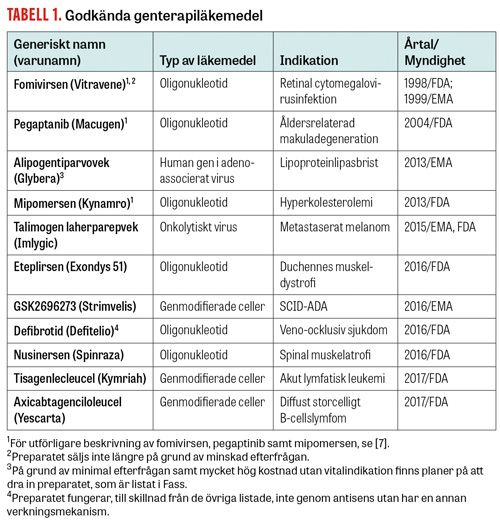
Genterapipreparat hör till gruppen läkemedel för avancerad terapi, som även innefattar bearbetade celler och vävnadstekniska produkter (Tabell 1). Vid genterapi förs arvsmassa in i celler för att uppnå en terapeutisk effekt genom att komplettera ett skadat arvsanlag, reparera en skadad gen eller ge cellen en ny funktion. För att överföra hela gener används vektorer, eller bärare, som vanligen utgörs av rekombinanta virus som inte är sjukdomsframkallande.
En annan form av genterapi är behandling med syntetiska oligonukleotider [7]. Dessa består av upp till några tiotal av arvsmassans byggstenar, så kallade nukleotider, medan genomet i ett rekombinant virus består av tusentals sådana. En tredje form av genterapi är tillförsel av budbärar-RNA (mRNA). Eftersom utvecklingen här ännu inte nått så långt beskrivs denna behandling inte vidare i artikeln.
Tillförsel av nytt friskt anlag eller redigering
Det kanske mest uppenbara användningsområdet för genterapi där hela arvsanlag överförs är monogena sjukdomar. Sådana exempel är sjukdomar med recessiv nedärvning, såsom olika former av svår kombinerad immunbrist (exempelvis SCID-X1 och SCID-ADA) och blödarsjuka. Genom att tillföra ett »friskt« arvsanlag kan en cell återfå förmågan att tillverka det protein som saknas.
Flera andra ärftliga bristtillstånd har också behandlats framgångsrikt, men antalet patienter är litet. Patienter med hemofili B har återfått förmågan att producera faktor IX så att behovet av tillförsel av rekombinant protein har minskat och i vissa fall upphört [10]. Nyligen har man dessutom använt en modifierad faktor IX som ger ökad förmåga att få blodet att koagulera, vilket också förbättrat behandlingseffekten.
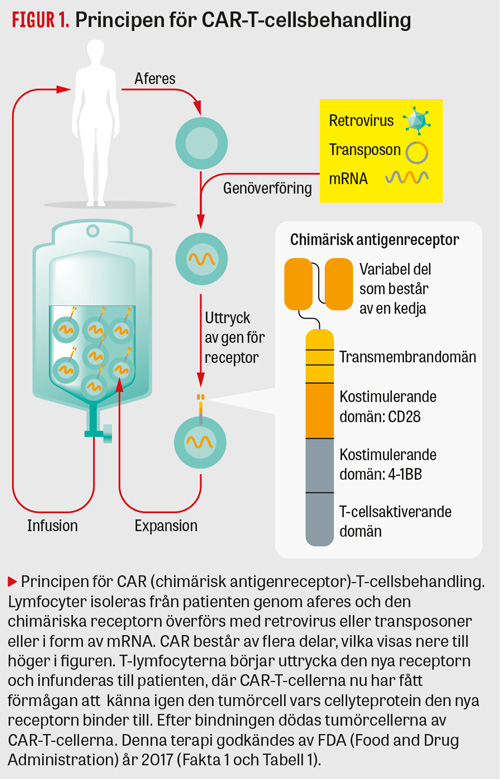
De indikationer flest patienter behandlats för med genterapi är lymfom och leukemier. Med användning av genteknik har ett arvsanlag för ett artificiellt protein skapats (Figur 1). Proteinet innehåller tre delar och uttrycks i patientens egna T-lymfocyter. Extracellulärt utgörs proteinet av en antikropp som känner igen CD19, vilket är ett cellyteprotein som finns på såväl normala som maligna B-lymfocyter. Mittendelen består av en del av T-lymfocytens antigenspecifika receptor, medan den intracellulärt utgörs av kombinationer av olika cellsignaleringsproteiner. Proteinet kallas chimärisk antigenreceptor (CAR), och patientens T-lymfocyter som tillförts den nya genen benämns CAR-T-celler [9]. Hundratals patienter har behandlats framgångsrikt, men enstaka patienter får allvarliga biverkningar, inklusive hjärnödem av okänd genes, och flera dödsfall har rapporterats. Den sammantagna nyttan har ändå bedömts vara så stor att amerikanska FDA (Food and Drug Administration) 2017 godkände tisagenlecleucel (Kymriah), en CAR-T-behandling mot akut lymfatisk leukemi. Senare under 2017 godkändes ett annat genterapiläkemedel för indikationen diffust storcelligt B-cellslymfom.
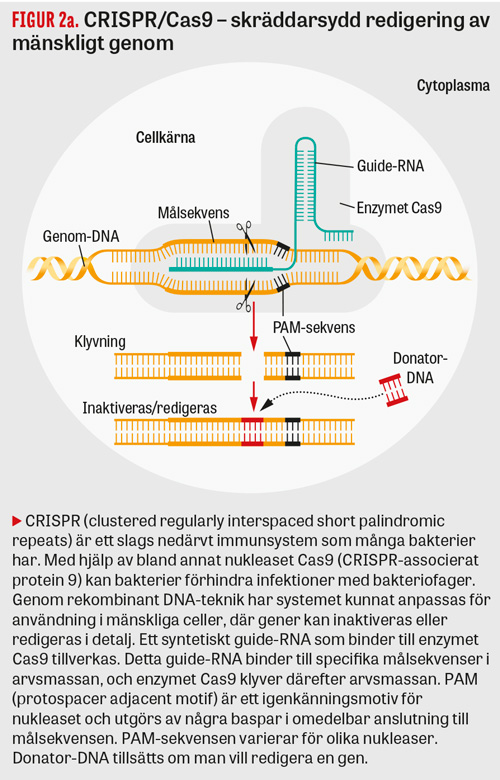
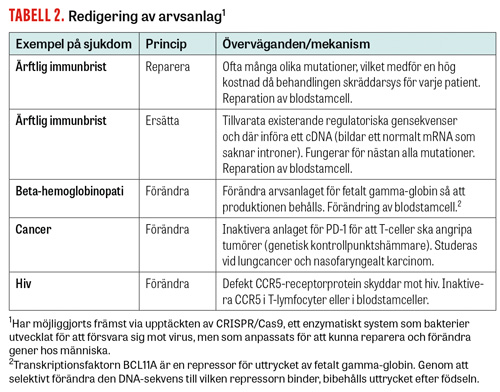
Något helt nytt i genterapiarsenalen är användning av enzymer med förmågan att reparera skadade anlag i celler, vilket möjliggjorts främst via upptäckten av genredigeringsmetoden CRISPR/Cas9 (Figur 2). För 5 år sedan var detta en ren utopi, men utvecklingen har gått fort (Tabell 2). Upptäckten av CRISPR (clustered regularly interspaced short palindromic repeats) och CRISPR-associerade Cas-gener, ett slags gensax, hos prokaryoter har revolutionerat molekylärbiologin och gjort det både billigt och enkelt att förändra arvsanlag. Kliniska försök inleddes i Kina under hösten 2016. Hos en patient med lungcancer inaktiverades då anlaget för cellytemolekylen PD-1 (programmerad dödsreceptor 1; även kallad CD 279), en så kallad immunkontrollpunktshämmare (immune checkpoint inhibitor), och de genmodifierade lymfocyterna återfördes därefter till patienten. Syftet var att förbättra möjligheten för T-lymfocyter att angripa tumörcellerna genom att inaktivera en molekyl som dämpar immunsvaret. Metoden utgör ett genterapeutiskt alternativ till behandling med antikroppar, som fungerar som immunkontrollpunktshämmare, i syfte att få T-lymfocyter att angripa tumörceller mer effektivt. Kinesiska forskare har hunnit längst, med redan bortåt 20 behandlade patienter vilkas celler genomgått CRISPR/Cas9-redigering. Orsaken till att det gått så fort är bland annat att denna typ av försök godkänns lokalt i Kina utan att någon central myndighet är involverad. Då detta är så pass nytt är uppföljningen begränsad, och resultaten återstår att se.
I det ovan nämnda fallet inaktiverades en gen, men metoden lämpar sig även för att reparera skadade anlag hos patienter med ärftliga sjukdomar. CRISPR/Cas9-tekniken borde passa särskilt bra när det gäller mutationer som orsakar dominant nedärvd sjukdom, där det ofta inte hjälper att tillföra ett friskt anlag. Tabell 2 visar på flera olika indikationer och principer där man påbörjat, eller är nära, kliniska försök.
Genetisk terapi med oligonukleotider
Terapeutiska oligonukleotider har använts sedan 1990-talet. De kan vara i form av dubbelsträngat siRNA eller bestå av enkelsträngade nukleinsyror. Den vanligaste formen är syntetiska oligonukleotider som består av endast ett 20-tal byggstenar (Tabell 1), vilka är riktade mot RNA och därför benämns antisens-RNA. Ett exempel är nusinersen (Spinraza), som godkändes i USA år 2016 för behandling av spinal muskelatrofi och som förändrar splitsningen av ett pre-mRNA [11].
I november 2017 rapporterades i New England Journal of Medicine om överföring av hela arvsanlaget, SMN1, med hjälp av en virusvektor. Samtidigt uppdaterades resultatet av behandling med Spinraza och en jämförelse mellan de två terapiformerna görs i en åtföljande redaktionell kommentar [12].
I år rapporterade Alnylam Pharmaceuticals om sitt nya siRNA, patisiran, för behandling av familjär transtyretinamyloidos (Skelleftesjukan). I en fas 3-studie uppnåddes mycket goda resultat och preparatet fick i november »genombrottsstatus« (breakthrough therapy designation) av FDA och »snabbare handläggning av registreringsansökningar« (accelerated assessment) av EMA. Flera företag har nått långt vad gäller nya oligonukleotidbehandlingar för ett flertal monogena sjukdomar, inklusive sådana med dominant nedärvning.
Framtida utmaningar
Ännu har få patienter behandlats med genterapi, och preparaten är främst till för ovanliga sjukdomar där det i dag saknas verksam behandling. Om större patientgrupper ska kunna behandlas krävs nya processer för storskalig framställning och distribution av genterapiprodukter. Behandlingarna är ofta mycket dyra då de normalt utvecklats för små patientgrupper. I dessa fall finns inget behov av storskalig tillverkning eftersom antalet patienter är för begränsat. Samtidigt finns det förutsättningar för att en behandling ska kunna ge bot. Därför behövs hälsoekonomiska bedömningar. GlaxoSmithKline, som marknadsför Strimvelis för behandling av SCID-ADA, har en ekonomisk modell där återbetalning sker om terapin inte fungerar. Även med denna modell kan priset komma att överstiga vad sjukvården är beredd att betala. I den internationella diskussionen angående terapier för extremt sällsynta sjukdomar förekommer idéer om alternativ finansiering. Utöver medel från sjukvården diskuteras bidrag från stiftelser eller andra intressenter för att täcka kostnaderna. Självfallet kommer behandlingsresultatet att vara avgörande. De hälsoekonomiska analyserna bör också ta hänsyn till de långsiktiga effekterna eftersom ineffektiv underhållsbehandling på sikt kan bli väldigt kostsam.
Antalet godkända terapier med oligonukleotider förväntas öka snabbt. Även dessa läkemedel är dyra: i USA kostar behandling med Spinraza för spinal muskelatrofi 750 000 dollar under det första levnadsåret. När patenten gått ut förväntas terapi med oligonukleotider bli betydligt billigare.
Genterapier där hela arvsanlag överförs kommer sannolikt också att sjunka i pris, men produktionskostnaden är betydligt högre. Även om endast ett fåtal sådana preparat ännu har godkänts finns ett antal läkemedel i pipeline, till exempel behandling för blindhet, epidermolysis bullosa, hemofili och cancer.
Antalet allvarliga biverkningar vid genterapi har varit relativt litet bland de tusentals patienter som redan ingått i kliniska prövningar. Det kan kanske verka förvånande eftersom sådana ofta fått mycket stor uppmärksamhet, men det har säkert delvis att göra med att orsaken till biverkningar vid genterapi är lättare att fastställa än för andra preparat. Observationstiden för de flesta är i nuläget dock fortfarande kort, och det är viktigt att fortsatt vara observant eftersom negativa effekter av till exempel integrerande virusvektorer kan dröja. Skulle exempelvis tumörsuppressorgener inaktiveras, vilket kan förväntas när nya arvsanlag integreras i genomet, kan det dröja lång tid innan även den andra kopian av anlaget genomgår en förändring. Endast långtidsuppföljning kommer att ge svar på hur säkra och effektiva behandlingarna är över tid. För enstaka patienter som framgångsrikt behandlats med genterapi är dock observationstiden mer än 15 år.
För att utveckla området i Sverige gör Vinnova och Vetenskapsrådet tillsammans med svensk akademi, industri och hälso- och sjukvård en mångmiljonsatsning på cell- och genterapi genom att finansiera ett nytt nationellt centrum – CAMP (Center for Advanced Medical Products) – som under en 6-årsperiod kommer att arbeta med att få fram nya gen- och cellterapibaserade behandlingar till kliniskt bruk. Mer specifikt kommer CAMP, som baseras på redan befintliga infrastrukturer inom akademi, hälso- och sjukvårdsregioner, företag och forskningsinstitut i Sverige, att arbeta med utmaningar såsom processutveckling, tillverkning, kvalitetskontroll samt regulatoriska, juridiska och etiska aspekter.
Såväl genterapi där cellernas arvsmassa förändras som behandling med oligonukleotider har under de senaste åren visat sin stora potential. Vägen till framgång har varit allt annat än spikrak, men grundforskning, kombinerad med ökad förståelse av sjukdomsmekanismer och avancerad läkemedelsutveckling, har gjort skillnad. Det är för tidigt att sia om den framtida utvecklingen, men det är principiellt mycket viktigt med dessa genombrott eftersom det rör sig om helt nya terapiformer. Det är särskilt värt att notera att det nu finns verksamma behandlingar för flera sjukdomar där det tidigare fanns mycket lite, eller ibland nästan inget alls, att erbjuda.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Milstolpar
1972: Konceptet klinisk genterapi presenteras i tidskriften Science [2].
1989: Genmärkta celler överförs till människa vid NIH (National Institutes of Health), USA. Neomycinresistensgen överförs med retrovirus för att spåra autologa tumörinfiltrerande celler från patienter med malignt melanom [3].
1990: Första genterapiprövningarna vid svår kombinerad immundefekt orsakad av brist på enzymet adenosindeaminas (SCID-ADA) utförs vid Hospitale San Raffaele, Milano, Italien och NIH [4].
1995: Första svenska genöverföringen till patient utförs vid Huddinge sjukhus. Neomycinresistensgen överförs med retrovirus för att spåra kvarvarande myelomceller vid återfall efter autolog stamcellstransplantation [5].
1998: Vid Huddinge sjukhus genomförs den första svenska genterapibehandlingen av patienter med kardiovaskulär sjukdom genom injektion av plasmid med genen för vaskulär endotelcellstillväxtfaktor (VEGF) i hjärtmuskeln [6].
1998: I USA blir Vitravene (fomivirsen) den första av FDA (Food and Drug Administration) godkända behandlingen med oligonukleotider (mot CMV-retinit hos främst patienter med aids) [7]. Samma preparat godkändes av EMA (European Medicines Agency) år 1999 som första terapi med oligonukleotider i Europa.
1999: Första dödsfallet i en genterapistudie inträffar vid University of Pennsylvania, USA. Patienten Jesse Gelsinger, vars namn offentliggjorts, led av ärftlig ornitintranskarbamylasbrist och drabbades av en letal inflammatorisk reaktion orsakad av adenovirusvektor injicerad i leverartären.
2000: Botande behandling av SCID-X1, som genomförts vid Hôpital Necker i Paris, rapporteras i Science [8].
2001: Första godkända genterapipreparatet i världen (Gendicine; onkolytiskt virus mot tumörer) godkänns av Kinas läkemedelsverk. Inte godkänt av EMA eller FDA.
2012: Glybera (alipogentiparvovek) blir det första EMA-godkända genterapipreparatet vid lipoproteinlipasbrist.
2012: Första rapporten om effektiv behandling av B-cellslymfom med genmodifierade T-celler (CAR-T-cellsbehandling) utförd vid NIH, USA [9].
2015: Första svenska/europeiska terapin med CAR-T-celler utförs vid Akademiska sjukhuset i ett samarbete mellan Uppsala universitet och Karolinska universitetssjukhuset.
2017: Den första FDA-godkända genterapin blir CAR-T-celler för behandling av akut lymfatisk leukemi samt snart därefter för diffust storcelligt B-cellslymfom (Tabell 1).