PCR-metoder, till exempel Cobas TaqMan MTB-testet, kan användas för snabbdiagnostik av tbc och fungerar väl för prov från luftvägarna som är positiva vid mikroskopi.
PCR fungerar otillfredsställande för prov från såväl luftvägar som andra lokaler som är negativa vid mikroskopi och kan ge såväl falskt negativa som falskt positiva provsvar.
PCR har hög specificitet i direkt positiva prov från luftvägar och man kan alltså snabbt skilja mellan tbc och infektioner orsakade av miljömykobakterier.
PCR kan inte användas för att bedöma behandlingsresultat, påvisa återfall eller för att utesluta tbc.
PCR är inte heller lämplig för att bedöma smittsamhet eller för smittspårning vid tbc.
Onödiga och felaktiga provbeställningar utgör ett stort resursslöseri i vården och kan dessutom resultera i missvisande diagnoser.
Tuberkulos (tbc) kan vara mycket svår att diagnostisera. Under senare delen av 1900-talet minskade antalet tbc-sjuka dramatiskt, och år 2003 registrerades enbart 410 nya fall i Sverige. Erfarenhet och kunskap om tbc hos sjukvårdspersonal minskade följaktligen, liksom anledningen att följa utvecklingen inom fältet. Sedan år 2003 har incidensen emellertid stigit och år 2016 var antalet nya fall 734. Internationella erfarenheter visar att tbc sannolikhet kommer att öka ytterligare i Sverige, liksom antalet fall med multiresistenta stammar. Detta gör att en välfungerande diagnostik är utomordentligt väsentlig, vilket förutsätter goda och moderna kunskaper hos sjukvårdspersonal.
Den säkraste och känsligaste metoden för att diagnostisera tbc, det vill säga påvisa Mycobacterium tuberculosis-komplexets bakterier (MTC), är odling. Detta tar lång tid, och ett svar kan dröja upp till 8 veckor. Molekylärbiologiska metoder (PCR) har inneburit att tiden förkortas till bara någon dag, men metoderna är enbart validerade för luftvägsprov (sputum- och bronkoskopiprov). Kliniska krav gör dock att PCR efterfrågas även för provmaterial från andra lokaler. Ytterligare skäl till att PCR-diagnostik efterfrågas kan vara de framgångar denna typ av metoder rönt inom andra områden. Också när misstanken om tbc är svag eller när man avser utesluta tbc förekommer det att PCR efterfrågas. Det är heller inte helt ovanligt att man efterfrågar denna metod för kontroll av behandlingsresultat vid tbc.
Tbc-diagnostik med PCR
På 1990-talet utvecklades PCR-tekniken inom tbc-diagnostiken, och det fanns stora förhoppningar om att man skulle kunna utveckla snabba metoder för alla former av tbc, i synnerhet den fruktade meningiten. Roche lanserade Cobas Amplicor MTB-test [1], som dock enbart blev validerat för luftvägsprov. Denna metod började användas på ett stort antal tbc-laboratorier världen över, och flera utvärderingar gjordes [2-4, 6]. Metoden infördes på Sahlgrenska sjukhusets laboratorium för mykobakteriologisk diagnostik 1997 och en utvärdering gjordes efter några år [6]. Studien omfattade 877 prov från nedre luftvägarna samt 564 prov från andra lokaler, vilka analyserades under perioden 1 februari 1997–31 december 2000. Resultaten från denna studie [6] överensstämde väl med studier gjorda på andra laboratorier [2-5], och den samlade bilden var att metoden fungerade väl på mikroskopipositiva (direktpositiva) luftvägsprov men var underlägsen odling när mikroskopinegativa (direktnegativa) luftvägsprov analyserades. Resultaten visade också att Cobas Amplicor MTB-test fungerade otillfredsställande på provmaterial från andra provtagningslokaler. Man konstaterade sålunda att metoden inte fungerade i de sammanhang där den bäst behövdes, till exempel vid misstanke om tbc-meningit.
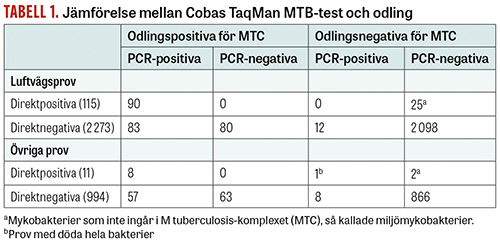
Cobas TaqMan MTB-test har numera ersatt Cobas Amplicor MTB-test [7]. Även detta nya test är bara validerat för luftvägsprov. Denna PCR-metod är för närvarande en av de internationellt mest etablerade metoderna för snabbdiagnostik av tbc. Den omfattande efterfrågan på snabba metoder för diagnostik av tbc har gjort att vi har utvärderat denna metod och publicerat resultatet av utvärderingen [8]. Liksom tidigare utfördes studien vid Sahlgrenska sjukhusets laboratorium för mykobakteriologisk diagnostik med användande av traditionell odling som jämförelse. Studien var retrospektiv och omfattade prov, från såväl barn som vuxna, inkomna under perioden 1 januari 2010–31 december 2012 med frågeställningen »mykobakterieinfektion«. PCR-analyser utfördes på direktpositiva prov och prov där PCR-analys efterfrågades. Totalt omfattade vår studie 3 393 prov, varav 2 388 var från luftvägarna (sputum- och bronkoskopiprov) och 1 005 från andra lokaler (Tabell 1). De 3 393 proven som ingick i studien utgjorde ca 19 procent av alla prov inkomna till mykobakterielaboratoriet.
Alla prov behandlades i enlighet med avdelningens rutiner, det vill säga mikroskoperades (för bedömning av direktpositivitet) och odlades på såväl fast (Löwenstein–Jensen-medium) som flytande (MGIT, Mycobacteria growth indicator tube) substrat. PCR utfördes enligt företagets instruktioner (Roche Diagnostics; 2009).
Tabell 1 visar att 126 av de 3 393 proven var mikroskopipositiva och 98 av dessa var både PCR-positiva och odlingspositiva för MTC. I 27 prov växte så kallade miljömykobakterier, till exempel M avium (60 procent), och dessa var alla såväl PCR-negativa som mikroskopinegativa för MTC. För de mikroskopipositiva luftvägsproven var överensstämmelsen mellan Cobas TaqMan MTB-testet och odling 100 procent, medan den för de mikroskopinegativa endast var 51 procent. Det sammanslagna resultatet för alla luftvägsprov visar en tämligen låg känslighet (68 procent), vilket är i överensstämmelse med resultaten från andra studier [9-11].
De mikroskopipositiva och odlingspositiva proven som inte var luftvägsprov utan tagna från andra lokaler var alla PCR-positiva. De utgjorde emellertid bara 8 stycken, varför man bör vara försiktig med slutsatser. Sammantaget var dock känsligheten för provmaterial från andra lokaler än luftvägarna låg (51 procent) och dessa resultat är också i stort sett överensstämmande med resultat från andra studier [9]. PCR-analyserna av pleuravätska har inte heller fungerat bra. I en studie där prov från 65 patienter med tbc-pleurit analyserades fann forskarna att metoden inte fungerar för diagnostik av denna sjukdom [12].
Flertalet studier visar en låg känslighet för alla mikroskopinegativa prov, inklusive luftvägsproven. I en studie var känsligheten 68,6 procent för mikroskopinegativa luftvägsprov, och denna siffra är bland de högsta [10]. Mikroskopinegativa prov har ju per definition lägre koncentration av bakterieceller än positiva, och provvolymerna vid PCR är långt mindre än de som används vid odling. Tuberkulosbakterierna har dessutom en tendens att klumpa ihop sig och bilda mikroskopiska strukturer (cords). En sådan bildning kan innehålla ett mycket stort antal bakterieceller, vilket ger en ojämn suspension. Ytterligare skäl till PCR-teknikens låga känslighet kan vara att mykobakterier har tjocka lipidrika cellväggar, vilket gör DNA-extraktionen svår.
Falskt positiva PCR-svar
I vår studie [8] var 20 prov från 16 patienter PCR-positiva, men mikroskopi- och odlingsnegativa (Tabell 1). Vidare fanns 1 prov som var PCR-positivt och odlingsnegativt men direktpositivt vid mikroskopi. Detta kom från en patient som redan behandlades för tbc, och provet innehöll alltså döda bakterier. Bland de övriga 16 patienterna med PCR-positiva/odlingsnegativa provsvar hade 6 fått diagnosen tbc och behandlades för sjukdomen. En patient hade haft tbc två år tidigare och en annan var nyligen BCG-vaccinerad. Också i vår tidigare studie fanns PCR-positiva/odlingsnegativa prov från patienter med diagnostiserad och behandlad tbc [6]. Hos sådana patienter finns alltså bakterie-DNA kvar och proven förblir PCR-positiva. DNA kan finnas kvar flera år efter avslutad behandling, och även BCG-vaccination ger positivt PCR-svar. Dessutom kan inte bara DNA utan, som ovan nämnts, även hela döda bakterier finnas kvar efter framgångsrik behandling, vilket ger prov som är odlingsnegativa men med synliga bakterier vid mikroskopering, det vill säga direktpositiva (Tabell 1).
En patient hade upprepat odlingsnegativa prov. Ett av dessa var PCR-positivt. Patienten bedömdes ha klinisk tbc och fick tbc-läkemedel och förbättrades, varför detta positiva PCR-resultat får anses vara sant positivt.
De återstående 7 PCR-positiva men mikroskopi- och odlingsnegativa proven i vår studie kom från 7 olika patienter. Dessa prov var alla sannolikt falskt positiva, då ingen av dessa patienter uppvisade tecken på tbc. Två av dem hade lunginfektioner orsakade av andra agens än tuberkulosbakterier. En patient hade Wegeners granulomatos, en hade cancer, en epilepsi och en fjärde hade empyem med annat agens. Ytterligare en patient var ett litet barn med mässling och pneumoni. Provet från denna patient samt provet från patienten med epilepsi utgjordes av cerebrospinalvätska. I en tidigare studie hade vi fyra fall av falskt positiva prov av cerebrospinalvätska, och dessa patienter hade andra infektioner/sjukdomar i CNS [6]. Provsvar som är falskt positiva kan resultera i felaktig terapi, vilket kan ge olyckliga konsekvenser för de drabbade patienterna.
Framtiden
Utvecklingen inom molekylärbiologisk teknik går mycket snabbt, och det är sannolikt att man inom en snar framtid får känsligare metoder för diagnostik av tbc än dem som finns i dag [13]. Metoderna är för närvarande dyra och komplicerade att använda, men det är sannolikt att såväl billigare som enklare metoder kommer. Det finns för närvarande flera metoder i pipeline men fortfarande är det i första hand direktpositiva luftvägsprov som de fungerar väl för [14, 15]. I en studie gjord nyligen i Hongkong visas att en metod från Abbott har en något ökad känslighet jämfört med Cobas TaqMan MTB-testet [16], men även i denna studie ingick endast prov från luftvägarna. Liknande resultat har nyligen också publicerats i andra studier från Kina [15, 17, 18].
Konklusioner
Det samlade resultatet av våra och andras studier visar att Cobas TaqMan MTB-testet fungerar väl på direktpositiva luftvägsprov men otillfredsställande på direktnegativa prov från såväl luftvägar som övriga lokaler. Metoden har hög specificitet [8, 10, 11] och kan alltså snabbt skilja mellan tbc och infektioner orsakade av miljömykobakterier i direktpositiva luftvägsprov. Detta är en stor fördel då miljömykobakterioser kräver andra läkemedel än tbc. Miljömykobakterier smittar inte mellan människor, varför de smittskyddsrutiner som finns för tbc inte behöver tillämpas i de fall en patient har en infektion orsakad av en miljömykobakterier. Man kan dock inte utesluta att patienter med cystisk fibros smittar varandra med Mycobacterium abscessus, men detta utgör i så fall ett undantag.
Studierna visar också att Cobas TaqMan MTB-testet inte är lämpligt för att bedöma behandlingsresultat, påvisa återfall eller utesluta tbc. Metoden är inte heller lämplig för att bedöma smittsamhet eller för smittspårning.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Läs även: