Adjuvant kemoterapi innehållande antracykliner och taxaner minskar risken för återfall och förbättrar överlevnaden i bröstcancer.
Den relativa nyttan av kemoterapi är oberoende av ålder, tumörstorlek, lymfkörtelstatus, malignitetsgrad, östrogenreceptorstatus eller endokrin behandling. Den absoluta nyttan är dock liten hos patienter med mycket god prognos.
Behandling med läkemedel mot HER2 förstärker effekten av kemoterapi neoadjuvant, adjuvant och mot metastatisk sjukdom och förbättrar överlevnaden vid HER2-positiv bröstcancer.
Målstyrd behandling mot PI3K–AKT–mTOR-axeln och mot CDK4/6 förstärker effekten av endokrin terapi vid spridd hormonreceptorpositiv bröstcancer.
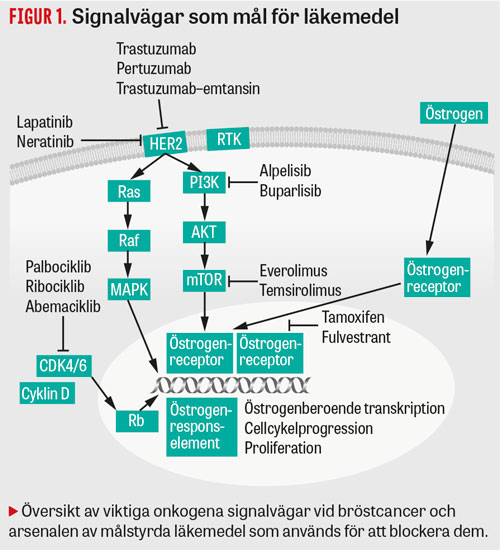
Figur 1
Kemoterapi har sedan drygt fyra decennier varit hörnstenen i den medicinska behandlingen av bröstcancer, både vid avancerad sjukdom och som adjuvant behandling; i den senare situationen är behandlingsmålsättningen bot. Flera preparat har visats ha effekt vid bröstcancer, antingen som monoterapi eller i kombinationer. Aktiva cytotoxiska läkemedel som används kliniskt är antracykliner (doxorubicin och epirubicin), taxaner (paklitaxel och docetaxel), alkylerare (cyklofosfamid, platinaanaloger), antimetaboliter (fluorouracil, gemcitabin, metotrexat) och andra mikrotubulihämmare (vinorelbin och eribulin).
Metastatisk bröstcancer
Vid spridd bröstcancer rekommenderas generellt kemoterapi till patienter med hormonreceptornegativ sjukdom, till patienter med HER2-positiva tumörer i kombination med anti-HER2-läkemedel och till patienter med hormonreceptorpositiva tumörer som progredierat under endokrin behandling. Viscerala metastaser med hotande organsvikt anses vara en indikation för primär kemoterapi, oavsett tumörens biologi.
Även om kombinationsbehandlingar leder till högre responsfrekvens är de förknippade med högre toxicitet än om samma läkemedel ges sekventiellt som monoterapi vid metastatisk bröstcancer [1]. En omfattande äldre metaanalys visade dock att kombinationsbehandling kan ge bättre totalöverlevnad [2]. Sammantaget är dock monoterapi numera oftast att föredra när syftet med behandlingen är palliativt.
Adjuvant kemoterapi
Nyttan av adjuvant kemoterapi vid tidig bröstcancer visades redan på 1970-talet [3]. I denna studie gav kombinationen cyklofosfamid, metotrexat och 5-fluorouracil en reduktion av mortaliteten med 21 procent jämfört med ingen behandling [4].
Under 1990-talet kom dels de första studierna med antracyklinbaserad terapi i stället för kombinationen cyklofosfamid, metotrexat och 5-fluorouracil, dels studier med tillägg av taxaner till antracykliner. Redan 2005 konstaterades att kombinationen av en »bra antracyklinkombination« och 5 års tamoxifenterapi resulterade i en halvering av bröstcancerdödligheten för en medelålders kvinna med östrogenreceptorpositiv bröstcancer [5].
Ytterligare en metaanalys med individdata från 123 randomiserade studier med 100 000 patienter visade att behandling med höga antracyklindoser leder till en relativ minskning av bröstcancermortalitet med 20 procent jämfört med behandling med kombinationen cyklofosfamid, metotrexat och 5-fluorouracil. Metaanalysen visade också att tillägg av taxaner förbättrar överlevnaden i bröstcancer med ytterligare 2 procent i absoluta tal (12 procents relativ förbättring) jämfört med »bra antracyklininnehållande regim« [6]. Metaanalysen visade även att den relativa effekten av adjuvant kemoterapi är oberoende av ålder, tumörstorlek, lymfkörtelstatus, malignitetsgrad, östrogenreceptorstatus eller användning av endokrin behandling.
Långtidstoxiciteten av adjuvant kemoterapi har studerats, och man kunde inte se någon ökning av icke-bröstcancermortalitet. Det bör dock noteras att höga kumulativa doser av antracykliner ökar risken för hjärtrelaterad dödlighet och akut leukemi [5]. Riskökningen är dock relativt sett försumbar jämfört med överlevnadsvinsten av behandlingen. Den omfattande användningen av adjuvanta terapier är den rimligaste förklaringen till den tydliga reduktion i bröstcancerdödlighet som nu noteras i många länder, oaktat att vi behöver minska både under- och överbehandling genom bättre prognos- och behandlingsprediktiva instrument.
Neoadjuvant kemoterapi
Kemoterapi vid icke-metastatisk bröstcancer kan även ges preoperativt, s k neoadjuvant behandling, vanligtvis vid lokalt avancerad bröstcancer. Teoretiska fördelar med neoadjuvant kemoterapi är bl a att man kan monitorera och evaluera effekten av behandlingen in vivo, att den systemiska behandlingen startar tidigare, att den genom en minskning av tumörstorleken kan möjliggöra bröstbevarande kirurgi och att man kan byta behandling hos dem som inte svarat på ursprungligen vald terapi.
En äldre metaanalys av jämförande studier visar att pre- och postoperativ kemoterapi är likvärdiga [7]. Dock har patienter som inte har någon kvarvarande tumör efter neoadjuvant kemoterapi, s k patologiskt komplett remission, signifikant bättre prognos; detta gäller i synnerhet patienter med trippelnegativa eller HER2-positiva tumörer [8, 9].
Dosintensiv och dostät behandling
Dosintensifiering (ökade doser) och dostät behandling (samma dos som ges under kortare tid) är två strategier som har studerats för att förbättra effekten av adjuvant kemoterapi. En metaanalys har visat att högre antracyklindoser är effektivare [6]. Det har även gjorts studier med högdos kemoterapi med benmärgsstöd, men de har inte visat någon överlevnadsvinst jämfört med icke-benmärgsstödd behandling [10]. En metaanalys av studierna med dostät terapi visar att denna strategi förbättrar sjukdomsfri överlevnad med 17 procent och överlevnad med 16 procent jämfört med konventionell behandling [11].
I den nyligen rapporterade internationella PANTHER-studien har en kombination av dosintensiv och dostät behandling jämförts med konventionell adjuvant behandling. Den experimentella behandlingen har förbättrat alla predefinierade effektmått med 17–23 procent, en skillnad som dock inte var statistiskt signifikant, förutom för händelsefri överlevnad [12].
Målstyrda läkemedel
De första generationerna målstyrda läkemedel var riktade mot östrogenreceptorn eller baserade på modellering av mängden fritt tillgängligt östrogen genom användningen av enzyminhibitorer. Denna del av målstyrda läkemedel avhandlas i en separat artikel i detta tema.
Grundförutsättningen för att specifika riktade läkemedel ska ha effekt är att den regleringsväg som läkemedlet ska interagera med har centrala funktioner för cellöverlevnad och/eller bröstcancercellers förmåga till metastatisk spridning.
En viktig observation är att man kan få förändringar av tumörbiologin, östrogenreceptorn och HER2-funktionen under tumörprogression och under spridning av sjukdomen [13-15]. Detta påverkar givetvis handläggningen av patienten, och det är därför viktigt att behålla ett uttryck av mål som man avser att interagera med. Enligt nationella och internationella riktlinjer rekommenderas biopsier av återfallstumörer, vilket förändrar handläggningen hos var sjätte till var sjunde patient på basis av prospektiva data [16, 17].
Det är omöjligt att ge en fullständig beskrivning av alla aktuella läkemedel, speciellt de under utveckling. Denna artikel fokuserar på i dagsläget relevanta läkemedel med effekt på bröstcancersjukdom i återfallssituation och i vissa fall också effekt på mikrometastatisk sjukdom i tidigare bröstcancerbehandling i samband med adjuvant/neoadjuvant annan systembehandling.
HER2-läkemedel
De grupper av läkemedel som kommer att beskrivas är de godkända anti-HER2-läkemedlen trastuzumab, lapatinib, pertuzumab och trastuzumab–emtansin.
Neratinib är ett intressant läkemedel under utveckling; troligen har det sin främsta effekt hos patienter med mutationer i HER2-genens tyrosinkinasdomän. Detta läkemedel har sannolikt bäst effekt hos individer med tumörer med mutationer i tyrosinkinasreceptorns fosforyleringsområde.
Cancergenen HER2 (ofta benämnd c-erb2) utövar sin centrala cellulära verkan genom att vara involverad i celltillväxt, kärlförsörjning och cellers förmåga till metastatisk spridning (Figur 1). År 1987 påvisades för första gången att individer med överuttryck av HER2-genen i sin primärtumör hade väsentligen sämre prognos [18]. Man tog fram en monoklonal antikropp som under 1990-talet kunde testas på ett antal patienter med spridd bröstcancer och överuttryck av HER2-genen. I randomiserade studier påvisades en förlängning av medianöverlevnaden i storleksordningen 5 till drygt 8 månader [19, 20].
Det första anti-HER2-läkemedlet registrerades år 1998 i USA och år 2000 i Europa. Trastuzumab gavs i dessa studier som tillägg till konventionell kemoterapi till de 15–20 procent av bröstcancerpatienter med överuttryck av HER2. Man har senare studerat effekten i adjuvanta och neoadjuvanta situationer, alltså behandling av mikrometastaser. Dessa studier visar sammanfattningsvis en reduktion i risk för återfall med ca 40 procent och en mortalitetssänkning i relativa tal med 30 procent, motsvarande en absolut effekt på upp till 12 procent [21-23].
Anti-HER2-antigenet uttrycks i stora mängder hos 15–20 procent av bröstcancerpatienters tumörer. Små mängder påträffas också i andra organ, bl a hjärtat. Detta kan ha varit en av anledningarna till att man i tidiga studier såg en oroväckande hjärttoxicitet. Till skillnad från antracyklintoxicitet är denna toxicitet i allmänhet övergående, och det är ovanligt med permanent nedsättning av hjärtfunktionen [24]. Vidare studier har kunnat visa att läkemedlet som tillägg till preoperativ kemoterapi ökar den antitumorala effekten och ger en högre frekvens av patologiskt komplett remission; det sistnämnda anses vara en viktig prognosfaktor [25].
Ytterligare anti-HER2-läkemedel har studerats. Tyrosinkinashämmaren lapatinib hade i prekliniska studier data som indikerade hög potens. Prospektiva och jämförande studier mot trastuzumab, med samma jämförelse med kemoterapi, har dock genomgående visat sämre effekt av lapatinib, såväl vid behandling av metastatisk sjukdom som i adjuvanta situationer. Vid indirekta jämförelser tycks det också gälla i neoadjuvanta situationer [26-28]. Vid en interimsanalys i den prospektiva randomiserade ALTTO-studien såg man en så mycket sämre effekt för lapatinib att man var tvungen att stänga denna arm och erbjuda alla patienter tillägg av trastuzumab.
Det potentiella värdet av att kombinera trastuzumab med olika HER2-läkemedel, s k dubbelblockad av HER2, har också studerats. Kombinationen med lapatinib har givit ett visst tilläggsvärde, men ännu större tilläggsvärde har setts med pertuzumab vid spridd sjukdom och i neoadjuvanta situationer. Vid spridd sjukdom erhålls en förlängning av medianöverlevnad med 15,7 månader och i neoadjuvanta situationer ökas frekvensen patologiskt komplett remission [29, 30].
För gruppen patienter med HER2-positiva tumörer och uttryck av östrogenreceptor har studier av kombinationsbehandling gjorts med kombinationer av anti-HER2-läkemedel och bra endokrin terapi. I indirekta jämförelser är behandlingseffekterna dock generellt klart sämre än de effekter man får genom att kombinera med kemoterapi.
Slutligen har försök gjorts med trastuzumab–emtansin, ett mikrotubulihämmarliknande cytostatikum som är direkt kopplat till antikroppen. Dessa försök har visat en direkt cytostatisk effekt och en relativt sett liten systembiverkning av denna kombination genom att cytostatika levereras specifikt i tumörcellerna. Det möjliga problemet vid tumörer med heterogent uttryck av HER2-proteinet är klonal selektion av celler som inte uttrycker HER2 och därmed bristande behandlingseffekt. Data vid spridd sjukdom är dock tydligt positiva: man får knappt 6 månaders medianöverlevnadsförlängning med trastuzumab–emtansin jämfört med tidigare standard (en kombination av lapatinib och capecitabin [ett cytostatikum]) [31].
Trastuzumab–emtansin är i allmänhet vältolerabelt; dock ses inte sällan biverkningar i form av stegrade leverenzymer och sjunkande trombocyter. Dessa biverkningar är generellt inte oroande, och behandlingen kan i de flesta fall fortsätta. Det pågår en svensk prospektiv och randomiserad studie som jämför nuvarande standard för preoperativ behandling för HER2-positiva tumörer (trastuzumab, pertuzumab och docetaxel) mot trastuzumab-emtansin (ClinicalTrials.gov NCT00875979).
Läkemedel mot PI3K, mTOR och AKT
För att ytterligare förbättra effekten av endokrin terapi har man utvecklat olika läkemedel mot signalvägarna för fosfatidylinositol-3-kinas (PI3K) och »mammalian target of rapamycin« (mTOR), eftersom dessa anses vara av betydelse för effekten av hormonell terapi (Figur 1). Hämning av dessa signalvägar har påståtts reversera s k endokrin resistens. Detta är dock inte säkerställt; snarare förstärker läkemedel mot dessa signalvägar effekten av hormonell terapi.
Fosfatidylinositol-3-kinas består av en katalytisk enhet med fyra isoformer (alfa, beta, gamma och delta) och en regulatorisk enhet. Uppskattningsvis har 25 procent av bröstcancerpatienter mutationer i PIK3CA-genen, som kodar för den katalytiska enheten alfa. Denna mutation i bröstcancercellen är den vanligaste mutationen hos patienter med bröstcancer. Vissa läkemedel mot fosfatidylinositol-3-kinas har som syfte en bred blockad av de olika isoformerna, medan andra har som målsättning att vara specifika.
I fas 3-studier finns alpelisib och buparlisib för patienter med avancerad bröstcancer. I dagsläget finns inga konklusiva data avseende dessa nya läkemedels effekter, men preliminära fynd indikerar att de har en liknande biverkningsprofil som då man inhiberar mTOR (se nedan). Ett relativt stort antal metabola förändringar ses, och vid inhibitionen ses immunologiskt relaterad lungtoxicitet.
Det finns ett antal läkemedel som hämmar mTOR, bl a temsirolimus och everolimus. Dessa preparat har använts tidigare och i annan dosering för att modulera immunsystemet. Vid behandling av bröstcancer ses med everolimus en tydlig förbättring av tiden till sjukdomsprogress med i storleksordningen 4 till 6 månader [32]. I en subgruppsanalys var effekten likvärdig i alla undergrupper, det var alltså inte möjligt att identifiera individer som hade mer eller mindre nytta av läkemedlet i relation till tidigare given terapi och metastaslokal. Studien är sedermera uppdaterad. Trots kvarstående förbättring av medianöverlevnaden med drygt på 4 månader sågs ingen formell statistisk överlevnadsvinst [33]. Everolimus kännetecknas av en lång rad biverkningar, t ex stomatit och pneumonit. De är i de flesta fall väl hanterbara, men kräver ofta dosjustering till individuellt accepterad toxicitet.
Det skulle också kunna vara av stort intresse att utveckla läkemedel mot AKT (proteinkinas B). Mutationer i AKT är dock väsentligen ovanligare, endast ca 3 procent av bröstcancerpatienter har mutationer i denna gen.
Inhibition av cyklinberoende kinaser
Basalt i den förlorade tillväxtkontrollen hos cancerceller är att cellcykeln inte regleras på det finstämda sätt som är fallet i normala celler. Cykliner har en central funktion i reglering av cellcykeln, och därför har flera läkemedel tagits fram mot cyklinberoende kinaser (CDK). För närvarande pågår kliniska studier med ett tiotal CDK-inhibitorer. Flertalet av dem hämmar flera medlemmar i CDK-familjen, men hämning av CDK4/6 förefaller viktig för östrogenreceptorpositiv bröstcancer.
Abemaciklib, ribociklib och palbociklib är alla i fas 3-studier. För palbociklib är två fas 3-studier rapporterade, och läkemedlet är nu godkänt i USA och Europa. I den jämförande studien av palbociklib i kombination med fulvestrant respektive enbart fulvestrant fick man en 5 månaders förbättring av progressionsfri överlevnad. Den vanligaste biverkningen var neutropeni grad 3–4. Liknande data sågs i en annan fas 3-studie där palbociklib kombinerades med letrozol och jämfördes med enbart letrozol [34]. I båda dessa studier sågs markant förbättring av progressionsfri överlevnad, men om detta kommer att resultera i någon överlevnadsvinst är ännu oklart.
Immunterapi
Immunterapi vid cancer har under de senaste åren revolutionerats med utvecklingen av en antikropp mot cytotoxiskt lymfocytassocierat antigen 4 (CTLA-4) och antikroppar mot »programmed cell death protein 1« (PD-1) respektive motsvarande ligand PD-L1. Med läkemedel mot de sistnämnda har man sett gynnsamma effekter vid en lång rad tumörsjukdomar, bl a vid trippelnegativ bröstcancer. Man såg 19 procents svarsfrekvens för trippelnegativ bröstcancer i en fas 2-studie av intensivt förbehandlade patienter [35-37].
Kanske ännu mer intressant är behandlingsförsöken med en kombination av PD-L1-hämning och kemoterapi där den antitumorala effekten var 70 procent i första linjen och 25–30 procent i den andra linjen [38].
Bisfosfonater och denosumab
Bisfosfonater är osteoklasthämmande läkemedel som ursprungligen har utvecklats för och använts vid osteoporosbehandling. Vid bröstcancer spridd till skelettet har bisfosfonater använts i flera år. En metaanalys av 9 studier har visat att bisfosfonater minskar risken för skelettrelaterade händelser, t ex patologiska frakturer, medullakompression och behov av palliativ kirurgi och strålbehandling; de kan även minska smärta och förbättra livskvalitet [39].
Förutom den skelettstärkande funktionen finns även data om att bisfosfonater kan ha direkt antitumoral effekt, och olika preparat har studerats extensivt även som adjuvant behandling av bröstcancer. En metaanalys baserad på individdata från 36 randomiserade studier visar att adjuvant bisfosfonatbehandling leder till signifikant minskning av skelettmetastaser med 2,9 procent och bröstcancerdödlighet med 3,1 procent efter 10 års behandling hos postmenopausala patienter. Dock påvisades inga signifikanta effekter för patienter som var premenopausala när behandlingen startades [40].
Ett relativt nytt tillskott vid behandling av skelettmetastaserande bröstcancer är denosumab, en hämmare av RANKL och därmed osteoklastfunktion. I jämförande studier med zoledronsyra gav denosumab en reduktion av skelettrelaterade händelser med 22 procent [39]. Andra fördelar med denosumab är att det administreras som en subkutan injektion och att det kan ges till patienter med nedsatt njurfunktion.
Potentiella bindningar eller jävsförhållanden: Theodoros Foukakis har fått konsult-/föreläsningsarvode från Novartis, Pfizer, Roche och Eisai, författararvode från UpToDate samt forskningsanslag till Karolinska universitetssjukhuset från Roche och Pfizer. Jonas Bergh har fått författararvode till Asklepios Medicin HB från UpToDate samt forskningsanslag till Karolinska institutet och Karolinska universitetssjukhuset från AstraZeneca, Amgen, Bayer, Merck, Pfizer, Roche och Sanofi-Aventis.






















