Den primära kirurgiska behandlingen vid malignt melanom är välstuderad, och stor konsensus råder i riktlinjer världen över.
Stora framsteg har dock gjorts inom det medicinska fältet under de senaste åren. Detta kommer att medföra att många av de behandlingsprinciper som tillämpas i dag kommer att behöva omprövas inom en relativt snar framtid.
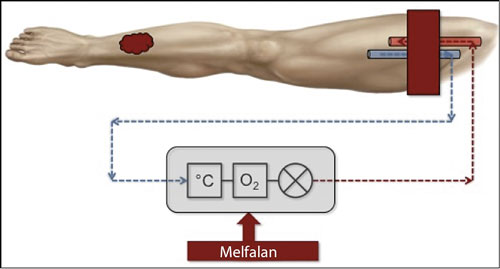
Figur 1. Principskiss för isolerad hyperterm perfusion visar ben med tumör på underbenet. Femoralvenen och -artären är frilagda och kanylerade, en blodtrycksmanschett sitter högt upp på låret och ven- och artärkatetrarna är anslutna till en hjärt–lungmaskin bestående av en värmeväxlare, en oxygenator och en pump. Till detta tillsätts sedan cytostatika (melfalan).
Illustration: Roger Olofsson Bagge
Den primära kirurgiska behandlingen vid malignt melanom är välstuderad, och stor konsensus råder i behandlingsriktlinjer världen över. Denna artikel syftar till att ge en överblick över de riktlinjer som används i dag; mycket är hämtat från det nationella vårdprogrammet för malignt melanom. Eftersom stora framsteg har gjorts inom det medicinska behandlingsfältet under de senaste åren, vilket också redovisas i detta tema, är det möjligt att många av dagens behandlingsprinciper kan komma att omprövas inom en relativt snar framtid.
Primär excision är den första kirurgiska åtgärden
Den första kirurgiska åtgärden, den diagnostiska excisionen, möjliggör både en patologisk diagnos (PAD) med viktiga prognostiska markörer och botar dessutom de flesta patienter. Melanommisstänkta lesioner ska excideras i sin helhet. Snittet ska läggas vinkelrätt mot hudytan, med en makroskopisk marginal på ca 2 mm. Biopsier ska undvikas, eftersom de inte alltid är representativa och kan ge falskt negativt resultat; ett undantag kan t ex vara stora förändringar i ansiktet där lentigo maligna melanom misstänks. Förändringar på extremiteter bör tas via längsgående snittföring, vilket underlättar senare primärsuturering vid den utvidgade excisionen [1].
Utvidgad excision då diagnosen fastställts
Då diagnosen fastställts rekommenderas vid malignt melanom utvidgad excision med ytterligare marginal i syfte att säkerställa radikalitet. Marginalen mäts utifrån ärret efter den diagnostiska excisionen och är 1 cm för tunna melanom (tjocklek enligt Breslow ≤1 mm), 2 cm för tjocka melanom (Breslow >1 mm) och 0,5 cm för in situ-melanom. Hud och underhudsfett medtas ända ner till fascia, periost eller perikondrium. Mindre excisionsmarginaler än de rekommenderade kan övervägas för melanom på särskilda lokaler, såsom akralt eller inom huvud- och halsområdet på grund av funktionella och kosmetiska hänsynstaganden [1].
De excisionsmarginaler som rekommenderas är baserade på flera randomiserade studier, där Sverige bidragit stort [2].
Historiskt ansåg man att det enda sättet att bota patienter med malignt melanom var att göra stora och tidvis mutilerande excisioner. Under årens lopp har man sedan kunnat visa att mindre marginaler är lika säkra, och successivt har hudresektionerna minskat. En studie som randomiserar patienter med tjocka melanom till 2 cm (nuvarande rutin) eller 1 cm excisionsmarginal pågår (MelmarT, ClinicalTrials.gov NCT02385214). Svaret kommer att dröja många år, och till dess kommer nuvarande rekommendationer att vara oförändrade.
Portvaktskörteltekniken utvecklas under sent 1970-tal
Alla patienter med invasivt malignt melanom riskerar spridning av tumörceller till lymfkörtlar. Redan i slutet av 1800-talet gjorde man elektiv lymfkörtelutrymning på patienter med malignt melanom, men studier på 1960- och 1970-talen visade att det inte gav någon förlängd överlevnad, däremot ökad morbiditet [3].
I slutet av 1970-talet utvecklades teorin bakom portvaktskörteltekniken (sentinel node). Initialt användes tekniken för att identifiera de regionala lymfkörtelstationer som var engagerade vid melanom lokaliserade till bålen. I början på 1990-talet utvecklades tekniken genom att både blått färgämne och radioaktiv isotop användes, vilket gav en mycket hög detektionsfrekvens av portvaktskörteln [4].
Den banbrytande studien MSLT-1 (Multicenter selective lymphadenectomy trial) visade att det var säkert att avstå från lymfkörtelutrymning om portvaktskörteln var frisk [5].
Portvaktskörtelbiopsi vid tumörtjocklek >1 mm
Dagens riktlinjer rekommenderar att portvaktskörtelbiopsi genomförs vid malignt melanom med tumörtjocklek >1 mm. Portvaktskörtelbiopsi kan också övervägas vid tunna melanom om det föreligger ulceration eller ökat antal dermala mitoser [1].
Preoperativt injiceras en kolloid med en radioaktiv isotop (teknetium-99m), varefter lymfskintigrafi kan detektera isotopen och därmed kartlägga det regionala lymfdränaget från tumörområdet. Perioperativt sprutas blått färgämne (Patent Blue V) intradermalt vid ärret. Eftersom isotopen även kan detekteras med en handhållen scintillator kan kirurgen på så sätt identifiera en eller flera blåfärgade radioaktiva körtlar under operationen. Dessa excideras och sänds för histopatologisk undersökning.
Vid melanom lokaliserade till extremiteterna återfinns portvaktskörtlar i princip alltid i axillen eller ljumsken. För patienter med melanom lokaliserade till bålen kan dock dränagevägarna vara mer komplexa, och portvaktskörtlar kan återfinnas i flera körtelstationer. Portvaktskörteldiagnostik är erkänt svårare i huvud- och halsområdet, och för att underlätta den anatomiska lokalisationen används också enfotonstomografi med datortomografi (SPECT-DT).
SPECT-DT ger en tredimensionell bild av radionuklidens fördelning i huvud- och halsregionen. Detta är viktigt på grund av varierande lymfdränage med multipla lymfkörtelstationer.
Sammantaget talar utmaningarna vid portvaktskörteldiagnostik inom huvud- och halsområdet för att dessa ingrepp, liksom kirurgisk behandling av konstaterad regional metastasering på halsen, centraliseras regionalt [6].
Portvaktskörtelteknik och lymfkörtelutrymning
Om mikroskopisk spridning av melanomet till portvaktskörtel påvisas, rekommenderar man i dag en kompletterande lymfkörtelutrymning. Detta förfarande har nu dock ifrågasatts eftersom data från en tysk randomiserad studie som jämförde lymfkörtelutrymning med enbart kontroll vid begränsad spridning till portvaktskörteln inte kunde påvisa någon skillnad i recidiv eller överlevnad [7]. I en större studie (MSLT-2) har man på samma vis randomiserat knappt 2 000 patienter med spridning till portvaktskörteln. Ännu finns inga resultat, men dessa lär förhoppningsvis komma snart.
Värdet av den prognostiska information man får från portvaktskörteln, som tillsammans med tumörtjocklek är den viktigaste markören, kommer sannolikt framöver att öka och vara avgörande vid selektion av patienter som kommer att erbjudas framtida adjuvant behandling [8]. Utvecklingen av biomarkörer går dock fort, och det kan mycket väl vara så att vi om några år har lika bra, eller bättre, prognostiska markörer genom blodprov, som därmed kommer att utmana den information vi får genom portvaktskörteldiagnostiken.
Om det finns en klinisk misstanke om makroskopisk spridning till lymfkörtlar ska detta utredas med finnål för cytologisk undersökning. Om metastasmisstanken bekräftas rekommenderas metastasutredning med PET kombinerad med DT (alternativt enbart DT), och om tecken till ytterligare spridning/generalisering saknas ska lymfkörtelutrymning göras. Vid lokala recidiv, satellitmetastaser (<2 cm från tumören/ärret) och in transit-metastaser (>2 cm från tumören/ärret men inom området för dess lymfdränering) rekommenderas i första hand radikal excision. I detta läge behövs dock ingen större marginal som vid den utvidgade excisionen, utan metastasen ska endast excideras radikalt – 2 mm marginal räcker.
Cytostatika lokalt med isolerad hyperterm perfusion
Vid upprepade eller multipla recidiv av melanom lokaliserade till extremiteterna som inte enkelt går att excidera bör man överväga isolerad hyperterm perfusion (isolated limb perfusion, ILP). Metoden är en regional cancerterapi som möjliggör en mycket hög koncentration av cytostatika lokalt i en extremitet med liten risk för generella biverkningar.
Extremiteten (arm eller ben) isoleras kirurgiskt med friläggning av artär och ven, vilka sedan kateteriseras och ansluts till en hjärt–lungmaskin. Blodförsörjningen av extremiteten sker då via hjärt–lungmaskinen, och för att undvika blodflöde genom kollateralkärl stryps dessa med en blodtrycksmanschett som placeras så högt upp på extremiteten som möjligt. Till hjärt–lungmaskinen tillsätts sedan höga doser av cytostatika (melfalan) samtidigt som extremiteten värms till ca 40 °C. Extremiteten perfunderas sedan under 60 minuter, varefter läkemedlet sköljs ut ur extremiteten, katetrarna avlägsnas och den normala blodförsörjningen återställs.
Patienter med stora maligna melanom (>3 cm), patienter som tidigare genomgått behandlingen och patienter med mjukdelssarkom behandlas dessutom med tillägg av tumörnekrosfaktor alfa (TNF-alfa; tasonermin). Detta medför att behandlingstiden blir längre, ca 90 minuter.
Efter behandlingen drabbas de flesta patienterna av svullet, rodnat ben; ca 20 procent får även ytliga blåsbildningar. Dessa biverkningar brukar vara som mest uttalade efter 2–3 veckor, men de är helt ofarliga och går tillbaka. Allvarligare lokala reaktioner uppträder hos 2–3 procent av patienterna; ofta rör det sig om ett subkliniskt kompartmentsyndrom med sekundära nervskador, vilket kan medföra nedsatt känsel eller motorik i extremiteten. I extremt ovanliga fall uppstår en så allvarlig reaktion att extremiteten kan behöva amputeras. Endast enstaka fall har rapporterats i litteraturen.
Patienterna följs upp efter 3 månader för att bedöma respons och toxicitet. Under denna tid har patienterna möjlighet att återkomma till kirurgmottagningen på Sahlgrenska universitetssjukhuset/Sahlgrenska i Göteborg vid behov, alternativt kontakta mottagningen via telefon. För att förebygga trombos erhåller patienterna blodförtunnande behandling under 4 veckor efter operationen. Vid stora tumörmassor kan kontakt med sjuksköterska för såromläggningar behövas, eftersom tumörerna kan blöda/vätska postoperativt. Patienterna kontrolleras enligt det nationella vårdprogrammet åtminstone var 6:e månad under 3 år för att följa behandlingssvaret.
Isolerad hyperterm perfusion har utvärderats mot flertalet cancertyper men används i dagsläget framför allt vid melanom och sarkom [9, 10]. Experimentellt har även flera andra tumörtyper där annan behandling inte gett effekt behandlats framgångsrikt, t ex Merkelcellstumörer, desmoidtumörer, skivepitelcancer och kutana lymfom [11]. I Sverige utförs metoden endast på Sahlgrenska universitetssjukhuset/Sahlgrenska i enlighet med en nyligen genomförd nationell nivåstrukturering. Mer information går att återfinna på www.perfusion.se.
65 procent av patienterna med in transit-metastaser av malignt melanom erhåller komplett respons 3 månader efter behandlingen (alla tumörer borta), ytterligare ca 20 procent har partiell respons där minst hälften av tumörerna försvinner [10]. Om patienten får recidiv med metastaser kan man återupprepa behandlingen, och resultaten är då ungefär desamma som vid den första behandlingen. Några patienter har reperfunderats upp till fem gånger sett över flera år.
Metastaskirurgi kan ge god palliation
Lymfkörtlar, lunga och lever är förutom hud de vanligaste metastaseringslokalerna vid malignt melanom. Kirurgi vid en eller ett fåtal fjärrmetastaser med långsam progress kan ge förlängd överlevnad hos vissa patienter. Tumörreducerande kirurgi (debulking) rekommenderas inte, men däremot bör man ha kirurgi i åtanke även för palliativt syfte. Sannolikt är kirurgi underutnyttjad i dessa fall. Kirurgi av isolerade metastaser i CNS och buken ger god palliation snabbt.
De nya framstegen inom den medicinska behandlingen gör sannolikt att metastaskirurgin får en större roll i framtiden. BRAF-hämmare, som inte så sällan har relativt kortvarig effekt, kommer att användas neoadjuvant för inoperabla patienter med sikte på radikal kirurgi någon månad senare. Andra patienter erhåller immunterapi och får ofta ett partiellt svar med komplett respons av vissa metastaser, medan andra metastaser förblir stabila eller till och med progredierar. Att göra patienten makroskopiskt tumörfri kan vara lockande samtidigt som man fortsätter med systemisk behandling [12].
Förhoppningsvis genomförs studier som undersöker nyttan av kirurgi efter neoadjuvant behandling, vilket kan leda oss in i en ny era av multimodal behandling av generaliserat malignt melanom.
Alla patienter med generell sjukdom bör diskuteras på en regional multidisciplinär konferens före behandlingsrekommendation.
Kirurgi har avgörande roll i behandlingen
Sammanfattningsvis har kirurgi fortfarande en avgörande roll vid behandling av malignt melanom, eftersom de flesta patienter blir botade av den primära excisionen. Vilka marginaler som används vid den utvidgade excisionen studeras fortfarande, men mest sannolikt dröjer det flera år innan riktlinjerna ändras. Förfarandet vid spridning till portvaktskörteln kan däremot ändras inom en snar framtid, eftersom data från studien MSLT-2 inom kort blir tillgängliga.
Kirurgi vid en eller några få metastaser kan ge en förlängd överlevnad hos vissa patienter, men kräver noggrann selektion. Eftersom utvecklingen är snabb inom det medicinska fältet är det högst troligt att patienter som är inoperabla i dag blir möjliga att operera i framtiden.
Potentiella bindningar eller jävsförhållanden: Roger Olofsson Bagge har erhållit föreläsningsarvode (Roche), forskningsanslag (AstraZeneca) och ersättning för arbete i rådgivande kommitté (Amgen).






















