Ögonmelanom är en potentiellt livshotande tumör som utgår från melanocyter i uvea, konjunktiva och i sällsynta fall från orbita.
Uveala och konjunktivala melanom har helt olika biologi och kräver därför olika typ av behandling vid spridd sjukdom.
Mukosala melanom är sällsynta och har dålig prognos, sannolikt på grund av att de diagnostiseras i avancerat skede.
Vid spritt mukosalt melanom är mutationsanalys av tumören viktig för val av eventuell medicinsk palliativ terapi.
Melanom uppstår ibland på andra ställen än i huden, som i ögon och slemhinnor. Dessa melanom har en annorlunda biologi och klinisk bild och behandlas ofta på ett annat sätt än hudmelanom.
Ögonmelanom
Ögonmelanom är en potentiellt livshotande tumör som utgår från melanocyter i uvea, konjunktiva och i sällsynta fall från orbita. Ögonmelanom är den vanligaste ögontumören, och ögat är den vanligaste lokalisationen för icke-kutana maligna melanom. Ögonmelanom utgör cirka 2,1 procent av alla melanom i Sverige. Uveala och konjunktivala melanom har helt olika biologi och kräver därför olika typ av behandling.
Uveala melanom
Uveala melanom är den vanligaste primära ögontumören. Medan andelen hudmelanom ökar är incidensen uveala melanom stabil [1]. I Europa varierar incidensen beroende på geografisk latitud. I Sverige är incidensen 70–80 nya fall per år [2]. Uveala melanom är vanligast hos den medelålders vita befolkningen. Miljöfaktorer förefaller inte spela någon roll för uppkomsten av uvealt melanom; till exempel har betydelsen av exponering för UV-ljus inte kunnat klarläggas [3]. Kända riskfaktorer för att utveckla uvealt melanom är ljus hy, ljus ögonfärg, okulär melanocytos, dysplastiskt nevussyndrom och förekomst av nedärvd BAP1 (BRCA1-associated protein 1)-mutation [4-5].
De flesta uveala melanom uppkommer i redan existerande nevus men kan också uppstå de novo eller från okulodermal melanocytos [6]. Majoriteten av uveala melanom uppstår i koroidea och resterande i iris eller corpus ciliare [7]. Den molekylära patogenesen till uvealt melanom skiljer sig från hudmelanom. Hos merparten av hudmelanom finns aktiverande mutationer i BRAF eller RAS, vilket inte förekommer hos uveala melanom där man i stället har punktmutationer i GNAQ och GNA11 vilka kan hittas hos cirka 80 procent av patienterna [8-10].
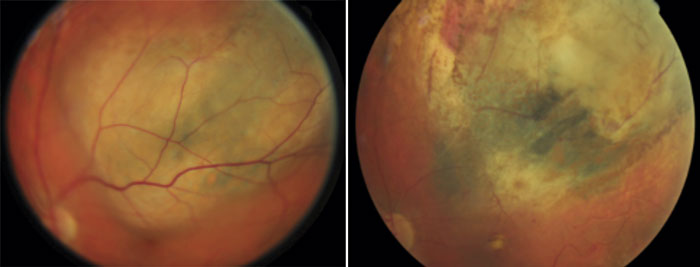
Uvealt melanom debuterar oftast med ögonsymtom, synlig tumör eller värk [11]. De är vanligtvis pigmenterade, kupolformade eller kragknappsformade förändringar. Tumören är pigmenterad i 55 procent och icke pigmenterad i 15 procent av fallen, och resterande 30 procent utgörs av en blandform av pigmenterad/icke pigmenterad tumör [7]. Om undersökningen görs av erfaren ögonläkare kan, till skillnad från andra maligna sjukdomar, diagnosen uvealt melanom ställas med 95 procents säkerhet utan behov av invasiva metoder [12-13]. Om diagnos ej kan ställas kliniskt och med icke invasiva metoder kan tumörbiopsi utföras [14]. Patienter med uvealt melanom utvecklar framför allt metastaser till lever, lunga och hud. Leverundersökning var 6:e månad med ultraljud alternativt MR-undersökning föreslås för att tidigt upptäcka eventuell tumörspridning [15].
Stadieindelningen TNM är validerad även för uvealt melanom. En annan metod, genuttrycksmönster (gene expression profiling, GEP), baserad på tumörbiopsi och analys med mikromatris har kunnat identifiera två klasser: klass 1, som är förenad med lägre risk att utveckla metastaser och associerad med EIF1AX-mutationer, samt klass 2 som är förenad med högre risk att utveckla metastaser och associerad med BAP1-mutationer [16, 17]. Flera cytogenetiska avvikelser har visat sig vara associerade med prognos vid uvealt melanom. Monosomi 3 och förstärkning av 8q är båda korrelerade till förkortad överlevnad oberoende av varandra men framför allt i kombination [18]. Sekvensering av uveala melanom med monosomi 3 ledde till upptäckten av inaktiverande somatiska mutationer i BAP1 på kromosom 3p21.1 [5]. BAP1-mutationer hittas hos cirka 50 procent av alla melanom och associeras med utveckling av metastaser [19]. Man har också funnit en hereditär BAP1-mutation i några släkter med familjärt uvealt melanom och andra tumörsjukdomar [20]. Mutationerna SF3B1 och EIF1AX är i stället korrelerade med bättre prognos och hittas hos 18 respektive 24 procent av alla fall [16, 21].
Behandlingen av uvealt melanom syftar till att bibehålla syn och förhindra uppkomst av metastaser. Man har dock visat att valet av primärbehandling inte påverkar risken för systemisk spridning och överlevnad [22]. Irismelanom behandlas vanligtvis med kirurgisk excision, brakyterapi eller kirurgiskt avlägsnande av ögat. Vid behandling av tumörer i corpus ciliare och koroidea kan brakyterapi, protonstrålbehandling eller kirurgi utföras. I Sverige används för närvarande brakyterapi med isotoperna jod-125 eller rutenium-106, eller kirurgi med avlägsnande av hela ögat (Figur 1). Lokal behandling av uvealt melanom är effektiv och kontrollerar sjukdomen lokalt i 95 procent av fallen, men ändå utvecklar nära 50 procent av patienterna metastaser under de första fem åren efter diagnos. Mikrometastaser finns sannolikt redan vid diagnostillfället även om andelen då detekterbara metastaser endast är 1–2 procent [23]. Patienter med spridd sjukdom kan behandlas med partiell leverresektion, radiofrekvensablation, immunterapi med ipilimumab, kemoembolisering av levern, intrahepatisk arteriell kemoterapi eller systemisk kemoterapi som ibland kan ge en förlängd överlevnad [24].
För närvarande pågår i Sverige en kliniskt randomiserad studie, SCANDIUM, som syftar till att utvärdera om intrahepatisk leverperfusion kan förlänga överlevnaden hos uveala melanompatienter med spridning till levern [25].
Konjunktivala melanom
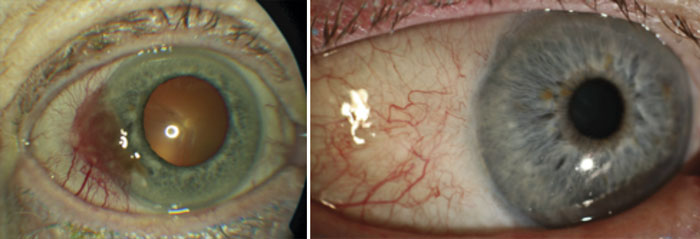
Konjunktivala melanom utgör 3,7 procent av alla ögonmelanom. Den åldersstandardiserade incidensen ökar och är för närvarande mellan 0,1 och 0,8 fall per 1 000 000 invånare [26, 27] under tidsperioden 1960–2005 [28]. Hos barn är konjunktivalt melanom mycket ovanligt. Konjunktivala melanom uppträder vanligtvis som pigmenterade förändringar men kan också vara opigmenterade [29]. De uppkommer vanligast i primär förvärvad melanos (primary acquired melanosis, PAM), ibland de novo och mer sällan i konjunktivala nevus. Ibland kan primär förvärvad melanos sprida sig till huden och kallas då lentigo maligna.
Konjunktivala melanom kan kliniskt delas in i tumörer belägna på bulbära konjunktiva, icke-bulbära konjunktivala tumörer och tumörer med invasion av ögonglob, orbita, ögonlock, sinus eller CNS [30]. Patologiklassificeringen av konjunktivala melanom baseras på vertikal tjocklek och invasionsdjup. Tumörtjocklek enligt Breslow används normalt inte för att karakterisera konjunktivala melanom. Den molekylära biologin när det gäller konjunktivalt melanom skiljer sig från uvealt melanom, och konjunktivala melanom har större likheter med hudmelanom. Aktivering av MAPK via mutationer i BRAF och NRAS är, liksom vid hudmelanom, vanliga vid konjunktivala melanom.
Behandlingen av konjunktivalt melanom är kirurgi i kombination med lokal kryobehandling av resektionsränder [31] (Figur 2). Preoperativ tumörbiopsi bör, liksom vid hudmelanom, undvikas för att förhindra recidiv och uppkomst av metastaser [32]. Lokal adjuvant kemoterapi kan förlänga överlevnad och förhindra lokala recidiv vid konjunktivalt melanom med primär förvärvad melanos med atypi [33]. Framför allt används mitomycin C, men interferon alfa-2b topikalt har introducerats som en alternativ, mindre toxisk behandling. Det föreligger dock sparsamt med data om hur effektivt interferon alfa-2b är vid denna diagnos [34]. Vid ofullständig radikalitet på djupet ges postoperativ strålbehandling. Vanligast är brakyterapi – i Sverige används isotoperna strontium-90 eller rutenium-106. Orbital exenteration med vida marginaler kan ibland bli nödvändigt vid utbredda tumörer som ej kan kontrolleras med lokal kirurgi och kryobehandling. Biopsier av portvaktskörteln (SNB, sentinel node biopsy) för att upptäcka mikrometastaser hos patienter med konjunktivalt melanom är omdiskuterat och konsensus saknas [35, 36].
Trots god mikroskopisk marginal återkommer tumören lokalt inom fem år hos 26 procent av patienter behandlade för konjunktivalt melanom med primär förvärvad melanos. Hos patienter med konjunktivalt melanom utvecklar cirka 21–26 procent metastaser [37]. Det finns inga entydiga riktlinjer för uppföljning, men patienter bör följas med ultraljud, datortomografi eller magnetresonanskamera av huvud–halsregionen för att tidigt upptäcka eventuell tumörspridning [38-39]. Vid metastaserande konjunktivalt melanom finns ingen specifik behandling utan i regel erbjuds samma behandling som vid metastaserande kutant melanom.
Orbitala melanom
Melanom i orbita kan uppträda de novo från kongenital okulär melanocytos eller från så kallade blå nevus, alternativt spridas från intilliggande uvealt melanom, ögonlocksmelanom, konjunktivalt melanom eller som metastaser från hudmelanom [40]. Behandlingen av orbitalt melanom innebär kirurgisk excision, exenteration och/eller systemisk cytostatikabehandling, ofta kombinerat med postoperativ strålbehandling.
Mukosala melanom
Mukosala maligna melanom (MMM) är definitionsmässigt tumörer som utgår från slemhinnor, men oftast inkluderas även intilliggande hårlös icke solexponerad hud (»glabrous skin«), till exempel i vulva, delar av näshålan, glans penis och distala delen av analkanalen. Mukosala maligna melanom är sällsynta – i Sverige har vi 50–70 fall per år. De vanligaste lokalisationerna för slemhinnemelanom är huvud- och halsregionen, genitalia och anus–rektum.
Mukosala maligna melanom i huvud- och halsregionen
I en svensk serie av 156 sinonasala melanompatienter fanns 44 procent av melanomen i näshålan, 23 procent i sinus och cirka 20 procent i både näshålan och sinus (okänd primär lokalisation: 13 procent) [41]. Majoriteten (71 procent) av dessa melanom var amelanotiska och 35 procent polypösa vilket primärt försvårar den kliniska diagnosen. Första symtomen är nästäppa eller näsblödning. En mindre andel melanom uppstår i munhåla och svalg.
Anorektala melanom inklusive perianala melanom
I en svensk serie av 251 patienter 1960–1999 fanns 54 procent av melanomen i analkanalen, 24 procent i både analkanalen och distala rektum och 10 procent i anus och perianal hud (okänd primär lokalisation: 11 procent) [42]. Första symtomet var ofta en blödning. Kliniska fyndet var ofta en amelanotisk polyp eller hemorrojdliknande förändring.
Vulvamelanom
I en svensk undersökning av 219 patienter fanns 31 procent av melanomen i labia majora varav majoriteten i den mediala hårlösa delen, 19 procent i labia minora, 31 procent i klitoris, 11 procent periuretralt och 5 procent i introitus vaginae [43]. Första symtomet var oftast en blödning och fyndet en amelanotisk polyp eller »knöl«.
Vaginala melanom
Melanom i vagina, cervix uteri och uretra är mycket sällsynta. Av dessa lokalisationer är vagina vanligast. 70–80 procent av tumörerna växer i nedre tredjedelen av vagina, och majoriteten av patienterna i det svenska materialet har lokalt avancerad sjukdom vid diagnostillfället.
Melanom i de manliga könsorganen
Melanom på de manliga yttre könsorganen och i de nedre urinvägarna är mycket sällsynta. Melanomen är nästan alltid lokaliserade till glans penis, det vill säga »glabrous skin«, och beter sig på liknande sätt som vulvamelanom.
Prognos
Prognosen vid vid mukosala maligna melanom är generellt sämre än vid hudmelanom och är beroende av hur avancerad primärtumören är (T-klassifikation), ålder vid diagnos samt av lokalisation [44]. Vulvamelanom tycks ha bättre prognos än övriga av dessa melanom; i en tysk studie rapporterades en 10-årsöverlevnad på 65 procent vid vulvamelanom jämfört med 22 procent hos övriga [45]. Den observerade 5-årsöverlevnaden i Sverige varierar mellan 13 procent för vaginala melanom och upp till 60 procent för övriga vulvamelanom.
Molekylär klassifikation
Ett antal studier har genomförts av somatiska genmutationer i mukosala maligna melanom. Mutationsmönstret skiljer sig från det som ses vid hudmelanom och varierar även mellan mukosala maligna melanom på olika lokaler. Medan BRAFV600-mutationer är betydligt mer sällsynta än i hudmelanom (mindre än 5 procent), är aktiverande c-KIT-mutationer betydligt vanligare [45-47]. Frekvensen c-KIT-mutationer tycks variera beroende på lokal och är rapporterade i högst frekvens i vulvamelanom (upp till 35 procent) [48]. Detta är av intresse för behandling av avancerad sjukdom. Även antal mutationer i TERT-promotorn är lägre vid mukosala maligna melanom än vid hudmelanom [49]. Testning för onkgenmutationer, i första hand c-KIT och BRAF, bör företas före behandlingsbeslut vid avancerad sjukdom.
Primärbehandling
Handläggningen av patienter med mukosala melanom bör diskuteras vid multidisciplinär konferens. Den viktigaste primärbehandlingen är kirurgi. Strålbehandling kan övervägas för inoperabla tumörer och postoperativ strålbehandling kan vara av värde för förbättrad lokal kontroll, men har inte visats påverka överlevnaden. Strålbehandling kan ges hypofraktionerat med höga fraktionsdoser på upp till 6 Gy, men resultaten jämfört med konventionell fraktionering är inte tillräckligt väl studerade.
Behandling av lymfkörtelmetastaser
Elektiv lymfkörtelutrymning hos patienter utan kliniskt påvisade metastaser har inte visat sig förbättra överlevnaden. Biopsi av portvaktskörteln har rapporterats i mycket små serier hos patienter med mukosala maligna melanom, men det finns ingen publicerad utvärdering av större material av portvaktskörtelbiopsi. I väntan på en sådan utvärdering rekommenderas därför för närvarande enbart terapeutisk lymfkörtelutrymning vid mukosala maligna melanom.
Generaliserad sjukdom
Det finns sparsamt med specifika data om behandlingen av generaliserade mukosala maligna melanom, och då det finns likheter med metastaserande hudmelanom blir behandlingen likartad vid båda tumörtyperna. En skillnad är att det finns en högre frekvens av mutationer i c-KIT-genen och ett ökat antal genkopior i mukosala maligna melanom, framför allt i vulvamelanom, jämfört med hudmelanom, medan BRAF-mutationer är mer ovanliga [48, 50-52]. Det finns ett antal fas 2-studier som visat effekt av tyrosinkinashämmaren imatinib vid c-KIT-muterade mukosala maligna melanom, med objektiva responser hos 23–40 procent, dock med kort progressionsfri överlevnad på cirka 3–4 månader [53-55]. En studie har visat effekter av den nyare kinashämmaren nilotinib hos en mindre andel patienter med c-KIT-muterade mukosala maligna melanom som progredierat på behandling med imatinib [56]. Moderna så kallade T-cellsaktiverande antikroppar (immune checkpoint inhibitors) mot CTLA-4 och PD-1/PDL-1 har ännu inte utvärderats i några prospektiva kliniska prövningar. En retrospektiv multicenterstudie av ipilimumab hos 33 patienter med mukosala maligna melanom visade två responser och en kort medianöverlevnad på cirka 6 månader [57]. I en färsk sammanställning av tidiga studier av PD-1-hämmaren pembrolizumab (Keytruda) identifierades 84 patienter med mukosala maligna melanom. Bland dessa sågs respons hos 19 procent och en medianöverlevnad på 11,3 månader. Terapiresponsen sågs oberoende av om patienter tidigare behandlats med ipilimumab eller inte. Hos gruppen patienter som svarade var mediandurationen av respons 27 månader. PD-1-hämmare har således en klinisk aktivitet vid metastaserande melanom och kan övervägas som behandlingsalternativ [58].
Uppföljning
På grund av den höga risken för återfall rekommenderas efter multidisciplinär konferens individuell uppföljning, i regel med varannan kontroll på opererande klinik och varannan på onkologklinik under 5 år.
Framtid
Det finns goda skäl att prospektivt och konsekutivt samla nationella data om mukosala melanom, genomförda behandlingar och biopsi av portvaktskörteln. På samma sätt bör tumörmaterial sparas för molekylärgenetiska studier för att bättre klargöra spektrum av mutationer vid mukosala melanom. För att få god kunskap om de sällsynta mukosala melanomen krävs gemensamma prospektiva registreringar och studier på nordisk, helst europeisk, nivå.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.