Mellan 5 och 10 procent av patienter med melanom har nära släktingar med melanom.
Individer tillhörande »melanomfamiljer« bör följas med regelbundna hudundersökningar.
CDKN2A-mutationer ses hos 5–20 procent av melanomfamiljer.
CDKN2A-mutationsbärare har ökade risker för andra, ofta rökningsassocierade cancerformer och har behov av screening för dessa.
BAP1-mutationer har identifierats hos svenska patienter med melanom, särskilt hos familjer med ögonmelanom.
Betydelsen av miljön med stark koppling mellan ultraviolett strålning och hudmelanom är välkänd, men tvillingstudier visar även att melanom påverkas starkt av ärftliga faktorer [1]. Samverkan mellan arv och miljö syns tydligt där populationer av ljusa eller rödlätta individer migrerat till soligare breddgrader, till exempel i Australien och Nya Zeeland, som har världens högsta incidenser för hudmelanom.
Bland melanompatienter med nordeuropeiskt påbrå har 5–10 procent nära släktingar med melanom. Det finns relativt god evidens för nyttan av att identifiera individer med hög risk för melanom, som dem med familjär predisposition, och följa dessa i preventiva uppföljningsprogram [2]. Däremot har studier inte kunnat visa någon säker gynnsam effekt av melanomscreening på populationsnivå. I mitten av 1980-talet tillsatte Svenska melanomstudiegruppen en arbetsgrupp (nuvarande Swedish network on familial melanoma, SweFAM) med uppgift att identifiera och registrera familjer med melanom och upprätta uppföljningsprogram för familjemedlemmar, med primär och sekundär prevention, samt att främja forskning inom området.
I början på 1990-talet blev det känt att nedärvda mutationer i tumörsuppressorgenen CDKN2A förekommer hos vissa familjer med melanom [3]. CDKN2A-genen kodar för två viktiga tumörsuppressorer och cellcykelreglerare: p16 och p14ARF. I melanomtumörer och även i andra tumörformer förekommer ofta förvärvade mutationer i CDKN2A-genen, som är så kallade driver-mutationer. Det innebär att dessa mutationer är pådrivande i den process som leder till att celler blir elakartade. Det är därför inte så förvånande att individer som har en nedärvd mutation, som förekommer i kroppens alla celler, har starkt ökad risk för tumörer. Kort efter att nedärvda CDKN2A-mutationer hade beskrivits började man testa för sådana mutationer i Sverige, och inom kort hittades ett antal familjer som var bärare av genmutationer [4, 5]. Intressant är att de flesta svenska familjerna är bärare av exakt samma mutation (p.Arg112dup) i genen. Det visade sig att det var en så kallad founder-mutation, vilket innebär att alla bärare är avkomlingar till den individ hos vilken mutationen en gång uppstod. Det uppskattas att mutationen ägde rum för cirka 2 000 år sedan, troligen i Smålandstrakten, där många bärare har identifierats. Bärare finns i dag utspridda i Sverige, men ännu har man inte hittat mutationen utanför Sverige [6]. Genom tiderna har bärare förmodligen oftast hunnit fortplanta sig innan de insjuknat, vilket gjort att mutationen levt vidare i populationen. CDKN2A-mutationer påträffas i 5–20 procent hos familjer med melanom; frekvensen varierar mellan olika länder och populationer samt påverkas av hur man definierar en »melanomfamilj«.
Definition av familjärt melanom
I en rapport från 2007 om det svenska preventiva programmet drogs följande slutsatser: 1) deltagande i preventivt program ledde till att melanom hittades vid ett tidigare stadium hos familjemedlemmar, 2) nya melanom hittades framför allt i familjer med två eller fler förstagradssläktingar med melanom, 3) nya melanom hittades oftare hos familjemedlemmar som redan hade melanom, samt 4) bland dem som var bärare av en mutation i CDKN2A-genen [2].
Innan dess att denna rapport, och liknande observationer från andra länder, kommit fram hade definitionen av familjärt melanom varit relativt bred. Det räckte ofta med två biologiska släktingar (första-, andra- eller tredjegradssläktingar) med melanom för att familjen skulle definieras som melanomfamilj. Dysplastiska nevus skulle även finnas hos familjemedlemmarna, och familjerna kallades för DNS (dysplastiskt nevussyndrom)-familjer.
På senare år har det skett en omvärdering där man gått mot mer stringenta kriterier vad gäller antal melanom och närheten i släktskap mellan familjemedlemmar med melanom. I början på året utkom nya nationella riktlinjer för familjärt melanom, utarbetade av SweFAM-gruppen. Dessa riktlinjer finns tillgängliga via hemsidan för Regionala cancercentrum i samverkan (RCC) [7]. Den nya definitionen av familjärt melanom innefattar inte dysplastiska nevus, utan först och främst tas hänsyn till antal och släktskap mellan familjemedlemmar med melanom (Fakta 1). Forskning har visat att andelen familjer som påträffas med CDKN2A-mutationer på så sätt stiger och att familjer som är mer stringent definierade har större nytta av uppföljningsprogram då riskerna är högre för nya melanom i dessa familjer [2]. Dysplastiska nevus förekommer inte sällan i familjer med melanom, men det har visat sig att de ofta också förekommer utan samband med melanom samt att många melanomfamiljer inte har dysplastiska nevus [8, 9]. Definitionen innefattar även familjer med bukspottkörtelcancer (adenokarcinom) i kombination med melanom, då sannolikheten för att identifiera CDKN2A-mutationer är betydande i sådana familjer (se nedan).
Sämre överlevnad hos individer med CDKN2A-mutationer
Kort efter att kopplingen mellan melanom och nedärvda CDKN2A-mutationer blev känd började man se att andra tumörer ofta förekom inom en del familjer med mutationer. Hos svenska founder-mutationsfamiljer, samt även hos bärare av en del andra CDKN2A-mutationer, såg man att det fanns ökad risk för bukspottkörtelcancer, men mindre kunskap fanns om risker för andra tumörer [10, 11]. Det är nu känt att bärare av den svenska CDKN2A-founder-mutationen, förutom en ökad risk för melanom och bukspottkörtelcancer, även har en ökad risk för annan, ofta rökningsassocierad cancer, specielltlungcancer, huvud- och halscancer samt mag- och matstrupscancer [12].
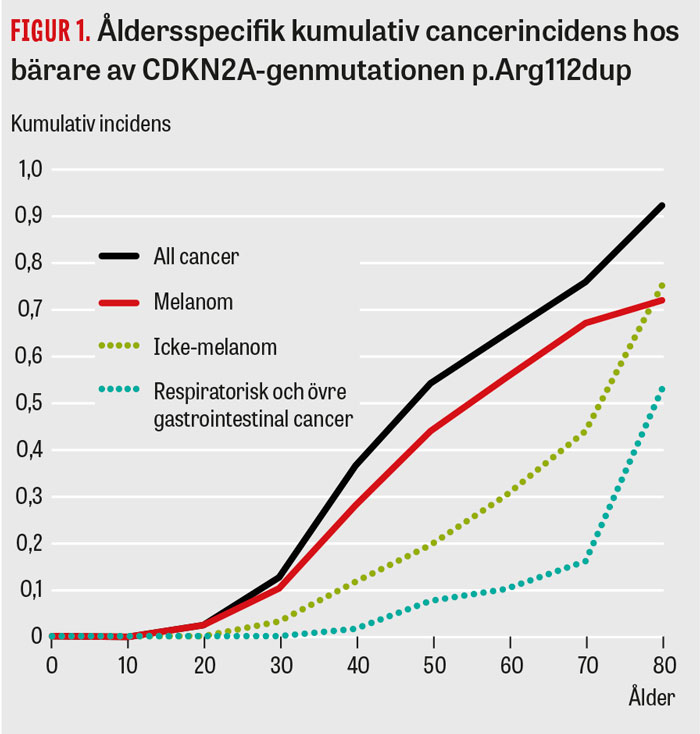
CDKN2A-mutationer har nu identifierats i ett femtiotal svenska släkter spridda över landet. Medianålder för första melanomdiagnos är cirka 40 år, vilket är dryga 20 år tidigare än det som ses i den allmänna svenska befolkningen. Mer än hälften utvecklar dessutom fler än ett primärt hudmelanom. I 80-årsåldern har 95 procent av bärarna drabbats av någon form av cancer: 75 procent har insjuknat i melanom och 75 procent har insjuknat i annan, ofta rökningsassocierad, cancer [12] (Figur 1). I en nyligen publicerad studie visar vi även att melanompatienter som bär på nedärvda CDKN2A-mutationer har signifikant sämre överlevnad i både melanom och annan cancer jämfört med melanompatienter utan CDKN2A-mutation. Denna överrisk var oberoende av kön, ålder, hudmelanomets tjocklek, antal diagnostiserade melanom eller diagnos av annan cancer [13]. Orsaken bakom den försämrade överlevnaden hos melanompatienter med nedärvd CDKN2A-mutation är fortfarande oklar.
Melanomfamiljer utan CDKN2A-mutation
I närmare 80 procent av alla melanomfamiljer är orsaken till anhopning av patienter i familjerna fortfarande okänd. På internationell nivå har det hittills enbart i ett fåtal (icke svenska) hudmelanomfamiljer identifierats mutationer i andra högriskgener kopplade till melanom. Dessa gener är framför allt den cellcykelreglerande genen CDK4 och de telomerassocierade generna TERT, POT1, ACD och TERF2IP [14]. I familjer med mutationer i andra kända tumörsuppressorgener som BRCA2, RB1, TP53 och PTEN kan det även förekomma ökade risker för melanom, men dessa cancersyndrom domineras av andra tumörformer.
I en studie på svenska melanomfamiljer som inte har CDKN2A-mutationer var medianålder för första melanomdiagnos cirka 50 år, det vill säga dryga 10 år tidigare än melanominsjuknande i normalbefolkningen, men cirka 10 år senare än hos patienter i familjer med CDKN2A-mutation. Ökad risk för melanom och skivepitelcancer i huden sågs, men inte ökad risk för annan cancer [15]. Mutationer i kända tumörsuppressorgener är oftast associerade med ökade risker för flera olika tumörtyper. Därför är det troligt att många av dessa familjer inte bär på mutationer i högriskgener. Skivepitelcancer i huden är liksom melanom associerad med ultraviolett strålning och vanligast hos ljusa eller rödlätta individer (som har speciella genvarianter kopplade till dessa egenskaper). Det förefaller därför som om det i många av dessa familjer rör sig om en ansamling av vissa varianter i gener som styr pigmentering, eventuellt i kombination med likheter i solexponeringsmönster inom familjerna, som ger ökade risker för melanom och annan hudcancer. I familjer med tidig insjuknandeålder, många individer med melanom och multipla cancerformer är det högre sannolikhet att en mutation i en högriskgen identifieras.
Genom storskaliga associationsstudier har ett flertal genvarianter (SNP) associerats med en viss riskökning för melanom. Då denna riskökning för melanom är betydligt mindre (1,2–5 ggr) än den som ses för till exempel CDKN2A (>60 ggr) kallas dessa gener för lågriskgener. Av dessa lågriskgener är pigmenteringsgenen MC1R mest väldokumenterad. Ett flertal andra melanomassocierade lågriskgener har rapporterats, inklusive ASIP, IRF4, TYR, TYRP1 och OCA [16-18]. Varianter i dessa gener är associerade med hud-, hår- och ögonfärg, fräknar och nevus. Vissa av dessa gener är även kopplade till ökade risker för skivepitelcancer och basalcellscancer i huden, men ingen koppling har visats för icke-hudcancer. I nuläget har totalt sett 20 kromosomala regioner visat signifikant association till ökad melanomkänslighet [19]. Fem av dessa regioner är associerade med pigmentering, fyra med telomerunderhåll och tre med nevus.
Ögonmelanomfamiljer
Ögonmelanom (uveala melanom) är sällsynta, men även bland dessa förekommer familjär anhopning av patienter. I Sverige och även i andra länder har det påvisats mutationer i genen BAP1 (BRCA1 associated protein 1) i vissa ögonmelanomfamiljer [20]. Nedärvda mutationer i BAP1 har även korrelerats till andra tumörtyper, huvudsakligen hudmelanom, mesoteliom, njurcancer, basaliom samt en karakteristisk typ av hudfärgade upphöjda nevus benämnda Wiesner-nevus eller BAPom [21]. BAP1-proteinet har en mångfacetterad roll, inklusive reglering av transkriptionsfaktorer, kromatinmodifiering och DNA-reparation. I ögonmelanom är förvärvade mutationer i BAP1-genen starkt kopplade till en sämre prognos i sjukdomen. BAP1 är fortfarande den enda kända genen som är kopplad till ärftligt ögonmelanom [22].
Identifikation, genetisk testning och uppföljning
I de nationella riktlinjerna för familjärt melanom finns rekommendationer för uppföljning av melanomfamiljer i Sverige [7]. Nya familjer identifieras oftast vid uppföljningsbesök efter melanomdiagnos då patienter tillfrågas om det finns biologiska släktingar med melanom eller annan cancer. Om familjen ser ut att falla under definitionen för familjärt melanom erbjuds en familjeutredning. Det finns regionala skillnader avseende vilka specialiteter eller kliniker som ansvarar för utredning, genetisk testning, uppföljning och screening av melanomfamiljer, men inom alla sjukhusregioner finns det enheter med denna inriktning där kontaktuppgifter för dessa finns angivna i riktlinjerna [7]. Diagnoser av melanom och annan cancer ska i regel fastställas med patologisvar. Om familjärt melanom bekräftas upprättas släktträd (pedigree) och information ges om möjligheten till genetisk testning.
Individer som diagnostiserats med melanom eller bukspottkörtelcancer inom definierade melanomfamiljer erbjuds CDKN2A-mutationsanalys. Om CDKN2A-mutation identifierats hos en familjemedlem erbjuds dennes förstagradssläktingar mutationstestning, och på så sätt kan mutationen spåras inom en familj. Då cancer hos barn och ungdomar är ovanligt även i de CDKN2A-muterade familjerna rekommenderas denna mutationsanalys först från 18 års ålder då individen är myndig och själv kan ta beslut om och förstå innebörden av en mutationstestning. CDKN2A-mutationsanalys betraktas i dag som ett kliniskt prov med betydelse för vissa delar av det kliniska handläggandet. Resultatet av mutationstestningen dokumenteras i patientjournalen på den enhet där individen följs för sin melanomärftlighet.
Det rekommenderas att de som tillhör melanomfamiljer från 18 års ålder följs upp med regelbundna, åtminstone årliga dermatologiska kontroller. Vid varje besök ges återkommande information om vikten av hudcancerprevention och egenkontroller av huden och att de likaledes skyddar sina barn. Det finns regionala skillnader gällande vilka kliniker som sköter uppföljning av familjer med CDKN2A-mutationer, men de behöver följas från en instans där specialkompetens finns om genetisk vägledning och om dessa individers särskilda riskprofil med ökade risker för melanom och tumörer i bukspottkörtel, munhåla, strupe, svalg, matstrupe och lungor. Individer med nedärvda CDKN2A-mutationer ska tidigt informeras om särskilt ökade cancerrisker kopplade till tobaksrökning och betydelsen av avhållsamhet samt erbjudas hjälp för att uppnå rökfrihet. Från 40 års ålder rekommenderas MR-screening för bukspottkörtelcancer [23]. Vid misstänkta symtom från luftvägar eller övre matsmältningsorganen ska låg tröskel föreligga för endoskopiska undersökningar. Hos bärare som rökt i många år ska likaledes tröskeln vara låg för att utföra lungröntgen eller lågdos-DT av torax. Individer med BAP1-mutationer följs med regelbundna ögon- och hudundersökningar.
Fortfarande är det mycket som är okänt om orsaker till familjärt melanom och hur det går för individer tillhörande melanomfamiljer. SweFAM bedriver i samarbete med Karolinska institutet forskning på genetiska orsaker till melanomanhopning i familjer där blodprov från identifierade melanomfamiljer tas emot från hela landet [7]. Forskning som denna kommer förhoppningsvis att kunna identifiera tidigare okända högriskgener kopplade till familjärt melanom samt kartlägga mer komplexa orsakssamband där flera olika lågriskgener är involverade.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Definition av familjärt melanom:
1. Familj med melanom (invasiva eller in situ) hos minst två förstagradssläktingar1 där minst en diagnostiserats före 55 års ålder.
2. Familj eller individ med tre eller fler melanom (invasiva eller in situ) i samma släktgren. Patienterna ska vara första-, andra2– eller tredjegradssläktingar3.
3. Familj eller individ med melanom (invasiva eller in situ) i kombination med bukspottkörtelcancer (adenokarcinom) (tre eller fler diagnoser krävs) i samma släktgren. Patienterna ska vara första-, andra- eller tredjegradssläktingar.
1Förstagradssläktingar: Biologiska föräldrar, syskon eller barn till indexpersonen.
2Andragradssläktingar: Biologiska mor/farföräldrar, föräldrars syskon, syskonbarn och barnbarn till indexpersonen.
3Tredjegradssläktingar: Biologiska kusiner, mor/farföräldrars föräldrar, mor och farföräldrars syskon samt barnbarns barn.