Två huvudgrupper av behandlingar har etablerats vid avancerat malignt melanom de senaste åren.
Den ena huvudgruppen är så kallade T-cellsaktiverande antikroppar (immune checkpoint inhibitors), vilka är antikroppar som ges intravenöst, binder till T-lymfocyter och aktiverar immunsystemet.
Behandling med T-cellsaktiverande antikroppar kan medföra immunrelaterade biverkningar som kan behöva behandlas med kortison.
Den andra nya huvudgruppen av läkemedel administreras per os, går in i cancercellerna och hämmar en signalväg.
De nya terapierna har medfört att prognosen förbättrats avsevärt och att vissa patienter möjligen kan bli botade.
Det finns goda skäl att tro att behandlingen vid malignt melanom kommer att bli ännu bättre de närmaste åren.
Fram till för några år sedan fanns inga behandlingar som förbättrade överlevnaden för patienter med spridd melanomsjukdom. De senaste åren har flera nya behandlingar mot metastaserande malignt melanom etablerats. Det rör sig i stora drag om två huvudgrupper av läkemedel, så kallade T-cellsaktiverande antikroppar (immune checkpoint inhibitors) som aktiverar immunsystemet, och hämmare av en signalväg som ofta är överaktiverad i melanom (MAPK-signalvägen). Dessa nya terapier har medfört att prognosen förbättrats avsevärt och att vissa patienter möjligen kan bli botade.
T-cellsaktiverande antikroppar
CTLA-4-hämmare
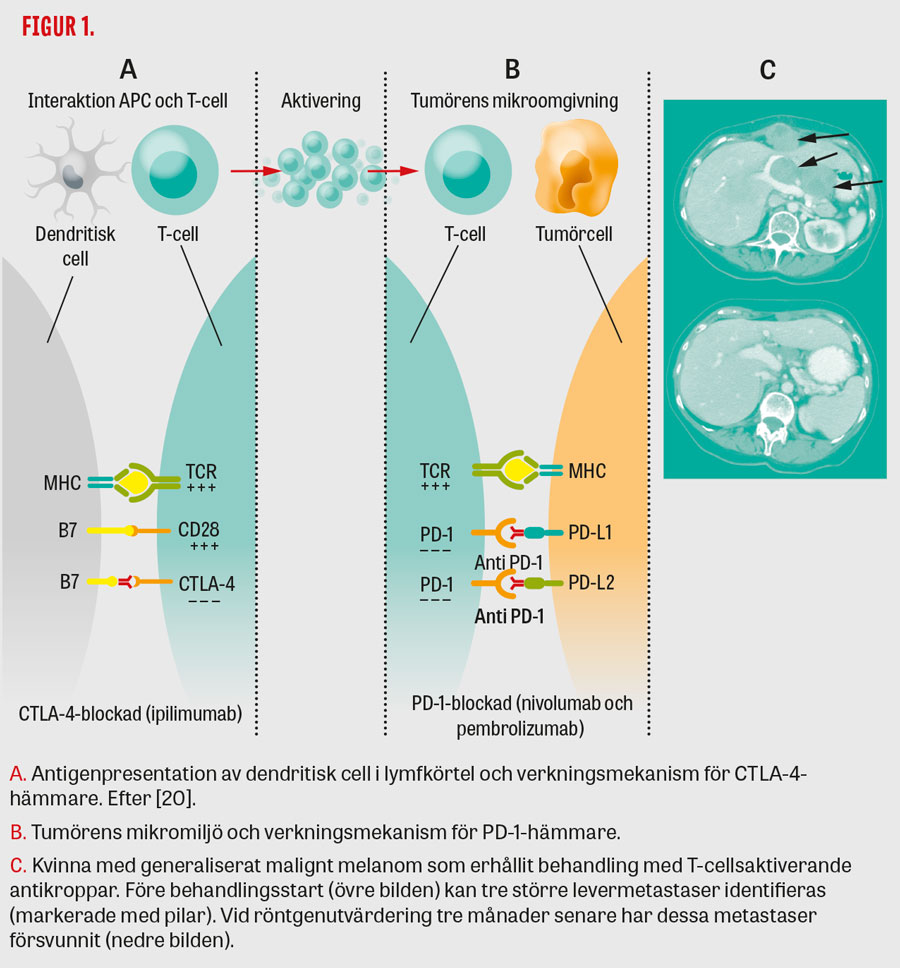
Den första livsförlängande medicinen vid malignt melanom, ipilimumab (Yervoy), en antikropp mot CTLA-4 (cytotoxiskt lymfocytantigen), blev rutinbehandling för svenska patienter med avancerat malignt melanom 2012. CTLA-4 uttrycks på T-celler och förmedlar inhibitoriska signaler. Behandling med ipilimumab medför en blockering av dessa signaler, vilket aktiverar immunsystemet så att det bekämpar cancern (Figur 1A). Behandlingsschemat är en infusion var tredje vecka, totalt fyra behandlingar. De patienter som fick ipilimumab i den registreringsgrundande studien vann i genomsnitt 3,5 månader i överlevnad. Tvåårsöverlevnad uppnåddes för en fjärdedel av de patienter som behandlades med antikroppen medan andelen behandlingssvar (objektiv respons, det vill säga tydligt minskad tumörbörda) bara var 10 procent [1]. Vidare observerades en ökad långtidsöverlevnad med en platå i överlevnadskurvan på ungefär 20 procent [2, 3]. Verkningsmekanismen för ipilimumab innebär att behandlingsnyttan för en del patienter inte blir uppenbar förrän flera veckor eller till och med månader efter behandlingen och att en positiv effekt inte nödvändigtvis behöver medföra att metastaserna minskar i storlek.
Då behandling med ipilimumab medför fler biverkningar än med de nyligen introducerade PD-1-hämmarna, samtidigt som PD-1-hämmarna är effektivare än ipilimumab, är dessa att föredra. Dock kan ipilimumab-behandling övervägas i kombination med nivolumab (se nedan).
PD-1-hämmare
PD-1 är en förkortning av programmerad dödsreceptor 1, och aktivering leder liksom för CTLA-4 till att immunsvaret hämmas. Därmed verkar PD-1-hämmarna, liksom ipilimumab, genom att stimulera immunsystemet men skiljer sig från ipilimumab då effekten utövas perifert i tumörvävnad (Figur 1B). Dessa anti-PD-1-antikroppar, som likt ipilimumab ges intravenöst, verkar snabbare och medför bättre behandlingssvar och överlevnad än ipilimumab (Figur 1C). Två antikroppar: nivolumab (Opdivo) (ges varannan vecka) och pembrolizumab (Keytruda) (ges var tredje vecka), som hämmar PD-1 är registrerade och behandlingen är etablerad i Sverige vid avancerat malignt melanom sedan september 2015. Under förutsättning att biverkningarna är tolerabla ges PD-1-hämmarna (till skillnad från ipilimumab) till dess att det konstateras att behandlingen inte gör nytta. Det är möjligt att det är bäst att sluta behandla patienter som fått ett behandlingssvar som står sig, vilket undersöks i studier. På många håll i Sverige tillämpas avslut efter 2 års behandling vid stabil sjukdom, vilket också är angivet i det nationella införandeprotokollet för PD-1-hämmare och använt i hälsoekonomiska beräkningar av Tandvårds- och läkemedelsförmånsverket (TLV). Nivolumab och pembrolizumab har likvärdiga effekter och biverkningar (se nedan).
I en fas III–studie (CheckMate 066) randomiserades patienterna som inte fått behandling tidigare (första linjen) till behandling med nivolumab eller dakarbazin. För den antikroppsbehandlade gruppen var behandlingen verksam i median 5,1 månader, 40 procent svarade på behandlingen (varav 8 procent kompletta svar) och 1-årsöverlevnaden uppmättes till 73 procent, vilket var signifikant bättre än för dem som fick dakarbazin [4]. I en annan fas III-studie (Checkmate 037) lottades patienter som fått etablerad terapi (andra linjen) till behandling med nivolumab eller kemoterapi (dakarbazin eller paklitaxel + karboplatin). Även i denna studie var behandlingseffekten signifikant bättre för den antikroppsbehandlade gruppen, i vilken 32 procent svarade (varav 3 procent kompletta svar) [5].
I en trearmad fas III-studie (Keynote 006) jämfördes behandling med pembrolizumab med ipilimumab varannan respektive var tredje vecka. Tidigare behandling med ipilimumab var ett exklusionskriterium, och vid dosering av pembrolizumab var tredje vecka svarade 33 procent (varav 6 procent kompletta svar) och 55 procent levde vid 2 år, vilket var signifikant bättre resultat än med ipilimumab [6].
Studierna visade att behandlingen fungerar väl i såväl första som andra linjen, och då även efter att ipilimumab-behandling inte längre är verksam. Förhoppningen att liganden för PD-1, PD-L1, som ibland uttrycks i tumörerna, skulle kunna fungera som en prediktiv faktor för behandlingseffekt har emellertid inte infriats vid malignt melanom.
Kombination av CTLA-4- och PD-1-hämmare
Genom att CTLA-4- och PD-1-hämmare stimulerar immunsystemet på olika sätt finns förutsättningar för kombinationsterapi. En randomiserad fas III-studie (CheckMate 067) har undersökt kombinationen ipilimumab och nivolumab jämfört med singelbehandling med antingen ipilimumab eller nivolumab. Patienterna i kombinationsarmen hade nytta av behandlingen i 11,5 månader i median (mot 2,9 månader i ipilimumab-gruppen och 6,9 månader i nivolumab-gruppen) [7]. Enligt nationell bedömning i april 2017 rekommenderas kombinationsbehandling med ipilimumab och nivolumab till patienter med gott allmäntillstånd som har uttryck av PD-L1 <1 procent i tumörcellerna [8].
Biverkningar och falsk progress
Administration av ipilimumab och/eller PD-1-hämmare ger sällan upphov till svåra infusionsrelaterade reaktioner, men kan ibland leda till uttalade immunrelaterade biverkningar som till exempel hudreaktioner, kolit, hypofysit, tyreoidit, binjureinsufficiens och hepatit. Biverkningarna är som påpekats mer uttalade vid ipilimumab-behandling än vid PD-1-hämmarterapi, och kombinationsbehandlingen är särskilt toxisk. Det är viktigt att dessa biverkningar upptäcks och behandlas tidigt och vid behov multidisciplinärt. Noggrann uppföljning av patienter via kontaktsjuksköterska rekommenderas. Biverkningsrisken innebär att endast kliniker som har erfarenhet av denna typ av behandling bör använda ipilimumab/PD-1-hämmare. Om en patient visar tecken på biverkningar är det viktigt att behandlande läkare snabbt tar ställning till behov av insättning av högdossteroidbehandling och eventuellt TNFα-hämmaren infliximab enligt utarbetad behandlingsalgoritm för immunrelaterade biverkningar som exempelvis återfinns i Fass. Det är också av vikt att steroidbehandlingen fullföljs med långsam nedtrappning eftersom snabb dosminskning kan leda till att de svåra biverkningarna återkommer. Det finns ingen evidens för att behandling med höga doser steroider vid immunrelaterade biverkningar försämrar terapieffekten.
Om storleksökning av befintliga eller tillkomst av nya metastaser noteras efter behandling behöver inte behandlingssvikt föreligga utan fynden kan bero på ett immunsvar (falsk progress/pseudoprogress). Därför bör immunrelaterade responskriterier användas i bedömningen av behandlingens effektivitet [9]. Om tumörbördan är oförändrad eller tilltagit ytterligare en månad senare anses äkta progress föreligga. Ibland är det svårt att avgöra om patienten har nytta av behandlingen eller ej. Då kan det vara värdefullt att bedöma hur symtom som trötthet och smärta utvecklar sig. Behandling med T-cellsaktiverande antikroppar bör endast ges till patienter i gott allmäntillstånd (WHO grad 0–I) som inte står på immunsuppressiv behandling (möjligen kan en låg dos kortison tillåtas).
Behandling med kinashämmare
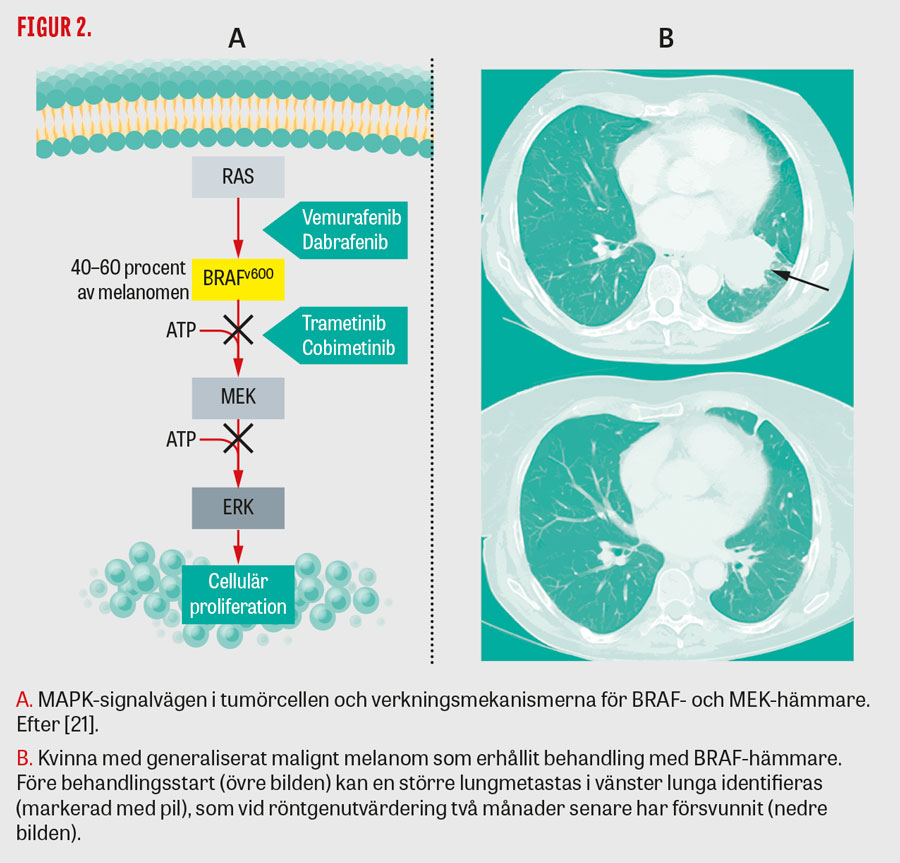
Uppemot hälften av alla hudmelanom uppvisar aktiverande BRAF-mutation i kodon 600, och denna är avgörande för att behandling med BRAF- och/eller MEK-hämmare ska kunna göra nytta (Figur 2A). Hos yngre patienter är mutationen vanligare än hos äldre. Analysen kan utföras på det primära melanomet även om det gått många år från kirurgi till konstaterad spridd sjukdom då BRAF-status brukar vara oförändrad under sjukdomsförloppet. BRAF-mutationer i akrala lentiginösa och slemhinnemelanom är ovanliga, och den i särklass vanligaste formen av ögonmelanom, uvealt melanom, är inte muterad (se artikel om ögon- och slemhinnemelanom).
Singelbehandling med BRAF- eller MEK-hämmare
Monoterapi har bättre effekt med BRAF- än med MEK-hämmare. De perorala BRAF-hämmarna vemurafenib (Zelboraf) och dabrafenib (Tafinlar) etablerades 2013 respektive 2014 som behandling för patienter vars melanom är BRAF-muterade. Behandlingsschemat innebär kontinuerligt peroralt tablettintag morgon och kväll. Behandlingen medför svar i hälften av fallen, och behandlingsnyttan uppgår till 1/2 år [10, 11]. Behandlingssvaret kan komma så snabbt som på några dagar, och de goda behandlingsresultaten innefattar även hjärnmetastaser. När sjukdomen så småningom blir resistent kan sjukdomsprogressen gå mycket snabbt. För vemurafenib är UVA-känslighet, med stor risk för solbrändhet, en mycket vanlig biverkan och för dabrafenib feber (pyrexi). Vidare är högt differentierad skivepitelcancer en vanligare biverkan för vemurafenib än för dabrafenib. Ett exempel på behandlingssvar återfinns i Figur 2B.
Kombination av BRAF- och MEK-hämmare
I fas III-studierna COMBI-v och COMBI-d hade patienterna signifikant längre nytta med kombinationen BRAF- (dabrafenib) och MEK-hämmare (trametinib, Mekinist) jämfört med monoterapi med antingen vemurafenib eller dabrafenib, och en mediantid utan behandlingssvikt (progressionsfri överlevnad) på drygt 11 månader uppnåddes. Behandlingssvaren uppgick till 2/3 och överlevnaden var i genomsnitt 2 år med kombinationsbehandlingen, samtidigt som vissa biverkningar var mindre uttalade i kombinationsgruppen, framför allt frekvensen av skivepiteltumörer i huden [12, 13]. En annan regim med BRAF- + MEK-hämmare som utvärderats i en fas III-studie är vemurafenib + cobimetinib (Cotellic) [14].
Sedan juni 2016 har kombinationsbehandling ersatt singelbehandling med BRAF-hämmare som förstahandsval.
Hälsoekonomiska aspekter på nya behandlingar
Hälsoekonomisk utvärdering av TLV är genomförd för de nya läkemedlen mot malignt melanom som monoterapi och kombinationsbehandling. Dessa analyser är och har varit komplexa till exempel på grund av olika metodval för analys som respektive företag tillhandahållit. En bedömning har utförts vid ansökan om subvention, alternativt för immunterapiläkemedlen inom TLV:s klinikläkemedelsuppdrag. Med hänsyn till komplexiteten har osäkerheten i de hälsoekonomiska resultaten bedömts som mycket hög.
För att minska osäkerheten har därför särskilda överenskommelser mellan företagen och landstingen träffats i många fall. För behandling med BRAF- + MEK-hämmare har detta inneburit att kostnaden per kvalitetsjusterat levnadsår (QALY) uppskattningsvis reduceras till 760 000–960 000 kr exklusive indirekta kostnader. TLV presenterade en analys 2015, då PD-1 hämmarna introducerades i Sverige inom ramen för nationellt ordnat införande. Då konstaterades att det utifrån kostnad per vunnet QALY i de två kunskapsunderlagen inte går att dra slutsatser om vilken av de båda produkterna som är mest kostnadseffektiv. Både nivolumab och pembrolizumab har dock bedömts som mer kostnadseffektiva än ipilimumab.
Cytostatikabehandling
Triazenderivatet dakarbazin utgjorde under många år hörnstenen vid cytostatikabehandling av avancerat malignt melanom. Då dakarbazin används (vanligen var tredje vecka) som enda medel erhålls behandlingssvar hos cirka 10 procent av patienterna och ingen förlängd överlevnad uppnås. En nyare analog till dakarbazin är temozolomid (Temodal), som skiljer sig från dakarbazin genom att den inte behöver aktiveras metabolt i levern och dessutom har fördelen att kunna administreras peroralt. Vidare har preparatet en god förmåga att penetrera blod–hjärnbarriären. En randomiserad fas III-studie av metastaserande maligna melanom har visat likvärdig effekt på överlevnaden för dakarbazin och temozolomid. Behandlingsnyttan var dock något längre för den grupp som fått behandling med temozolomid [15]. Dessutom uppmättes bättre livskvalitet för dessa patienter [16]. Temozolomid används i klinisk praxis till patienter för vilka PD-1-hämmare eller BRAF- och MEK-hämmare inte är ett alternativ.
Regional hyperterm perfusionsbehandling med cytostatika kan ges vid Sahlgrenska universitetssjukhuset, Göteborg och bör övervägas till patienter som har avancerad utbredning av malignt melanom i en extremitet.
Immunstimulerande genterapi
I en fas III-studie av malignt melanom sågs en signifikant bättre sjukdomskontroll vid 6 månader för patienter som fick intratumorala injektioner med det onkolytiska viruset talimogen laherparepvec (T-VEC, Imlygic) jämfört med den grupp som fick subkutana injektioner med cytokinen GM-CSF [17]. T-VEC är ett försvagat herpes simplex-virus som kodar för genen för GM-CSF. GM-CSF i sin tur kan förbättra antigenpresentationen så att ett immunsvar mot cancern utvecklas. Influensaliknande symtom är vanliga biverkningar.
Den första behandlingen ska ges i mycket lägre dos än efterföljande som ges varannan vecka.Behandlingen är registrerad för patienter med avancerad stadium III-sjukdom (spridning till lymfkörtlar i närheten) samt melanom stadium IV utan spridning till inre organ. T-VEC har inte varit föremål för nationell hälsoekonomisk bedömning, och det är oklart i hur stor utsträckning detta läkemedel kommer att användas.
Framtiden
Till framtida möjliga immunologiska behandlingar hör vacciner, konjugerade antikroppar, virusbaserade behandlingar och T-celler.
Adjuvant behandling, det vill säga tilläggsbehandling efter radikal kirurgi, är inte etablerad vid malignt melanom. Huruvida adjuvant behandling med de nya preparaten är av värde för patienter med regionala lymfkörtelmetastaser (stadium III), vilka har hög risk för recidiv, undersöks i flera studier. Bland annat studeras värdet av ipilimumab i olika doser, och jämförelser görs mot interferon-α [18]. En av dessa studier har visat att behandling med ipilimumab i hög dos under tre år signifikant minskar antalet återfall för patienter som opererats för malignt melanom i stadium III. Vidare var överlevnaden 11 procent bättre vid 5 år (65 procent versus 54 procent), och även denna skillnad var signifikant [19]. Behandlingen har ännu ej godkänts av den europeiska läkemedelsmyndigheten EMA, och då toxiciteten är påtaglig är det oklart i vilken utsträckning den kommer att användas. Huruvida nivolumab och pembrolizumab är effektiva läkemedel som tilläggsbehandling efter att patienten opererats för sitt maligna melanom i stadium III studeras också.
Vidare undersöks i en potentiellt registreringsgrundande studie om behandling med vemurafenib kan förhindra återfall, medan en annan studie kommer att ge svar på frågan om dabrafenib + trametinib förbättrar prognosen i den adjuvanta situationen. I bägge dessa studier med perorala hämmare ges behandling under ett år.
Forskning pågår också för att definiera prediktiva biomarkörer för vilka patienter som bör behandlas med PD-1-hämmare. Vidare undersöks i studier om PD-L1-hämmare är bättre än PD-1-hämmare och om det är en vinnande strategi att kombinera BRAF- + MEK-hämmarbehandling med PD-1- eller PD-L1-hämmare. Att kombinera immunterapi med specifik effekt (till exempel potentiella cancervacciner) med T-cellsaktiverande antikroppars allmänt immunaktiverande effekt är ett annat utvecklingsspår. I Uppsala och Stockholm pågår kliniska prövningar av individualiserad immunterapi, däribland studier i vilka patienterna får metastasinjektioner med det potentiella läkemedlet och som bygger på expansion av stimulerade autologa T-celler (TIL-celler – tumörinfiltrerande lymfocyter) som sedan återförs till patienter med malignt melanom tillsammans med immunstimulerande substanser. De kommande åren har förutsättningar att bli lika spännande som de närmast föregående.
Potentiella bindningar eller jävsförhållanden: Gustav Ullenhag: utbildningsinsatser för Amgen, MSD och Bristol-Myers Squibb, möten med Bristol-Myers Squibb och MSD, kongressrapport för Roche. Huvudprövarskap för studier med läkemedel från Bristol-Myers Squibb, MSD, Roche, GSK och Novartis.
Johan Hansson: deltagit i utbildningar organiserade av Bristol-Myers Squibb, Novartis och Roche, deltagit i rådgivande kommitté för Bristol-Myers Squibb, MSD, Novartis och Roche. Huvudprövarskap för studier med läkemedel från AstraZeneca, ArrayPharma, Bristol-Myers Squibb, MSD, Roche, GSK och Novartis.
Lars Ny: huvudprövarskap för studier med läkemedel från ArrayPharma, Bristol-Myers Squibb, MSD, Novartis och Roche. Deltagit i utbildningar organiserade av Bristol-Myers Squibb. Deltagit i rådgivande kommitté för Novartis.