Allt fler hjärtfel diagnostiseras i dag före födelsen. Detektionsgraden är högst för hjärtfel med endast en kammare som inte kan korrigeras till en normal cirkulation med två kammare. Föräldrarna väljer då ofta att avbryta graviditeten.
Vid prenatal detektion av hjärtfel kan de olika hemodynamiska problem som uppstår efter födelsen minimeras och prognosen förbättras.
De flesta fosterarytmier kan diagnostiseras med samma säkerhet som efter födelsen. Behandlingen är i första hand intrauterin. Prematur förlossning bör undvikas.
Hjärtfunktionsbedömning är av stor betydelse vid fostermedicinsk handläggning av hemodynamiskt belastande extrakardiella missbildningar.
Modern ultraljudsteknologi har inte bara revolutionerat den barnkardiologiska diagnostiken utan också gjort det möjligt att under fosterlivet erbjuda i stort sett samma strukturella och funktionella hjärtdiagnostik som efter födelsen. I avsaknad av enkla och bra metoder att registrera elektriska signaler från fostrets hjärta har utvecklingen av fosterekokardiografiska metoder också gjort det möjligt att diagnostisera olika typer av arytmi och deras hemodynamiska konsekvenser. Samma ultraljudsmetodologi som används inom barnkardiologin för funktionell hjärtbedömning kan i stort sett också användas på foster. Denna typ av undersökningar behövs inte bara vid primärt kardiologiska problem, utan har också i allt större omfattning kommit till nytta vid handläggning av foster med kärlrika tumörer, arteriovenösa fistlar och tvillingtransfusionssyndrom.
Avsikten med denna presentation är att ge en kort beskrivning av var fosterkardiologin befinner sig i dag, med utgångspunkt från vår verksamhet på Astrid Lindgrens barnsjukhus och vårt mycket nära samarbete med den fostermedicinska verksamheten på Karolinska sjukhuset i Stockholm. För den som önskar mer information rekommenderas en relativt nyligen publicerad rapport från American Heart Association som ger en utförligare beskrivning och ett stort antal referenser [1].
Olika typer av medfödda hjärtfel
Vi har tidigare beskrivit hur införande av hjärtdiagnostik i det obstetriska rutinultraljudet i Stockholmsregionen resulterat i att andelen prenatalt upptäckta hjärtfel av dem som bedöms kräva operation eller kateterintervention före 1 års ålder ökat från 10 procent före 1998 till 40 procent under 2004 [2]. Följande beskrivning baseras också på situationen i Stockholm, och även om det i dag finns stora skillnader i detektionsgrad över landet kan man förvänta sig att dessa gradvis kommer minska. Detektionsgraden har fortsatt öka, och våra preliminära data visar att vi från 2013 upptäckt fler än 60 procent av alla hjärtfel (enligt ovanstående definition) före födseln. Under senare år har andelen par som väljer att avbryta graviditeten tenderat att minska och ligger nu kring 50 procent (25–30 fall per år). Till stor del förklaras detta av att det i dag upptäcks en större proportion enklare hjärtfel med bättre prognos.
Hjärtfel med en kammare är lätta att upptäcka, kan inte korrigeras till en normal tvåkammarcirkulation efter födelsen och leder ofta till att graviditeten avbryts. Hypoplastiskt vänsterkammarsyndrom är mer problematiskt än de enkammarhjärtan som inte behöver en operativ korrektion av aortabågen direkt efter födelse. Redan för mer än 10 år sedan upptäcktes mer än 80 procent av alla foster med hypoplastiskt vänsterkammarsyndrom och 75 procent av dem med andra typer av enkammarhjärtan. Dessa siffror har i dag ökat till 95 procent samtidigt som andelen inducerade aborter under många års tid har legat mer stabilt kring 80 procent för hypoplastiskt vänsterkammarsyndrom och 60 procent för andra typer av enkammarhjärtan.
Vid atrioventrikulär septumdefekt har hjärtat en gemensam klaff mellan förmak och kammare men oftast två väl utvecklade kammare, varför detta hjärtfel är svårare att upptäcka. Under senare år har detektionsgraden dock legat på drygt 65 procent, och två tredjedelar valde att avbryta graviditeten. I samtliga fall där abort inducerades hade fostret Downs syndrom, som är starkt associerat med detta hjärtfel. En mer komplicerad atrioventrikulär defekt illusteras i Figur 1.
För hjärtfel med avvikelser i de avgående artärerna och två väl fungerande kammare har detektionsgraden ökat mer gradvis och ligger nu mellan 50 och 60 procent. Även om hjärtat har två kammare är det inte säkert att hjärtfelet kan korrigeras kirurgiskt till en normal cirkulation efter födelsen. Lägesrelationer mellan avgående artärer och strukturer i hjärtats kammare liksom deras respektive dimensioner kan vara helt avgörande för hur ett hjärtfel kan opereras och hur slutresultatet blir. Klaffar, kammare och artärer som redan i vecka 18–20 är små brukar avvika ännu mer från det normala i fullgången tid, och det kan vara extremt svårt att förutse hur användbara dessa strukturer kommer att bli då hjärtfelet ska korrigeras efter födelsen. En väl fungerande tvåkammarcirkulation kräver också ett sammanhängande, väl utvecklat lungkärlsträd, vilket kan vara svårt att bedöma framför allt hos de foster som saknar fungerande avflöde från kammare till lungartär. Flera av dessa hjärtfel är också associerade med extrakardiella avvikelser, kromosom- och gendefekter, vilket inte helt sällan har större betydelse för långtidsförloppet efter födelsen än hjärtfelet [3]. Vår erfarenhet är att knappt 25 procent av dessa graviditeter avslutas med en inducerad abort. Som regel har det varit foster med extrakardiell problematik och/eller hjärtfel där tvåkammarkorrektion bedömts osannolik.
Att diagnostisera en aortakoarktation är ofta inte möjligt förrän efter födelsen då ductus arteriosus stängts. Diagnosen misstänks fetalt då det finns en storleksskillnad mellan hjärtats kammare och de avgående artärerna som är mer uttalad än normalt. Även under normala förhållanden är höger kammare och lungartären något större än motsvarande vänstersidiga strukturer, framför allt under den tredje trimestern, varför antalet falskt positiva diagnoser blir högt. Priset av ett par dagars onödig sjukhusvård av de nyfödda där diagnosen inte kan konfirmeras uppvägs dock flerfaldigt av att de som verkligen har en koarktation upptäcks innan hjärtfelet blir symtomgivande. I Stockholmregionen upptäckts i dag knappt 20 procent av de barn som har koarktation som huvuddiagnos före födseln. Vi saknar egna siffror om antalet falskt positiva diagnoser, som internationellt ligger kring 55 procent och kanske kommer att minskas något genom att man kombinerar dimensionsmått och vinklar mellan olika kärlstrukturer [4-5].
Med allt högre kompetens hos dem som utför det obstetriska rutinultraljudet diagnostiseras också andra avvikelser av något mindre klinisk betydelse. Ett exempel är kärlringar där aortabågen och lungartärbågen/ductus arteriosus passerar på var sin sida om luft- och matstrupen. Det stora flertalet barn med kärlring förblir besvärsfria, men ungefär en fjärdedel får andnings- och/eller sväljningsbesvär, och hos de 15–20 procent som behöver opereras leder den prenatala diagnosen snabbare till kirurgi och symtomfrihet. Som en följd av prenatal screening har vi också sett flera foster med ett helt normalt hjärta där den intrahepatiska delen av den nedre hålvenen saknats och blodet i stället tagit sig till hjärtat via azygosvenen. Barnkardiologiskt betraktas denna anomali traditionellt som en markör för ett polysplenisyndrom (vänsterisomerism) där de flesta har polyspleni, hjärtfel, två morfologiska vänsterlungor, central lever, någon grad av malroterad tarm och ibland även gallvägsatresi. Våra och andras observationer utmanar nu denna nomenklatur, men innan detta kartlagts bättre bör både hjärta och buk undersökas på nyfödda barn med denna avvikelse i den nedre hålvenen.
Viktigt efter födelsen
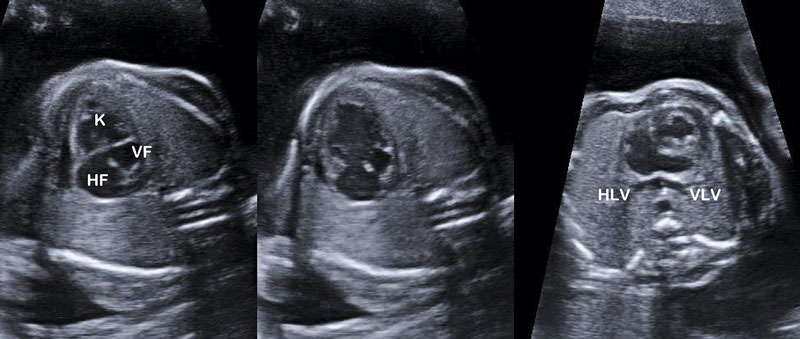
Med reservation för hjärtfel med läckande klaffar tolereras de flesta hjärtfel väl under fosterlivet. Via de fetala shuntarna ductus arteriosus och foramen ovale kan hjärtats kammare hjälpas åt att bibehålla en normal hjärtminutvolym med en pumpande kammare. Efter födelsen blir dock förutsättningarna helt annorlunda i och med den perinatala cirkulationsomställningen, och en viktig del i den fosterkardiologiska diagnostiken är att bedöma hur barnet kommer att påverkas av detta. Ofta behöver ductus arteriosus hållas öppen med prostaglandin före ett eventuellt kateteringrepp eller kirurgisk behandling [6]. I de ovanliga fall där lungvenerna mynnar i portacirkulationen behövs i stället en öppen ductus venosus så att blodet kan passera vidare till den nedre hålvenen och hjärtat (Figur 1). Denna förbindelse, som i fosterlivet förmedlar syrerikt blod direkt från porta och den intrahepatiska delen av navelsträngsvenen, stängs normalt inom 1–2 veckor efter födelsen.
Om ductus venosus inte anläggs på ett normalt sätt och navelsträngsvenen fortfarande mynnar i portacirkulationen tolereras detta oftast väl. I de fall där navelsträngsvenen mynnar direkt i den nedre hålvenen, någon av dess grenar eller i förmaken blir hjärtat volymbelastat och förstorat (Figur 2). Variationsrikedomen vid dessa anomalier är stor och diagnostiken ibland utmanande [7]. Fosterhjärtat tolererar dock volymarbete väl och kan man bara undvika alltför uttalad prematuritet så brukar problemet lösa sig vid avnavling.
Att informera föräldrarna efter en fosterekokardiografisk undersökning är lika viktigt som att kunna ställa en korrekt diagnos. Prognosen kan inte bara baseras på diagnosen i sig utan också på hur säker den är, graviditetslängden och risken att prognosen förändras fram till födelsen, risken för extrakardiella missbildningar och resultat av behandling. Ett aktuellt ämne är information om risken för kognitiva brister och beteendeavvikelser som i ökad omfattning påvisas hos barn och ungdomar med mer komplicerade hjärtfel [8, 9]. Historiskt har dessa symtom kopplats till hjärnskador som uppstått under hjärtkirurgi. Med dagens undersökningsmetoder har man dock visat att drygt en fjärdedel av foster med hjärtfel har mindre strukturella avvikelser i hjärnan redan före födelsen [10]. På gruppnivå är även mindre hjärnvolymer, försenad hjärnmognad och avvikande flödesmönster i hjärnans artärer vanligare hos foster med hjärtfel [10].
Arytmidiagnostik
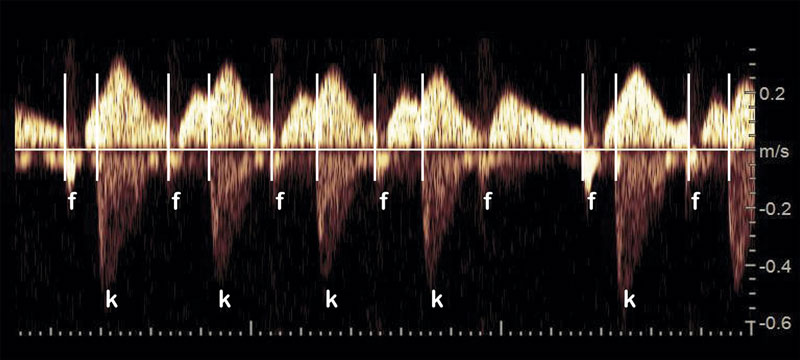
Även om det i dag finns noninvasiva metoder att registrera elektriska signaler från fostrets hjärta är ekokardiografisk ultraljudsdiagnostik fortfarande rutinmetod för att diagnostisera hjärtarytmier hos foster. Med M-mode, alternativt dopplerteknik, identifieras det mekaniska respektive hemodynamiska resultatet av förmaks och kammares elektriska aktivering. Alla större artärer kan utnyttjas för att fastställa rytm och frekvens i kammare, medan förmakskontraktionen ses som en kort period av inbromsat eller reverserat flöde i större systemvener. Oftast kan resultatet från dessa två registeringar ge en korrekt diagnos hos foster med extraslag, men vid mer komplexa arytmier krävs registeringar som direkt visar relationen mellan aktivering av förmak och kammare [11]. Sådana görs helst från ett område där man kan registrera flödet i en ven och en artär samtidigt (Figur 3, 4). Ett tekniskt enklare alternativ, som dock har vissa begränsningar, är att registrera vänster kammares in- och utflöde. Dessa metoder kräver fosterekokardiografisk erfarenhet och grundläggande kunskap om de mekanismer som genererar olika typer av arytmi. Generellt rekommenderas att alla foster med en kvarstående hjärtfrekvens som är lägre än 110 slag per minut, högre än 180 slag per minut eller där mer än var tionde slag är ett extraslag bör utredas [1, 11].
Oregelbunden hjärtrytm orsakas som regel av extraslag som brukar försvinna spontant före eller kort tid efter födelsen. Hjärtat är strukturellt normalt hos 98–99 procent, men i enstaka fall ses ett hjärtfel eller en hjärttumör. Den kanske viktigaste differentialdiagnosen i detta sammanhang är atrioventrikulärt block av andra graden (Mobitz typ I/II) (Figur 3) som skiljer sig från blockerade supraventrikulära extraslag genom att förmaksrytmen är regelbunden [11]. Ibland är extraslagen mer frekventa och förekommer som vartannat (bigemini) eller vart tredje slag (trigemini). Sannolikt rör det sig då om blockerade supraventrikulära slag som inte primärt genererats i förmaket utan återkopplats från kammardelen via en accessorisk bana. Blockerat förmaksbigemini resulterar i en regelbunden kammarrytm med frekvens 70–90 slag per minut som kan vara svår att skilja från i första hand 2:1-atrioventrikulärt block, men ibland också ett komplett hjärtblock. Blockerat förmaksbigemini påverkar inte fostret negativt och upphör oftast spontant. Dessa foster bör dock kontrolleras veckovis så länge arytmin består då det finns en risk på 6–14 procent att de senare under graviditeten utvecklar behandlingskrävande takyarytmi [12].
Vår erfarenhet av ventrikulära extraslag i bigemini är att de upptäcks i graviditetsvecka 32–35 och ofta misstolkas som en regelbunden långsam kammarrytm, med en frekvens motsvarande hälften av förmakets, då de prematura extraslagens volymer blir små och inte detekteras med CTG (Figur 4). Någon hemodynamisk fosterpåverkan uppstår inte, och fosterrörelserna är som regel normala till skillnad från hos ett foster med en persisterande kammarfrekvens på 60–65 slag per minut orsakat av hypoxi. I de flesta fall går arytmin i regress inom ett par veckor.
Knappt hälften av alla foster med komplett hjärtblock har ett komplicerat hjärtfel, och de utan associerat hjärtfel orsakas praktiskt taget alltid av transplacentärt överförda maternella autoantikroppar (anti-SSA/Ro52). Sådana antikroppar påvisas företrädesvis hos kvinnor med reumatisk sjukdom och medför enligt vår egen erfarenhet en risk på 3–4 procent att deras foster utvecklar hjärtblock [13, 14]. Blocket utvecklas som regel under graviditetsvecka 18–24, ibland på kortare tid än en vecka, men förloppet kan vändas om transplacentär behandling med steroider (betametason, dexametason) påbörjas innan blocket blivit komplett [13]. Enligt rekommendationer från American Heart Association kan behandling med steroider och immunglobulin även övervägas vid komplett hjärtblock i avsikt att minska dödlighet och incidens av dilaterad kardiomyopati, även om effekten inte har bevisats [1].
Med en incidens av antikroppsmedierat hjärtblock i Stockholm på 1/23 000 graviditeter är vår erfarenhet av transplacentär behandling begränsad [14]. Vi kan dock konstatera att vi sedan år 2000, med steroidbehandling av andragradsblock och kompletta block med riskfaktorer för intrauterin död [15], haft en peri-/neonatal mortalitet på cirka 5 procent, vilket är betydligt lägre än de drygt 15 procent som rapporteras i ett flertal äldre studier [14]. Det kan vara svårt att diagnostisera ett komplett hjärtblock, och att skilja inkompletta block från blockerade extraslag kräver ofta registeringar av hög kvalitet och god kunskap om de olika arytmiernas mekanism [11, 12]. Det viktigaste med denna diagnos är dock att den inte misstolkas som en hostande asfyxi, då ett gravt underburet barn med kammarfrekvens på 50–75 slag per minut har en mycket hög neonatal mortalitet.
Fetal takyarytmi brukar definieras som en icke sinusutlöst hjärtrytm med frekvens överstigande 180–200 slag per minut. Det händer att CTG visar ungefär hälften av den sanna kammarfrekvensen på 260–290 slag per minut utan variabilitet och därför tolkas som en hotande asfyxi. Supraventrikulär takykardi av atrioventrikulär återkopplingstyp, med en accessorisk bana som snabbt överleder den elektriska impulsen tillbaka från kammare till förmak, diagnostiseras hos drygt 60 procent, förmaksfladder hos knappt 30 procent, och 10 procent har andra mekanismer [16, 17]. Förmaksfladder resulterar alltid i ett funktionellt atrioventrikulärt block, och frekvensen i kammare blir hälften eller en tredjedel av förmaksfrekvensen beroende på grad av blockering. Olika typer av supraventrikulär takykardi har som regel samma frekvens i förmak och kammare. De särskiljs genom att fastställa om tidsintervallet från kammarkontraktion till förmakskontraktion är kortare eller längre än tidsintervallet från förmakskontraktion till efterföljande kammarkontraktion [11].
Vid atrioventrikulär återkopplingstyp är tiden mellan kontraktion av kammare och förmak så kort att förmaket kontraherar medan hjärtats kammare fortfarande är i systole och klaffarna mellan förmak och kammare stängda. Förmakens kontraktion resulterar därför i kraftiga flödesvågor tillbaka ut i system- och navelsträngsvener. Den höga hjärtfrekvensen begränsar också tiden för diastolisk kammarfyllnad, vilket tillsammans med den samtidiga kontraktionen av förmak och kammare leder till höga venösa tryck och hydrops innan kammarmuskulaturen börjar svikta. Vid förmaksfladder ses inga symmetriska kontraktioner i förmaken, de venösa flödena är inte lika påverkade och risken för hydrops mindre. Hydrops, som föreligger hos 25–30 procent vid diagnos, är den enskilt viktigaste prognostiska faktorn. Med transplacentär antiarytmisk behandling kan ett gynnsamt resultat förväntas i praktiskt taget alla fall utan hydrops, men hos dem med hydrops finns en mortalitet på 16–17 procent [16, 17].
Även om American Heart Association nyligen sammanställt rekommendationer [1] så finns det i dag inga allmänt accepterade riktlinjer beträffande indikationer för behandling och optimalt val av antiarytmika. Det optimala målet med fetal arytmibehandling är ett barn med normal hjärtrytm och utan hydrops som föds vaginalt i rätt tid. Transplacentär och direkt fetal behandling med ibland flera antiarytmika medför dock risker för både modern och hennes foster, varför sänkning av hjärtfrekvensen utan att arytmin bryts, undvikande av prematuritet och överlevnad av ett friskt barn och moder kan vara acceptabla alternativ. Med denna inställning har vi sedan början av 1990-talet konverterat drygt 70 procent av dem med hydrops och cirka 85 procent av dem utan hydrops intrauterint till sinusrytm. Det har ofta behövts flera antiarytmika, i enstaka fall direkt fetalt, och i flera fall har det tagit mer än två veckor att bryta arytmin. Handläggningen har också krävt ett nära samarbete mellan fostermedicinare, obstetriker och barnkardiologer.
Bedömning av hjärtfunktion och hemodynamik
Fetal hydrops, vätska i kroppens hålrum och hudödem, har i en fjärdedel av fallen en kardiell orsak (Fakta 1) [18]. Fostret har normalt en stor extracellulär vätskevolym och ett högt lymfflöde som är påtagligt känsligt för tryckökningar i höger förmak. Detta innebär att icke-immun hydrops vanligtvis inte är ett preterminalt tillstånd men ändå ett oroväckande fynd vid fetal hjärtfunktionspåverkan. Vid fetalt diagnostiserad dilaterad kardiomyopati är den neonatala överlevnaden 50 procent hos dem utan hydrops och mindre än 20 procent hos dem med hydrops. Hypertrof kardiomyopati har sämre prognos. Flera ekokardiografiska variabler korrelerar också med prognosen och kan bidra till den prognostiska bedömningen [19]. Kärlrika tumörer och arteriovenösa fistlar leder till ett ökat volymarbete som ofta tolereras väl utan utveckling av hydrops. Trots att hjärtat blir ordentligt förstorat brukar det inte bli några stora klaffläckage och blodflödet till placenta inte bli alltför påverkat.
Någon fetal behandling finns i praktiken inte, och de fosterkardiologiska bedömningarna går i princip ut på att utvärdera om fostrets tillstånd tillåter fortsatt graviditet och hur barnet ska omhändertas efter födelsen. Ett i detta sammanhang viktigt tillstånd är arteriovenösa fistlar i huvudet, där fosterhjärtats högra kammare pumpar stora volymer blod mot ett lågt motstånd, som dock ökar dramatiskt då ductus arteriosus stängs kort tid efter födelsen (Figur 5). Ductus arteriosus måste därför hållas öppen till dess att lungkärlsmotståndet sänkts och kammaren bedöms klara ett ökat tryckarbete. Fistlar i den nedre kroppshalvan och venöst återflöde via den nedre hålvenen belastar i större utsträckning den vänstra kammaren, och behovet av en öppen ductus efter födelsen är inte lika förutsägbart.
Ett annat tillstånd som förväntas resultera i att hjärtat tvingas pumpa för mycket blod är att vara mottagare i ett tvillingtransfusionssyndrom. Hjärtat ser dock inte alls ut att vara volymbelastat utan snarare som ett hjärta under onormal tryckbelastning. Förklaringen är att donatorns påslag av renin–angiotensinsystemet hos mottagaren orsakar vasokonstriktion, som i kombination med hypervolemi resulterar i ett ökat pumpmotstånd. Redan tidigt i förloppet ses lätt hypertrofi och försämrad diastolisk fyllnad i höger kammare. Med tilltagande hypertrofi försämras också den systoliska funktionen, flödet genom pulmonalklaffen försvinner och ibland uppstår även en förträngning i höger kammares utflöde. Vänster kammare påverkas senare och följer ett liknande förlopp men utvecklar inget avflödeshinder. Fosterekokardiografiska tekniker är av nytta redan vid tidig diagnostik av tvillingtransfusionssyndrom, men behövs framför allt för att följa förloppet hos både donator och mottagare [20].
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Orsaker till fetal hjärtsvikt och hydrops
Hjärtmuskelsjukdom
Myokardit
Kardiomyopati
Hög volym- och/eller tryckbelastning
Hjärtfel med stora klaffläckage
Kärlrika tumörer i foster och placenta
Arteriovenösa fistlar
Agenesi av ductus venosus med navelsträngsven till systemvener
Pumptvilling vid akardisk tvillinggraviditet
Mottagare vid tvillingtransfusionssyndrom
Ductus arteriosus-stängning
Arytmi
Supraventrikulär takykardi
Komplett hjärtblock
Anemi, ischemi
Mekanisk kompression
Pleura och perikardvätska
Tumörer