Målsättningen för behandling av typ 2-diabetes är att förhindra komplikationer, god glukoskontroll är där en viktig del av behandlingen.
För att på bästa sätt erbjuda effektiv läkemedelsbehandling behöver man känna till läkemedlens verkningsmekanismer och den grundläggande patofysiologin vid typ 2-diabetes.
Denna artikel tar upp såväl etablerade som nya läkemedel för behandling av typ 2-diabetes.
Målsättningen för behandling av typ 2-diabetes är att förhindra komplikationer. Ju tidigare i livet man insjuknar och ju sämre glukoskontroll man har under sjukdomstiden, desto större är risken att drabbas av diabeteskomplikationer. En god glukoskontroll är en viktig del av behandlingen för att motverka dessa komplikationer [1, 2].
I dag finns en mängd läkemedel som alla har förmågan att sänka blodglukos utifrån olika verkningsmekanismer. För att på bästa sätt behandla patienter måste man känna till dessa läkemedels verkningsmekanismer och även översiktligt patofysiologin vid typ 2-diabetes.
Patofysiologi
Insulinresistens i skelettmuskel. Vid typ 2-diabetes föreligger flera grundläggande störningar, där insulinresistens är av stor betydelse. Insulin frisätts från pankreasöarnas betaceller som svar på förhöjd blodglukoshalt. Efter måltid tas 80 procent av kolhydraterna upp av skelettmuskulaturen via ett insulinberoende glukosupptag [3]. Receptorer för insulin (som finns på muskelns yta) aktiveras, och via en signaleringskaskad aktiveras slutligen specifika glukostransportörer som sänds ut till cellmembranet och möjliggör för glukos att transporteras in till cellen (insulinberoende glukosupptag) [3]. Vid insulinresistens i skelettmuskulaturen föreligger alltid ett nedsatt insulinberoende glukosupptag.
Insulinresistens i lever. Upptaget av glukos i levern är liksom upptaget i skelettmuskeln insulinberoende, och glukos kan där omsättas eller lagras som glykogen. Levern har en unik förmåga att via glykogen nybilda glukos (glukoneogenes), varvid normala glukosnivåer upprätthålls vid fasta. Insulin hämmar glukoneogenesen, och glukagon (som frisätts från alfaceller i pankreas) stimulerar glukoneogenesen. Vid insulinresistens i levern föreligger defekt insulinsignalering, vilket medför att insulinet inte lika effektivt hämmar glukoneogenesen samtidigt som glukagoninsöndringen är stegrad [3]. Kliniskt kan detta återspeglas som höga fasteglukosvärden (f-glukos).
Insulinresistens i fettväv. Insulin är viktigt även för fettsyrametabolismen. Vid typ 2-diabetes kan även fettväven vara insulinresistent, vilket leder till lipolys och därmed ökade fria fettsyror i blodet. De fria fettsyrorna ansamlas i bl a skelettmuskulatur och lever och åstadkommer där försämrad insulinsignalering [4]. Kliniskt kan man se måttligt förhöjda till höga koncentrationer av triglycerider i blodet.
Njurens roll. Även njuren kan nybilda glukos, men i förhållande till levern är denna produktion försumbar. Däremot återresorberar njuren glukos (kroppen vill inte göra sig av med värdefull energi). Vid typ 2-diabetes är tröskelvärdet för denna återresorption förhöjd (njuren sparar ännu mer glukos) [5].
Betacellssvikt. Så länge betacellerna kan kompensera för insulinresistens med ökad insulinsekretion kan normoglykemi upprätthållas. Då betacellerna inte längre kan kompensera med ökad insulinsekretion uppstår hyperglykemi [6]. I regel är detta en mycket långsam process, där utveckling från normal glukostolerans till nedsatt glukostolerans och slutligen till manifest typ 2-diabetes kan ta flera år. Redan vid symtomdebut för typ 2-diabetes har individen oftast förlorat en betydande del av betacellsfunktionen och nästan hälften av betacellsvolymen [7].
Nationella riktlinjer
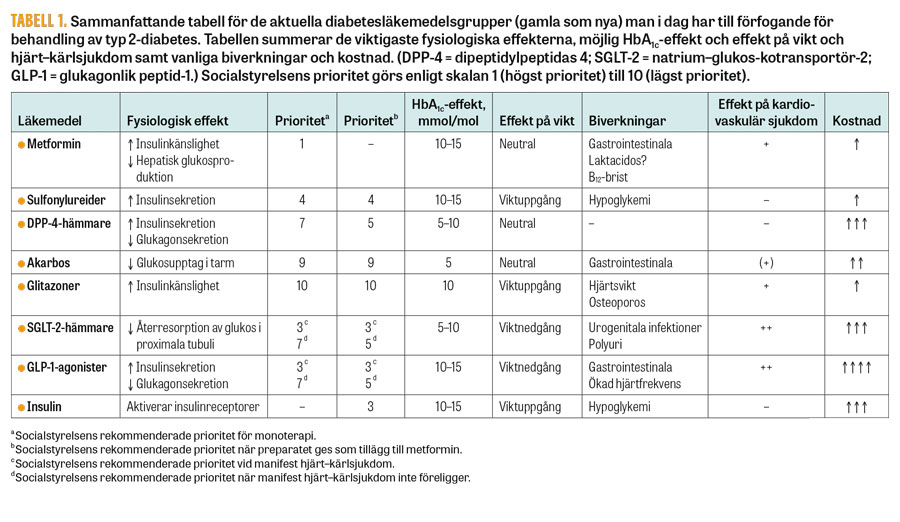
Läkemedelsverket, Statens beredning för medicinsk och social utvärdering, Socialstyrelsen och Tandvårds- och läkemedelsförmånsverket samt Läkemedelsverket har som syfte att förse hälso- och sjukvården med en uppdaterad och samlad bild av hur vi bäst erbjuder våra patienter behandling vid typ 2-diabetes. Utöver den mängd vetenskapliga artiklar som måste gås igenom görs också hälsoekonomiska beräkningar som slutligen resulterar i nationella riktlinjer för diabetesvård. I de nationella riktlinjerna från 2017 prioriteras diabetesvården enligt en skala från 1 (högst prioritet) till 10 (lägst prioritet).
Val av diabetesläkemedel
Alla individer med typ 2-diabetes ska erbjudas motiverande insatser för livsstilsförändring, och hos personer med nydebuterad diabetes bör man eftersträva normalt blodglukosvärde. Oavsett behandlingsmål ska den behandlande läkaren erbjuda adekvat läkemedelsbehandling med syfte att motverka hyperglykemiska symtom.
För val av läkemedel bör man beakta faktorer som individen själv kan påverka (attityd, behandlingsföljsamhet och stöd från anhöriga) och faktorer som individen inte kan påverka (ålder, förväntad kort livslängd, annan svår kronisk sjukdom och hjärt–kärlsjukdom). Utöver detta är andra faktorer såsom fetma, lång diabetesduration, njurfunktionsnedsättning, risk för hypoglykemi och pris också avgörande för val av läkemedel [8].
Metformin
Då livsstilsförändringar inte räcker för att uppnå behandlingsmålet bör alla individer med typ 2-diabetes erbjudas metforminbehandling. Metformin (biguanid), som funnits på marknaden i drygt 50 år, stimulerar AMP-aktiverat proteinkinas, vilket minskar leverns glukoneogenes och ökar glukosupptag i skelettmuskulaturen [9]. Metformin frisätter inte insulin och ger inte hypoglykemi och anses vara viktneutralt.
I kliniska studier sänker metformin HbA1c med 10–15 mmol/mol [10]. Metformin ger inte sällan gastrointestinala biverkningar (väderspänning, diarré och illamående), vilket patienten alltid måste upplysas om. Denna typ av biverkning är ofarlig men kan upplevas som plågsam. För att minska uppkomsten av biverkning är intag av tabletten i samband med måltid och med långsam upptitrering helt avgörande. Om gastrointestinal biverkning uppkommer under pågående upptitrering bör patienten återgå till föregående dos och stanna vid den högsta tolererade dosen.
Förutom gastrointestinala biverkningar finns det några få undantag där vi inte kan använda metformin, t ex uttalad njurfunktionsnedsättning (estimerad GFR [eGFR] <30 ml/min). I samband med metforminbehandling och nedsatt njurfunktion kan den ovanliga, men mycket allvarliga, biverkningen laktacidos inträffa – en biverkning som under senare tid debatterats [11]. Metformin kan i dag användas till patienter med eGFR ≥30 ml/min (man bör göra en dosreduktion från eGFR <45 ml/min). Vid svåra infektioner eller risk för intorkning samt inför intravenös kontrasttillförsel ska metformin tillfälligt sättas ut och kan sedan återinsättas enligt gängse rutiner.
Sulfonylureider och metiglinider
Sulfonylureiderna (glimepirid, glipizid och glibenklamid) ökar insulinsekretion genom att stimulera receptorer på betacellens yta, detta i sin tur genom att stänga ATP-känsliga kaliumkanaler i betacellsmembranet. Stängning av kaliumkanalen framkallar depolarisation av betacellen och resulterar i ökat inflöde av kalcium till cellen genom öppnande av kalciumkanalerna, vilket slutligen leder till insulinfrisättning [12].
Effekten av insulinstimulering bestäms helt av betacellens kvarstående kapacitet att producera insulin. Med sulfonylureidbehandling ökar risken för allvarliga hypoglykemier; risken är störst för glibenklamid eftersom detta läkemedel har aktiva metaboliter som utsöndras via njurarna. Sulfonylureider har bra och snabb glukossänkande effekt (HbA1c 10–15 mmol/mol). Sulfonylureider kan ges i kombination med metformin. Det är dock mer tveksamt huruvida sulfonylureider ska användas i kombination med insulin, framför allt hos äldre, eftersom risken för hypoglykemi kan öka [13]. Sulfonylureider ska (liksom metformin) inte användas vid nedsatt njurfunktion (kontraindicerat om eGFR <30 ml/min).
Repaglinid, tillhör gruppen metiglinider, är en kortverkande insulinfrisättare som stänger de ATP-känsliga kaliumkanalerna via ett målprotein i betacellen. Repaglinid kan möjligen ge en fördel jämfört med sulfonylureider med avseende på hypoglykemier [12], dock till priset av fler doseringstillfällen (repaglinid ska alltid tas i samband med måltid, vilket inte krävs för sulfonylureider). Repaglinid kan användas även vid terminal njursvikt.
Pioglitazon
Pioglitazon, som tillhör gruppen glitazoner, ökar insulinkänsligheten genom att binda till nukleära peroxisomproliferator-aktiverade γ-receptorer (PPAR-γ) som via genuttryck (mRNA) inverkar på fettsyrametabolismen [14]. Pioglitazon påverkar blodglukos främst genom förbättrad insulinkänslighet och kan vid uttalad insulinresistens ha god effekt på HbA1c, ca 10–15 mmol/mol. Man måste dock komma ihåg att den maximala effekten kan komma först efter 2–3 månader. Läkemedlet lämpar sig därför sällan i monoterapi om syftet med behandlingen är snabb HbA1c-sänkning. Pioglitazon ska inte användas vid hjärtsvikt. Läkemedlet är förknippat med en viss viktuppgång.
Alfaglukosidashämmare
Akarbos är en alfaglukosidashämmare som hämmar upptaget av kolhydrater i tunntarmen efter måltid [12]. Eftersom mer kolhydrater kvarstannar i tarmen är förekomsten av gastrointestinala biverkningar mycket hög. Läkemedlet absorberas till blodet till endast 3 procent och ger därför ringa risk för systembiverkningar. Akarbos ger inte hypoglykemi. Den höga förekomsten av gastrointestinala biverkningar och den modesta effekten på HbA1c, ca 5 mmol/mol, medför att läkemedlet sällan används.
Insulin
Insulinbehandling vid typ 2-diabetes är alltid att föredra om det finns behov av snabb glukossänkning eller vid uttalad betacellssvikt (t ex vid lång diabetesduration). Likaså kan man i princip alltid använda insulin om det föreligger kontraindikation för andra diabetesläkemedel. NPH-insulin till natten är ett bra alternativ vid högt HbA1c, som tillägg till metformin. Rekommendationen är då att starta med NPH-insulin (10–12 E) och titrera till målvärde (f-glukos 6 mmol/l). Om f-glukosvärdet tre på varandra följande morgnar är >8 mmol/l alternativt 6–8 mmol/l, ökar man med 4 E respektive 2 E till dess att patienten uppnått f-glukos 6 mmol/l [15]. HbA1c kontrolleras tidigast efter 2–3 månader.
Om HbA1c då är fortsatt otillfredsställande måste man fundera på behandlingsföljsamhet eller möjlig postprandial hyperglykemi (kontrollera då blodglukos före och efter måltid).
Vid postprandial hyperglykemi krävs oftast även måltidsinsulin. En enkel behandlingsstrategi är basal bolusregim där man kan börja med att lägga till ett måltidsinsulin till den största måltiden [16].
Flera nya diabetesläkemedel
Under de senaste 10 åren har vi fått fler nya läkemedel för behandling av typ 2-diabetes. Vissa av dem är redan etablerade (inkretinbaserade läkemedel), medan andra är relativt nya (natrium–glukos-kotransportör-2 [SGLT-2]-hämmare).
Inkretinbaserade läkemedel
Vid födointag frisätts från tarmen bl a inkretinhormonet GLP-1 (glukagonlik peptid-1) som stimulerar till insulinfrisättning från betacellerna i pankreasöarna [17]. Denna stimulering sker genom en glukosberoende mekanism, vilket medför att insulinfrisättningen avstannar om blodglukos sjunker under 5 mmol/l. Mer än 50 procent av betacellernas insulinsekretion efter födointag beror på inkretineffekten [18]. Sekretionen av GLP-1 efter måltid är dosberoende, vilket innebär att ökat kaloriintag leder till större frisättning av GLP-1 [19]. Inkretinbehandling, som stimulerar GLP-1-receptorn, delas upp i GLP-1-agonister (subkutan injektionsbehandling) och DPP-4 (dipeptidylpeptidas-4)-hämmare (tablettbehandling).
GLP-1-agonister. GLP-1-agonisterna har dels utvecklats ur exendin-4 (exenatid och lixisenatid), dels ur nativt GLP-1 (liraglutid och dulaglutid). Vid injektion av GLP-1 stimuleras receptorn mer kraftfullt än vid den fysiologiska GLP-1-stimulering som ses med DPP-4-hämmare. Detta leder till en HbA1c-sänkning på 10–15 mmol/mol, men även till ökad mättnadskänsla och möjlig viktnedgång [20]. Inte sällan drabbas patienterna av gastrointestinala biverkningar (illamående och ibland även kräkningar), vilka oftast är övergående inom några veckor. Halveringstiden för GLP-1-agonister varierar och därmed injektionsfrekvensen (exenatid 2 gånger per dag, liraglutid och lixisenatid 1 gång per dag). I dag finns även beredningar som kan ges 1 gång per vecka (exenatid och dulaglutid). Allt oftare kombineras GLP-1-agonisterna med insulin, och i dag finns även färdiga kombinationsberedningar med insulin och GLP-1-agonister.
DPP-4-hämmare. GLP-1 inaktiveras i blodet genom enzymet dipeptidylpeptidas-4 (DPP-4). Enzymet klyver GLP-1-peptiden till en inaktiv peptid som elimineras via njuren. Inaktiveringen sker snabbt, vilket medför att GLP-1 har kort halveringstid (1–2 minuter). DPP-4-hämmare (sitagliptin, saxagliptin, vildagliptin och linagliptin) binder till DPP-4-enzymet och motverkar således nedbrytningen av GLP-1, vilket medför en fysiologisk koncentrationsökning av GLP-1 i blodet [21].
DPP-4-hämmarna ger alla en likvärdig HbA1c-reduktion (5–10 mmol/mol) [22]. DPP-4-hämmarna är viktneutrala, och man kan inte förvänta sig någon viktreduktion som för GLP-1-agonisterna. Glukagoninsöndringen hämmas dock vid behandling med DPP-4-hämmare. DPP-4-hämmare tolereras oftast mycket väl av patienterna och har låg biverkningsgrad. Vid sviktande njurfunktion ska dosen av sitagliptin, saxagliptin och vildagliptin reduceras. Detta gäller dock inte för linagliptin, som kan användas oberoende av njurfunktionen eftersom nedbrytningen sker i levern [23] till skillnad från de andra DPP-4-hämmarna som elimineras via njuren.
DPP-4-hämmare kan vara fördelaktiga för äldre individer med typ 2-diabetes om behandlingsmålet för HbA1c är mindre viktigt och för att undvika hypoglykemier.
Natrium–glukos-kotransportör-2-hämmare
Under fysiologiska förhållanden reabsorberas glukos till 90 procent via SGLT-2-receptorer, vilka är lokaliserade i proximala njurtubuli. SGLT-2-hämmare (dapagliflozin, empagliflozin och kanagliflozin) binder till receptorerna och hämmar därmed reabsorptionen av glukos. SGLT-2-hämmare sänker njurtröskelvärdet för reabsorptionen av glukos (mer glukos utsöndras). Kliniska studier visar en HbA1c-sänkning på 5–10 mmol/mol [14].
Eftersom effekten av dessa läkemedel är oberoende av insulinresistens och betacellssvikt ses likartad HbA1c-sänkande effekt vid debut av typ 2-diabetes som vid lång diabetesduration (relativ insulinbrist). SGLT-2-hämmare anses vara särskilt lämpade vid postprandial hyperglykemi. Den glukossänkande effekten avtar vid njurfunktionsnedsättning (eGFR <45 ml/min) [24]. Andra gynnsamma effekter av behandling med SGLT-2-hämmare kan vara en viktreduktion på 2–3 kg (vilken i regel stabiliseras efter ca 4–6 månader), eftersom man förlorar ca 250 kcal/dag (60–90 g glukos) i urinen [25].
En vanlig biverkning av SGLT-2-hämmare är genital svampinfektion (även bakteriell urinvägsinfektion), och det är viktigt att informera patienten om detta.Genital svampinfektion ska behandlas enligt rådande behandlingsföreskrifter utan att behandlingen med SGLT-2-hämmare egentligen måste upphöra. Man ska även informera patienten om att SGLT-2-hämmare har diuretiska effekter (patienten kan i början av behandlingen uppleva ökad urinering, som oftast avstannar vid förbättrad glukoskontroll). Man bör dock vara försiktig med behandling med SGLT-2-hämmare till äldre individer med samtidig omfattande diuretikabehandling på grund av risk för intorkning.
Eftersom SGLT-2-hämmare kan öka ketonbildning ska läkemedlet inte ges till individer med ketosbenägenhet (t ex individer med typ 1-diabetes). För kanagliflozin sågs i utfallsstudien en signifikant ökad risk för tåamputationer; det är därför kontraindicerat att ge kanagliflozin till patienter med pågående fotsår [26]. Man kan inte helt utesluta en s k klasseffekt för SGLT-2-hämmare, varför försiktighet möjligen ska råda även för behandling med empagliflozin [27] och dapagliflozin vid pågående fotsår och typ 2-diabetes.
Metformin och livsstilsintervention är grunden
I fråga om förstahandsval av läkemedelsbehandling vid typ 2-diabetes skiljer sig inte Socialstyrelsens nya rekommendationer 2017 från dem 2010. Patienter med typ 2-diabetes bör erbjudas metformin. Om patienten inte tolererar metformin är många diabetesläkemedel från olika läkemedelsgrupper subventionerade att användas i monoterapi. Nytt från Socialstyrelsen är att individer med typ 2-diabetes och manifest hjärt–kärlsjukdom bör erbjudas empagliflozin/kanagliflozin eller liraglutid.
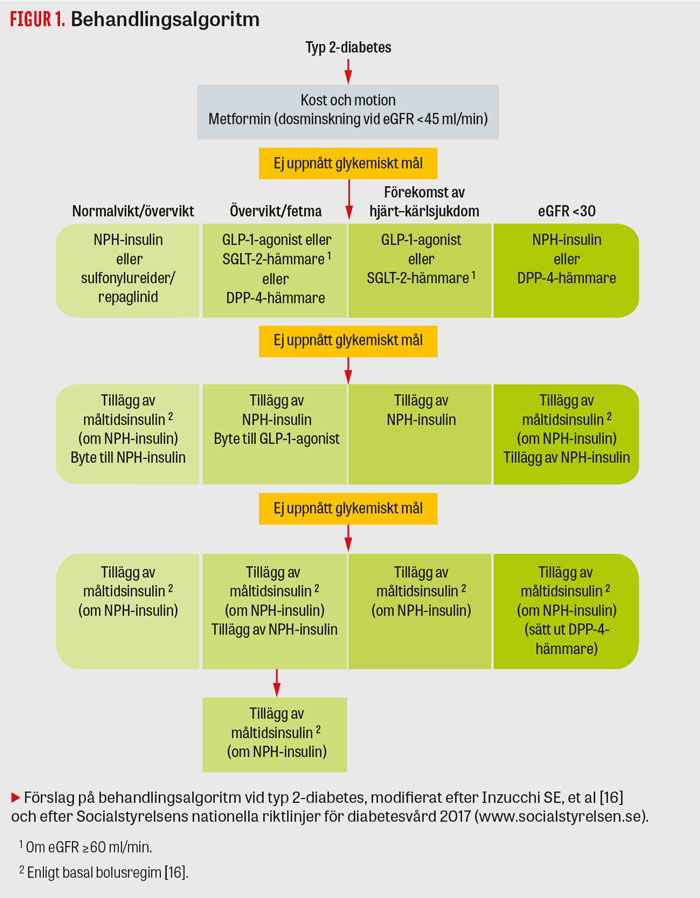
Då metformin inte räcker till för en bra glukoskontroll måste man fundera på vilket/vilka av diabetesläkemedlen som passar individen bäst (Tabell 1). Många av de perorala diabetesläkemedlen finns i fasta kombinationer med metformin, vilket kan förenkla behandlingsföljsamheten, men de kan också vara olämpliga för vissa individer. Vidare finns också fasta kombinationer i injektionsform. Oavsett vilken behandling man väljer efter metformin ska metformin och fortsatt livsstilsintervention alltid utgöra grunden för behandling vid typ 2-diabetes (Figur 1).
I läkemedelsvalet efter metformin bör dock individens behov vara vägledande [8]. De faktorer som då kan vara avgörande är bl a manifest hjärt–kärlsjukdom, fetma, nydebuterad sjukdom, ålder, risk för hypoglykemi, njurfunktionsnedsättning och pris (Figur 1, Tabell 1)
Genom kännedom om de bakomliggande störningar som karakteriserar sjukdomen och de effekter som livsstilsintervention tillsammans med diabetesläkemedlen kan åstadkomma kan vi bli ännu bättre rustade för effektiv behandling av individer med typ 2-diabetes.
Potentiella bindningar eller jävsförhållanden: Thomas Nyström har mottagit föreläsararvode från AstraZeneca, Boehringer Ingelheim, Eli Lilly och NovoNordisk samt erhållit forskningsanslag från AstraZeneca, Eli Lilly och NovoNordisk. David Nathanson har mottagit föreläsararvode från Eli Lilly, Novo Nordisk, Boehringer Ingelheim och AstraZeneca. Utöver detta har författarna även ett akademiskt forskningssamarbete med AstraZeneca (DAISY-projektet).
Tina Nyström Rönnås, Stockholm, har bidragit med kritisk granskning av manuskriptet.