Vid läkemedelsresistent epilepsi ger tilläggsbehandling med vagusnervstimulering minskad anfallsfrekvens hos vuxna och ungdomar med epilepsi.
Vagusnervstimulering har få biverkningar, och interaktion med läkemedel saknas.
Det vetenskapliga underlaget för behandling av epilepsi med djup hjärnstimulering är otillräckligt.
Ketogen diet är en väletablerad behandling vid epilepsi hos barn och ungdomar.
Ketogen diet är en noggrant beräknad kost som består av hög andel fett, det dagliga behovet av protein och ett minimum av kolhydrater.
Vid vissa neurometabola sjukdomar kan ketogen diet ge anfallsreduktion och ofta anfallsfrihet och även förbättra motoriska symtom och psykomotorisk utveckling.
För personer med läkemedelsresistent epilepsi som inte är kandidater för epilepsikirurgi kan det bli aktuellt med andra behandlingsmetoder. I dag används olika typer av neurostimulering och kostbehandlingar, oftast som komplement till läkemedelsbehandling. Vagusnervstimulering (VNS) har funnits länge och är en kliniskt etablerad metod. Andra typer av hjärnstimulering är mer experimentella och inte kliniskt etablerade. Kostbehandling intar en allt större plats i behandlingsarsenalen, och intresset och efterfrågan från patienter är stort.
Vagusnervstimulering
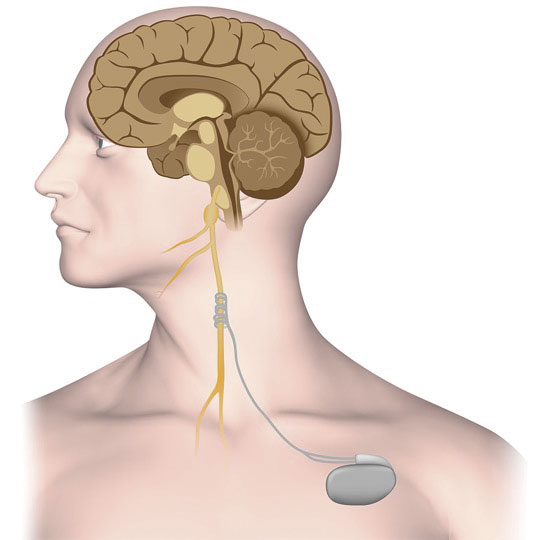
Vagusnervstimulering innebär att man med en pulsgenerator ger elektriska signaler som via vagusnerven når hjärnan. Den exakta mekanismen för den antikonvulsiva effekten är inte helt klarlagd. Resultat från experimentella djurstudier och humana funktionella avbildningsstudier samt EEG- och likvorundersökningar talar för att stimuleringen påverkar vagala afferenter som via kärnor i hjärnstammen projicerar till talamus och limbiska systemet. Genom påverkan på dessa strukturer, som utgör delar av de neuronala nätverk som är involverade i generering och spridning av epileptisk aktivitet, kan anfall förhindras. Långvarig stimulering av vagusnerven ger också förändringar i inhibitoriska och excitatoriska transmittorsystem, vilket kan förklara kroniska antiepileptiska effekter [1].
Hur går det till?
En vagusnervstimulator består av en elektrod som via en incision på halsen appliceras runt vagusnerven och sedan förbinds med en pulsgenerator placerad subkutant på bröstet (Figur 1). Eftersom det framför allt är höger vagus som innerverar hjärtat sker stimulering oftast på cervikala delen av den vänstra vagusnerven för att minimera risker för kardiella biverkningar såsom bradykardi och asystoli. Inläggning av vagusnervstimulatorn sker på neurokirurgisk klinik i generell anestesi, och patienten kan oftast gå hem efter ett vårddygn. Vid polikliniska besök programmeras generatorn med olika paradigm för kronisk intermittent stimulering. Patienterna förses med en magnet vilken de själva, eller vårdare/förälder, kan placera på generatorn för att utlösa en vidbehovsstimulering när man varseblir en anfallsstart.
När är vagusnervstimulering indicerad?
Vagusnervstimulering har varit godkänd som tilläggsbehandling vid epilepsi sedan mitten av 1990-talet, och hittills har fler än 85 000 patienter behandlats. Metoden är i första hand en tilläggsbehandling framför allt vid fokal epilepsi i de fall där epilepsikirurgisk behandling ej är möjlig.
Behandlingsresultat av vagusnervstimulering
Den vetenskapliga grunden för behandlingen är begränsad. Randomiserade kontrollerade studier på barn, ungdomar och vuxna med sammanlagt 439 deltagare har visat en 50-procentig anfallsminskning hos 20–40 procent av patienterna [2]. I en Cochrane-analys av kontrollerade studier av vagusnervstimulering konkluderades att patienter som behandlades med hög stimulering (terapeutisk dos) fick en signifikant anfallsminskning jämfört med en kontrollgrupp som fick låg stimulering (subterapeutisk dos) [3]. En anfallsminskning med 50 procent används ofta som ett mått på klinisk betydelsefull effekt, men målsättningen för epilepsibehandling är anfallsfrihet utan besvärande biverkningar. Andelen patienter som blir anfallsfria med vagusnervstimulering är ytterst liten och nyttan av vidbehovsstimulering har inte studerats systematiskt. I långtidsuppföljningar av vuxna har vagusnervstimulering visat sig vara förenad med en förbättrad livskvalitet [4]. Positiva effekter på svårighetsgrad av anfall samt sinnesstämning finns rapporterade i flera okontrollerade studier [5].
Biverkningar av vagusnervstimulering
Biverkningar såsom röstförändringar, hosta, dyspné, smärta, parestesier, illamående och huvudvärk är stimulationsrelaterade och övergående, och interaktionsproblematik med läkemedel saknas. Alla typer av diatermi ska undvikas vid vagusnervstimulering. Tidigare har vagusnervstimulering utgjort ett hinder för undersökningar med magnetkamera, men i dag finns riktlinjer för hur detta kan utföras, dock fortfarande inte i området torax, ryggrad och buk.
Djup hjärnstimulering
Framgångsrik behandling med djup hjärnstimulering vid neurologiska sjukdomar, framför allt motorikstörningar, har banat väg för liknande behandlingar vid epilepsi [6]. En vanlig anfallstyp vid epilepsi är fokala anfall med medvetandepåverkan. Dessa anfall kan starta i olika neuronala nätverk och ge upphov till olika anfallssymtom. Gemensamt är dock att de ofta sprider sig via väldefinierade nätverk såsom kortiko-striato-talamiska banor och det limbiska systemet. Genom elektrisk stimulering av noder i dessa nätverk kan man modulera impulsflödet och spridning av anfallsaktivitet. Det är framför allt stimulering av nucleus thalamicus anterior som används i dag. I en kontrollerad studie av 110 patienter med fokal epilepsi påvisades en signifikant anfallsminskning som ökade med tiden efter operation [7]. Stimulationsrelaterad depression och minnessvårigheter rapporterades av några patienter. Behandlingen är reversibel och stimuleringen kan stängas av och systemet tas bort. Metoden är invasiv, dyrbar och finns i dag tillgänglig endast på ett fåtal ställen i Sverige.
Ketogen diet
Ketogen diet och modifierad ketogen diet är väletablerade behandlingar vid läkemedelsresistent epilepsi hos barn. Antalet indikationer ökar, speciellt bland neurometabola sjukdomar, där hjärnan och mitokondrierna inte kan tillgodogöra sig glukos som substrat för energiproduktion utan i stället kan utnyttja ketonkroppar. Exempel på sådana tillstånd är glukostransportprotein typ 1-brist (GLUT-1-brist) och pyruvatdehydrogenas komplexdefekt (PDH-brist).
Ketogen diet innebär en noggrant beräknad kost som består av hög andel fett, det dagliga behovet av protein och ett minimum av kolhydrater. Fettet i kosten omvandlas i levern till ketonkroppar som transporteras till kroppens celler och över blod–hjärnbarriären och kan användas som alternativ energikälla i hjärnan. Vid detta metabola skifte sker många biokemiska, metabola, hormonella och fysiologiska förändringar som kan bidra till minskad neuronal retbarhet och därmed bättre anfallskontroll.
Hur verkar ketogen diet?
I dag finns god kunskap om ett flertal verkningsmekanismer som anses leda till minskad neuronal hyperexcitabilitet. Man har funnit minskad glutamaterg synapstransmission och ökad syntes av GABA, inhibition av glykolys och inhibition av AMPA-receptormedierad neuronal excitation, inhibition i rapamycin (mTOR)-systemet, ökad redoxpotential i mitokondrierna och aktivering av ATP-känsliga kaliumkanaler. [10].
När är ketogen diet indicerad?
Effekt ses vid många läkemedelsresistenta epilepsityper och är särskilt väldokumenterad vid myoklon atonisk epilepsi, Lennox–Gastauts syndrom, Dravets syndrom och tuberös skleros-komplexet. Ketogen diet är också indicierad vid de ovanliga metabola tillstånden GLUT-1-brist och PDH-brist och kan vara effektiv vid vissa andra mitokondriella sjukdomar. Inför behandlingsstart är det viktigt att utesluta sjukdomar i fettsyrametabolismen.
Hur går det till?
För att genomföra ketogen diet beräknar en dietist kostupplägget individuellt för varje barn och tar fram strikt uträknade måltidsförslag (matrecept). Det krävs regelbundna kontroller och stöd av ett team bestående av dietist, sjuksköterska och läkare. Modifierad ketogen diet är en mindre strikt diet där patienten komponerar måltider själv, med intag av 10–20 gram kolhydrater per dygn, fritt intag av proteiner och så stor mängd fett som möjligt (Figur 2). Vid den klassiska ketogena dieten krävs tillskott av vitaminer, mineraler och kalcium med D-vitamin. För barn med gastrostomi finns färdigberedd sondnäring. Utvärdering av dietbehandlingen rekommenderas efter 3 månaders behandling, och man fortsätter om god effekt erhållits. Efter 2 års behandling bör man ta ställning till utsättande av dieten. Detta sker vanligen under 3–6 månader. För de metabola sjukdomarna är behandlingen långvarig, eventuellt livslång.
En internationell expertgrupp har sammanställt ett konsensusdokument med behandlingsrekommendationer för ketogen diet utifrån vetenskaplig evidens och klinisk erfarenhet [11]. I Sverige finns behandlingscentrum för barn i Göteborg, Linköping, Lund, Stockholm, Umeå, Örebro och Uppsala.
Behandlingsresultat av ketogen diet
Ketogen diet har använts sedan de första rapporterna om anfallskontroll på 1920-talet. I öppna studier reduceras anfallen med mer än 50 procent hos cirka hälften av patienterna, och cirka 10 procent blir helt anfallsfria. I en randomiserad kontrollerad prospektiv studie svarade 38 procent på behandling (>50 procent anfallsminskning) med ketogen kost jämfört med 6 procent i kontrollgruppen [12] medan en mindre studie visade att 50 procent svarade på behandling [13]. Flera studier visar minskad mängd epileptiform aktivitet i EEG samt bättre sömnkvalitet och kognitiva effekter, bland annat ökad uppmärksamhet [14]. Förbättring av beteende och kognition noteras ofta och bekräftades nyligen i en randomiserad kontrollerad studie [15]. I en skandinavisk studie har effekt och biverkningar efter två års behandling av 300 patienter sammanställts, och resultaten överensstämmer med de internationella [16].
Det finns begränsad erfarenhet av behandling av vuxna med modifierad ketogen diet. Studierna är få och utgörs av små öppna prospektiva studier där effekten synes sämre än hos barn, men en liten grupp uppnår signifikant förbättring och enstaka patienter anfallsfrihet [17].
I ett flertal rapporter har man vid behandling med ketogen diet vid GLUT-1-brist och PDH-brist visat reduktion av epilepsianfall och ofta anfallsfrihet samt förbättring av kognitiv utveckling och motoriska symtom som ataxi och koordinationsstörning. Tidig diagnos och behandling vid GLUT-1-brist kan förhindra utveckling av epilepsi och kognitiv påverkan.
Risker med behandling med ketogen diet
Biverkningarna är få och går ofta att åtgärda (förstoppning, illamående, magont, diarré). Allvarligare biverkningar är ovanliga: njursten (risken ökar vid samtidig behandling med topiramat och zonisamid och minskar vid tillskott av kaliumcitrat), hyperurikemi, hyperlipidemi, kardiomyopati och försämrad tillväxt. Vid behandlingsstart, infektioner, vätskeförlust och andra katabola tillstånd finns risk att patienten utvecklar metabol acidos, vilket behandlas med tillförsel av vätska och elektrolyter.
Framtida behandlingsalternativ
Det pågår en intensiv forskning och utveckling av alternativa behandlingsmetoder vid epilepsi. Flera sätt att elektriskt stimulera såväl perifera som centrala nervsystemet utforskas. Kliniska prövningar av icke-invasiv stimulering av vagusnerven pågår. Transkutan vagusstimulering innebär att en stimulator placeras i ytterörat och ger impulser till en sensorisk gren av vagusnerven. Responsiv neurostimulering är en avancerad invasiv teknik där en inopererad generator programmeras för att detektera och inhibera epileptisk aktivitet direkt i det anfallsgenererande området i kortex eller hippokampus [8, 9].
Forskning pågår också avseende nya enklare dieter med kalorirestriktion, direkt tillförsel av ketonkroppar och triglycerider som kan verka på olika nivåer i citronsyracykeln.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.