Direktverkande antikoagulantia (NOAK) är lika effektiva som warfarin vid sekundärprofylax av venös tromboembolism, men medför en lägre risk för blödningar och erbjuder enklare dosering.
Om en allvarlig blödning eller behov av akut kirurgi ändå uppkommer, finns i dag antidot mot dabigatran samt en handläggningsplan för övriga NOAK.
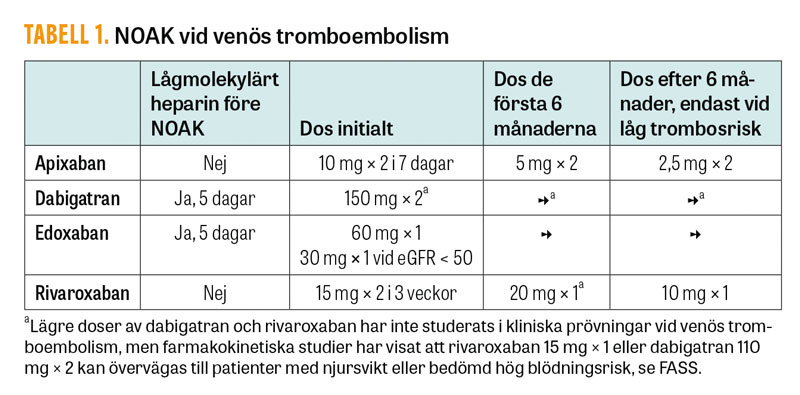
Samtliga NOAK har visats förebygga recidivtrombos lika effektivt som warfarin, men med lägre risk för blödningar i de grundläggande studierna [1-4]. På grund av dessa studiers upplägg behöver fem dagars behandling med lågmolekylärt heparin ges före behandlingsstart med dabigatran eller edoxaban. Vid initiering av apixaban eller rivaroxaban ges i stället en högre dos de första dagarna (Tabell 1). Jämfört med warfarin erbjuder NOAK en enklare dosering och mindre behov av kontroller, varför nästan alla patienter med venös tromboembolism erbjuds NOAK redan på akuten i dag. Det är dock viktigt att dessa patienter ändå får en adekvat uppföljning med återbesök till en trombosintresserad läkare, för beslut om eventuell vidare utredning samt behandlingens längd.
Normalt ges NOAK i tre till sex månader efter en första venös tromboembolism. Vid eventuell förlängd behandling kan en lägre dos av rivaroxaban, 10 mg × 1, eller apixaban, 2,5 mg × 2, övervägas, som i studierna gett bibehållen effekt men samtidigt lägre blödningsrisk [5, 6] (Tabell 1). Värt att notera är dock att patienter med stark indikation för fortsatt antikoagulantia exkluderades från dessa studier, varför det är oklart om det hos denna patientgrupp är tillräckligt med en lägre dos. Hos patienter med venös tromboembolism och samtidig uttalad trombofili, speciellt antifosfolipidantikroppssyndrom, är erfarenheterna med NOAK begränsade och rekommenderas för närvarande inte.
Cancerassocierad trombos
Vid cancerassocierad trombos har lågmolekylärt heparin i långtidsbehandling rekommenderats, eftersom risken för recidivtrombos upp till halveras jämfört med warfarin [7, 8]. Nyligen publicerades en studie där edoxaban jämfördes med dalteparin vid cancerassocierad venös tromboembolism [9]. 1 046 patienter inkluderades och fick antingen edoxaban 60 mg × 1 (30 mg × 1 vid eGFR 30–50 eller kroppsvikt ≤ 60 kg) efter fem dagars lågmolekylärt heparin initialt, eller dalteparin 200 IE/kg × 1 i en månad följt av 150 IE/kg × 1 subkutant tills vidare. Studien var randomiserad men inte blindad, och fler patienter som randomiserats till dalteparin avbröt behandlingen. Edoxaban var inte sämre än dalteparin avseende det primära utfallsmåttet, en kombination av allvarlig blödning och recidiv i venös tromboembolism (12,8 vs 13,5 procent; hazardkvot [HR] 0,97, 95 procents konfidensintervall [95KI] 0,70–1,36; P = 0,006) för non-inferiority. Större blödningar var vanligare med edoxaban (6,9 vs 4,0 procent; HR 1,77, 95KI 1,03–3,04; P = 0,04) med en samtidig trend till lägre risk för recidivtrombos (7,9 vs 11,3 procent; HR 0,71, 95KI 0,48–1,06; P = 0,09). Risken för blödningar var särskilt stor hos patienter med gastrointestinal cancer eller med bedömd hög blödningsrisk.
En liknande men mindre pilotstudie med totalt 406 patienter där dalteparin jämförs med rivaroxaban har nyligen publicerats [10]. Patienterna randomiserades till dalteparin i samma dos som ovan eller rivaroxaban 15 mg × 2 i tre veckor, följt av 20 mg × 1 till en total behandlingstid på 6 månader. Det primära utfallsmåttet återfall i venös tromboembolism drabbade 4 procent i rivaroxabangruppen jämfört med 11 procent hos patienter behandlade med dalteparin (HR 0,43, 95KI 0,19–0,99). Kliniskt relevant mindre blödning var vanligare hos patienter behandlade med rivaroxaban (13 vs 4 procent, HR 3,76, 95KI 1,63–8,69).
I väntan på fler studier där NOAK jämförs med lågmolekylärt heparin vid cancerassocierad trombos, kan edoxaban eller rivaroxaban nu vara ett alternativ till dessa patienter, företrädesvis de som redan har genomgått den initiala cancerbehandlingen med eventuell kirurgi eller cytostatika, inte har gastrointestinal cancer och där blödningsrisken förefaller vara låg.
NOAK och blödningar
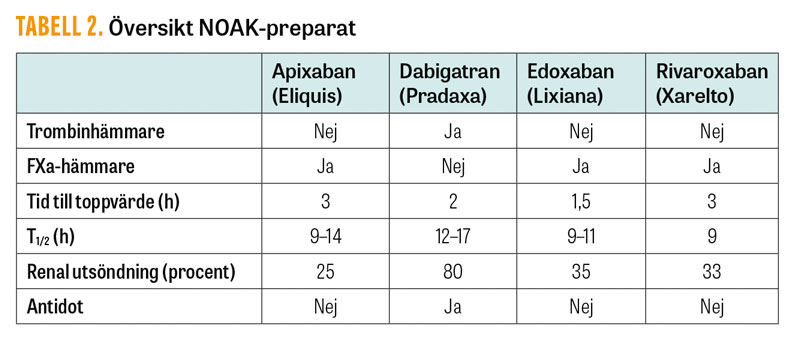
Över 150 000 svenska patienter står i dag på NOAK-behandling, och antalet ökar snabbt. Trots en i grunden låg blödningsrisk innebär detta att en stor mängd patienter kommer att drabbas av en allvarlig blödning eller ha behov av akut kirurgi. Vid mindre akut behov av kirurgi kan man med fördel vänta ut läkemedlets effekt, vilket tar 1–4 dagar beroende på preparat och njurfunktion (Fakta 1). Dabigatran är det NOAK-preparat som är mest beroende av njurfunktionen för elimination, men är samtidigt också det som i dag har en utprovad antidot (Tabell 2) [11].
Idarucizumab (Praxbind) är en antikropp riktad mot dabigatran, som binder dabigatran >300 gånger starkare än dabigatran binder till trombin. Detta innebär att även trombinbundet dabigatran neutraliseras när antikroppen ges, och effekten av dabigatran elimineras närmast momentant. Dosering i studien var två ampuller à 2,5 g, men i klinisk praxis kan 5 g ges direkt vid akut blödning eller kirurgi som inte kan vänta. Viktigt att tänka på är att antidoten endast tar bort dabigatrans effekt. Övrig handläggning av patientens blödning behöver göras på sedvanligt sätt.
Andexanet alfa är en faktor Xa (FXa)-liknande molekyl. I studier har man gett denna som infusion under två timmar, och då »lurat« FXa-hämmare (apixaban, edoxaban och rivaroxaban) att binda denna i stället för den riktiga FXa. På så sätt kan effekten av FXa-hämmarna reverseras kortvarigt. En hög frekvens av tromboemboliska händelser (18 procent) sågs efter behandling med andexanet alfa [12]. Preparatet är godkänt för reversering av apixaban eller rivaroxaban i USA, men är ännu ej godkänt i Europa. I klinisk praxis rekommenderas i stället protrombinkomplexkoncentrat (Ocplex eller Confidex) 2000 IE vid blödning eller behov av akut kirurgi till en patient som står på en FXa-hämmare. Detta har i kliniken fungerat väl, men har inte den direkta och kompletta effekt som en antidot kan ha.
Koncentrationsbestämning av NOAK kan vara av värde vid blödning eller behov av kirurgi, men finns inte tillgängligt på alla sjukhus. Dessutom har vi i dag liten erfarenhet av vilken blödningsrisk patienten har vid kirurgi vid olika läkemedelskoncentrationer av NOAK. En grov uppskattning kan fås genom PK(INR) och APTT. Framför allt APTT kan vara förhöjd vid terapeutisk dabigatrankoncentration i blodet, men är mindre känslig för FXa-hämmarna. Minst känslig är APTT för apixaban, där den kan vara helt normal trots att patienten tagit en för hög dos.
En av de stora riskerna med en blödning hos en antikoagulerad patient, är att de antikoagulantia som skulle skydda mot en tromboembolisk händelse blir utsatta i samband med blödningen. Det är därför viktigt att återstarta antikoagulantia så snart som möjligt efter kirurgin (Fakta 1).
Sammanfattning
NOAK är i dag förstahandsbehandling vid venös tromboembolisk sjukdom, på grund av en både enklare och säkrare behandling. Vid uttalad trombofili är erfarenheten med NOAK begränsad, men nya data ger en möjlighet att använda edoxaban och rivaroxaban vid cancerassocierad trombos. Vid blödning finns i dag antidot mot dabigatran och en i kliniken fungerande handläggning av FXa-hämmarna.
Potentiella bindningar eller jävsförhållanden: Sara Själander har deltagit i utbildningsaktiviteter eller referensgrupper för följande företag: Bristol-Myers Squibb samt Pfizer AB. Anders Själander har deltagit i utbildningsaktiviteter eller referensgrupper för följande företag: Astella, AstraZeneca, Bayer, Boehringer Ingelheim, Bristol-Myers Squibb, CSL Behring, Merck Sharp & Dohme, Novartis, Pfizer samt Sanofi Aventis.
Fakta 1. Kliniska råd vid NOAK. Från [13].
Elektiv kirurgi, tid från sista tablett till kirurgi
- Lågriskingrepp:1 dygn
- Högriskingrepp eller eGFR 15–30:2 dygn
- FXa-hämmare, eGFR 15–30 och högrisk:3 dygn
- Dabigatran, eGFR 15–30 och högrisk: 4 dygn
Återstart av antikoagulantia efter kirurgi
- Mindre kirurgi: 6–8 timmar efter ingrepp eller nästa dag
- Standardrisk: 24–48 timmar efter ingrepp
- Högriskpatient/kirurgi: Profylax med lågmolekylärt heparin postoperativt. Återinsätt NOAK vid god hemostas