Trauma är den främsta dödsorsaken i världen i åldersgruppen 15–45 år [1]. Globalt drabbas ca 5 miljoner personer årligen av trauma, en siffra som väntas öka till 8 miljoner kring år 2020. Bland dessa dödsfall är okontrollerad blödning en av de ledande orsakerna till undvikbara dödsfall [2, 3]. De senaste åren har ämnet fått allt större uppmärksamhet i internationell forskning, och ett paradigmskifte får sägas ha skett. Från att ha gett stora mängder kristalloida och ibland kolloida vätskor samt blodprodukter är man nu mer restriktiv med tunna vätskor och använder sig i större utsträckning av erytrocyter och andra blodprodukter (plasma och trombocyter), liksom andra koagulationsfrämjande läkemedel [4].
I tillägg till detta har även den kirurgiska utvecklingen gått framåt med skadekontrollerande kirurgi och användning av endovaskulära tekniker för att stoppa blödningen.
Traumatisk blödning är delvis olik annan blödning och har sin egen specifika patofysiologi (akut traumatisk koagulopati). Cirka en tredjedel av alla blödande traumapatienter uppvisar koagulopati vid ankomst till sjukhuset, vilket visar sig som sänkt fibrinogenkoncentration, förhöjt PK-värde och förlängd APTT. Dessa patienter har signifikant ökad risk att drabbas av multiorgansvikt och död jämfört med patienter som saknar tecken till koagulopati [5].
Orsaken till den akuta traumatiska koagulopatin är multifaktoriell, men viktiga orsaker tycks vara utspädning, konsumtion av koagulationsfaktorer samt aktivering av systemisk antikoagulation och fibrinolys. Koagulopatin förvärras av hypoxi, hypotermi och acidos [6, 7].
Att upptäcka behovet av massiv transfusion
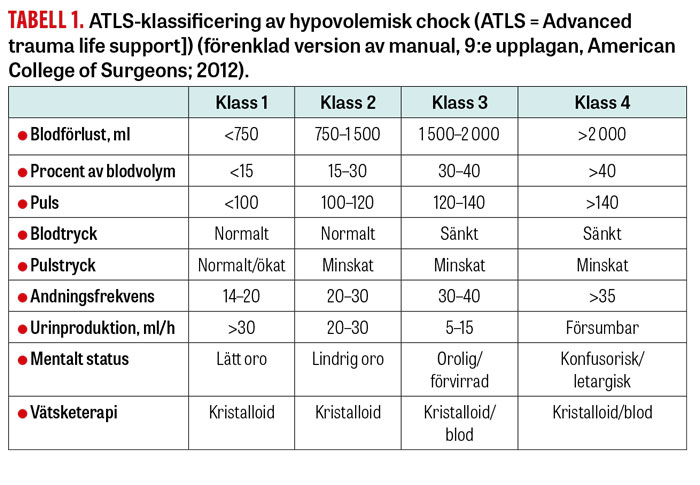
ATLS-klassificering (ATLS = Advanced trauma life support) av hypovolemisk chock vid blodförlust är ett strukturerat sätt att bedöma patientens fysiologiska status utifrån vitalparametrar. I en studie har förändringarna dock visat sig vara mindre påtagliga än vad som anges i ATLS, varför man inte bör stirra sig blind på dessa [8].
Det finns också andra specifika verktyg och skalor för att förutsäga risken för massiv transfusion. En av de mest validerade skalorna är TASH (Trauma associated severe hemorrhage), som bedömer sju olika faktorer och ger en riskvärdering med 84 procents sensitivitet och 78 procents specificitet för att massiv transfusion kommer att behövas [9].
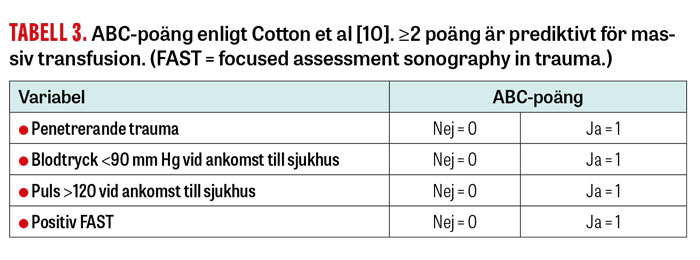
Ett annat förenklat men likväl validerat verktyg är ABC (Assessment of blood consumption) som tittar på färre parametrar, där varje utfall ger 1 poäng och ≥2 poäng är positivt test med 75 procents sensitivitet och 85 procents specificitet för massiv blödning [10].
Det finns flera definitioner i litteraturen av vad som räknas som massiv transfusion; en av de mest använda är om patienten erhåller ≥10 enheter erytrocytkoncentrat de första 24 timmarna efter det att skadan uppstått [11].
På senare år har försök till att få fram en mer prediktiv definition gjorts, bl a CAT (critical administration threshold), som definieras som ≥3 enheter erytrocytkoncentrat under en 60-minutersperiod [12]. De patienter som uppfyller CAT-kriterierna har dubbelt så hög mortalitetsrisk som de patienter som inte uppfyller kriterierna, den etablerade definitionen missar en del av dessa dödsfall. I takt med att mer plasma och trombocyter introduceras i resusciteringen blir de gamla definitionerna alltmer svårvärderade och kommer möjligen att förändras framöver.
Under senare år har införandet av s k massivt transfusionsprotokoll blivit alltmer populärt inom traumavården. Massivt transfusionsprotokoll har sina rötter i den amerikanska krigssjukvårdens erfarenheter från krigen i Irak och Afghanistan, och det innebär standardiserad behandling med blod och blodprodukter som efterliknar helblod [13]. Ofta har massivt transfusionsprotokoll aktiverats vid s k kritisk blödning, vilken definieras som transfusionsbehov >1 enhet erytrocytkoncentrat/10 kg kroppsvikt/timme.
Tanken med protokollet är att på ett standardiserat sätt ge blod, blodprodukter och faktorkoncentrat samt öka mängden plasma och trombocyter i förhållande till erytrocyter. Dessutom har man strävat efter att minska mängden kristalloida vätskor.
Behandlingsstrategi
Vid allvarlig blödning är tidsfaktorn och det initiala omhändertagandet av avgörande betydelse för prognosen liksom koagulationsrubbningens omfattning [14]. Tidig hemostaskontroll av yttre blödningar på skadeplats med t ex tourniquet eller blodstillande förband och snabb transport till skadekontrollerande kirurgi samt tidig resuscitering med blodprodukter utgör hörnstenarna i behandlingen av massiv blödning vid trauma.
Kristalloider används prehospitalt och inledningsvis på sjukhus, men syntetiska kolloider inverkar negativt på koagulationen och har inte längre någon plats i behandlingen. I möjligaste mån ska man undvika eller behandla den »dödliga triaden« hypotermi, acidos och koagulopati. Så fort definitiv blödningskontroll har uppnåtts bör man sträva efter försiktighet med blodprodukter för att minska risken för transfusionsrelaterade skador som multiorgansvikt, SIRS (systemiskt inflammatoriskt svarssyndrom [systemic inflammatory response syndrome]), TRALI (transfusionsrelaterad akut lungskada [transfusion related acute lung injury]), ökad infektionskänslighet och ökad mortalitet [15].
Ett sätt att mäta effekten av resuscitering är via laktat eller basunderskott. Det är sedan tidigare visat att laktat kan vara ett tidigt och objektivt värde på hur patienten svarar på behandling vid cirkulatorisk chock [16]. Ett laktatvärde som är fortsatt förhöjt trots åtgärder är associerat med ökad mortalitet och multiorgansvikt. Dock ger laktat ett mer osäkert mätvärde när alkohol är inblandat, eftersom alkohol i sig kan höja laktatnivåerna i blodet [17]. Eftersom alkohol relativt ofta förekommer i samband med svårt trauma, rekommenderas att parallellt följa basunderskott [18].
Traumatisk blödning hos barn
Barns koagulationssystem skiljer sig något från vuxna, och ju yngre barnet är, desto större är skillnaderna. Nyfödda barn har generellt lägre nivåer av koagulationsfaktorer, men dessa normaliseras successivt under första levnadsåret. Viskoelastisk mätning med tromboelastografi (TEG) eller tromboelastometri (ROTEM) är en beprövad metod hos barn och kan användas för att styra behandlingen.
Barn är mer känsliga än vuxna för att utveckla TRALI och TACO (transfusionsrelaterad cirkulatorisk överbelastning [transfusion associated cardiac overload]), varför man bör vara vaksam på att inte överresuscitera barn med blodprodukter [19].
Liksom hos vuxna skiljer sig definitionerna för massiv transfusion åt i litteraturen, men riktvärdet är >40 ml/kg kroppsvikt under 24 timmar, vilket utgör ungefär hälften av ett barns blodvolym, som är ca 80 ml/kg [20].
Om kunskap saknas på behandlande enhet, rekommenderas att kontakt tas med koagulationsjouren eller annan expertis innan behandling med faktorkoncentrat till barn påbörjas.
Provtagning
Vid massiv blödning efter trauma finns inte tid att invänta provsvar innan man måste påbörja behandling med blodprodukter och koagulationsfaktorer. Det kan ändå vara av värde att ta koagulationsprov, eftersom det kan komma att styra framtida behandling om koagulationsrubbningen kvarstår. Naturligtvis ska även blodgruppering och förenlighetsprövning (bastest) utföras.
För att vinna tid bör i första hand patientnära analyser väljas, och bestämning bör göras av fibrinogen, PK(INR), trombocytpartikelkoncentration (TPK) och APTT. Artärgasanalys bör göras fortlöpande för bestämning av Hb-, pH- och kalciumnivå.
Om det finns tillgänglig apparatur för viskoelastisk mätning (TEG/ROTEM) bör denna sannolikt användas, men dess roll i en klinisk situation vid trauma är fortfarande oklar [21, 22]. Upprepad provtagning är viktig för att följa förloppet.
Vätska och blodprodukter
Vanligen startas behandlingen av patienten prehospitalt med kristalloida vätskor. Att helt normalisera blodtrycket vid massiv blödning med chock riskerar att leda till utspädningskoagulopati med risk för ökad blödningsintensitet och förnyad blödning; ett alltför högt blodtryck anses också kunna lösgöra redan bildade koagler. Dessutom är vätskorna oftast kalla, vilket leder till ökad risk för hypotermi.
På senare år har konceptet »permissive hypotension« vunnit mark, dvs kontrollerad resuscitering där man inte eftersträvar att normalisera blodtrycket utan i stället eftersträvar ett blodtryck kring 80–90 mm Hg systoliskt [2, 23, 24]. Vid traumatisk hjärnskada rekommenderas dock ett något högre blodtryck, >100 mm Hg systoliskt, för att säkerställa adekvat perfusion till hjärnan [19]. Hos den pediatriska populationen saknas tyvärr studier gällande detta koncept.
Vid behov av massiv transfusion rekommenderas att man i ett tidigt skede börjar resuscitera med erytrocytkoncentrat och plasma, men även att man ger trombocyter [25]. Proportionen mellan de olika blodprodukterna är dock fortfarande omdiskuterad; i randomiserade studier tycks ett förhållande av minst 2:1 (erytrocytkoncentrat:plasma) vara gynnsamt, men sannolikt finns vinster med ett förhållande nära 1:1 utan ökade risker för komplikationer [11]. I internationell litteratur rekommenderas att trombocyterna ges i förhållandet 1:1:1 (erytrocyter:plasma:trombocyter), vilket i Sverige motsvarar förhållandet 4:4:1 på grund av annorlunda förpackningsstorlek [26]. Således rekommenderas i Sverige att vid misstanke om massiv blödning bör resuscitering ske med erytrocytkoncentrat, plasma och trombocyter i förhållandet 4:2:1 till 4:4:1.
Erytrocyter bidrar till hemostas dels via reologisk påverkan (blodkropparnas rörelse i kärlet) som gör att trombocyterna når kärlväggen, dels genom kemisk påverkan på aktiverade trombocyter [27, 28]. Vilka gränsvärden som ska användas vid resuscitering för Hb och TPK är omdiskuterat. Enligt de senaste europeiska riktlinjerna bör man eftersträva ett Hb-värde >70–90 g/l, men det saknas välgjorda studier inom området. Svenska riktlinjer anger Hb >90 g/l som önskvärt målvärde, och erfarna kliniker rekommenderar att man vid kritisk blödning siktar på 100 g/l för att undvika att hamna för lågt i ett kritiskt initialskede [19]. Hb måste alltid relateras till patientens övriga hemodynamiska tillstånd.
Inte heller hos barn som är cirkulatoriskt stabila har man sett någon negativ påverkan med en Hb-gräns på 70 g/l [29]. Det har diskuterats huruvida Hb-gränsen bör vara högre för patienter med traumatisk hjärnskada, men sannolikt bör inte gränsen vara annorlunda för dessa patienter [30].
Trombocyternas roll vid traumatisk koagulopati är dåligt känd, och ingen absolut transfusionsgräns finns för traumapatienter; få traumapatienter uppvisar dessutom trombocytopeni initialt [31]. Dessutom är normal nivå ingen garanti för trombocyternas funktion. Enligt de europeiska riktlinjerna för traumatisk blödning bör trombocytnivån inte understiga 50 × 109/l hos en aktivt blödande patient. Man föreslår också en högre gräns (100 × 109/l) vid multitrauma, traumatisk hjärnskada och massiv blödning [2]. Det synes viktigare att få information om trombocyternas funktion än om deras antal.
Koagulationsfrämjande läkemedel
Tranexamsyra. Tranexamsyra är en syntetisk lysinanalog och verkar som fibrinolyshämmare, dvs förhindrar upplösning av koagler, något som sannolikt sker i ökad grad vid traumatisk koagulopati, s k hyperfibrinolys. Medlet har använts under lång tid inom kirurgin och anses ha få allvarliga biverkningar [32].
Amerikanska armén började tidigt studera effekterna av tranexamsyra vid skador i strid och kunde visa ökad överlevnad, särskilt hos de patienter som behövde massiv transfusion [33]. Tranexamsyra har också studerats vid civila trauman, och man har sett en klar överlevnadsvinst utan ökad trombosrisk [34].
Det tycks som om det finns fördelar med att ge tranexamsyra tidigt i skadeförloppet, helst inom 1 timme efter skadan eller, om detta inte är möjligt, senast 3 timmar efter det att skadan uppstått [35]. Dock finns tecken på att tranexamsyra given som första dos >3 timmar efter skadan faktiskt leder till ökad mortalitet, varför man inte rekommenderar att det ges om >3 timmar förflutit. Man kan, med den evidens som finns i dag, överväga om behandling med tranexamsyra bör införlivas i den prehospitala behandlingen. Den rekommenderade dosen är 2 g intravenöst initialt (inom 3 timmar); ytterligare 1–2 g kan ges 2–3 gånger per dygn, men dygnsdoser >40–60 mg/kg kroppsvikt bör undvikas [19].
Studier pågår av tranexamsyra till patienter med traumatiska hjärnskador [36].
Hos barn är det vetenskapliga underlaget för civilt bruk av tranexamsyra minimalt, men Royal College of Paediatrics and Child Health i Storbritannien rekommenderar 1 g initialt följt av infusion av ytterligare 1 g över 8 timmar för barn över 12 år. För yngre barn rekommenderas 15 mg/kg kroppsvikt (maxdos 1 g) följt av infusion med 2 mg/kg/timme i minst 8 timmar eller till dess blödningen avstannar [37, 38].
Joniserat (fritt) kalcium. Joniserat (fritt) kalcium är en viktig del av koagulationskaskaden och medverkar i bildningen och stabiliseringen av fibrin. Mängden fritt kalcium i blodet påverkas av bl a pH-värde och albuminnivåer. Man har kunnat påvisa en korrelation mellan hypokalcemi och ökad mortalitet; dock finns i dag ingen evidens för att korrigering av hypokalcemi leder till någon överlevnadsvinst, men det får antas biologiskt rimligt att kalcium bör finnas i adekvata nivåer för en god hemostas [39].
Man bör sannolikt sträva efter normala nivåer av fritt kalcium i blodet (>1,1 mmol/l) men åtminstone hålla nivån >1 mmol/l. Kalcium (kalciumglukonat) kan ges i doser om 90 mg outspätt intravenöst cirka var 5:e minut. Man bör observera att erytrocytkoncentrat innehåller citrat, som binder fritt kalcium. I en normal situation metaboliseras citrat snabbt i levern, men vid massiv transfusion kan detta få signifikant negativ inverkan på kalciumnivån.
Fibrinogen. Fibrinogen utgör en väsentlig del av koagulationen, eftersom det med hjälp av trombin omvandlas till fibrin, och fibrinogen är den koagulationsfaktor som snabbast minskar vid massiv transfusion [40]. Det saknas bra studier på området, men dagens svenska och europeiska rekommendationer är att initialt behandla med fibrinogenkoncentrat 2–4 g (30–40 mg/kg kroppsvikt). Ytterligare komplettering därefter bör styras utifrån klinik och bestämning av fibrinogen och/eller viskoelastisk mätning [19]. Fibrinogennivån bör vara >2 g/l. Studier av fibrinogens roll vid traumatisk blödning pågår [41].
Övriga koagulationsfaktorer. Övriga koagulationsfaktorer, kanske framför allt rekombinant faktor VIIa (rFVIIa), har diskuterats vid utebliven hemostas. Det är viktigt att tänka på att evidensen för tillförsel av koagulationsfaktorer är låg och att ett antal kliniska förutsättningar måste vara uppfyllda för att det ska ha en eventuell effekt. Detta gäller bl a kirurgisk hemostaskontroll, dvs stora blödningar måste vara under kirurgisk kontroll; rFVIIa har endast effekt vid diffus koagulopatisk blödning.
Adekvat behandling med erytrocyter, plasma, trombocyter och fibrinogen måste ha givits, eftersom rFVIIa verkar på patientens eget koagulationssystem; dessutom bör pH-värde och kroppstemperatur vara nära normala liksom kalciumnivåerna. Prediktorer för dålig respons på given rFVIIa har visats vara pH <7,2, TPK <100 × 109/l och systoliskt blodtryck <90 mm Hg [42]. I en multicenterstudie av rFVIIa vid stor traumatisk blödning påvisades visserligen ett måttligt minskat transfusionsbehov av erytrocyter, men någon överlevnadsvinst kunde inte visas [43].
Om rFVIIa används bör dosen vara 0,1 mg/kg avrundad till lämplig förpackningsstorlek. Andra läkemedel som kan komma på fråga är t ex faktor VIII och von Willebrand-faktor. Ovanstående läkemedel bör endast användas av läkare med erfarenhet eller i samråd med koagulationsjour.
Reversering av antikoagulantia
Den äldre populationen blir större och mängden trauma hos äldre kan därmed antas öka. Många av dessa patienter behandlas med antikoagulantia på grund av olika grundsjukdomar, och detta måste tas hänsyn till vid stor traumatisk blödning. Dessa patienter sköts med fördel i samråd med koagulationsjour om erfarenhet saknas. För direktverkande antikoagulantia (NOAK) har det fram till nyligen saknats effektiva antidoter, men forskning pågår [44] och nyss godkändes en antidot i Sverige mot dabigatran.
Sammanfattning
Stora traumatiska blödningar är ett relativt sällsynt tillstånd på de flesta akutmottagningar i Sverige. Dock måste alla sjukhus som tar emot patienter med trauma vara beredda på att kunna göra snabba och korrekta insatser för att öka chanserna till överlevnad. På senare år har införandet av massivt transfusionsprotokoll fått stor spridning inom traumaomhändertagandet. Protokollet har dock på senare år utmanats i litteraturen, där vissa förespråkar en mer individualiserad behandling med hjälp av patientnära analyser, framför allt viskoelastisk mätning, och där blodprodukter och koagulationsfaktorer ges efter behov i stället för efter protokoll [45, 46].
Det viktigaste är sannolikt att man har en plan för hur man ska hantera den massivt blödande traumapatienten och att man i tidigt skede överväger kirurgisk intervention, eventuellt med tillägg av endovaskulära tekniker.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.