I Sverige finns i dag omkring 1 200 anlagsbärare för akut porfyri.
De allvarliga kliniska manifestationerna kan utlösas av läkemedel. Förskrivning till anlagsbärarna kräver särskild omsorg och kunskap.
I en nyutgiven publikation har ca 1 300 läkemedel klassificerats beträffande risk vid akuta porfyrier.
Bedömningarna utgår från läkemedlens molekylära, farmakokinetiska och farmakodynamiska egenskaper och hur dessa påverkar mekanismerna i en vidareutvecklad molekylär modell för porfyriattacken. Den teoretiska riskbedömningen stäms av mot tillgängliga kliniska data.
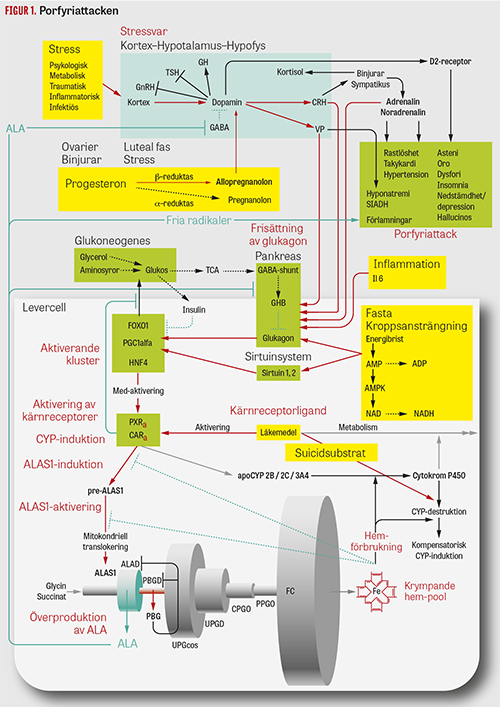
Figur 1. Porfyriattacken. Patogenetisk modell för identifiering av potentiellt porfyrogena effekter av läkemedel och av genomiska och metabola processer tänkbara som mål för intervention. Se vidare Fakta 1. Efter: Thunell S. Scand J Clin Lab Invest. 2000;60:509-40 [4].
I en av sina böcker om åren som lappmarksdoktor på 1920-talet och framåt berättar Einar Wallquist om sitt möte med den gåtfulla släktsjukan, en sjukdom som trotsade diagnos och som yttrade sig i attackvis påkommande svåra buksmärtor, humörsvängningar och förlamningar, och som följde vissa släkter i bygderna [1]. Lokalt kallades den rödsjukan därför att urinen var röd under attackerna. Om de drabbade vårdades hemma vek tillståndet oftast spontant, men de som hade upprepade anfall blev i det långa loppet invalidiserade och sängliggande. Togs de in på sjukhus under attacken avled de inte sällan i andningsförlamning eller kretsloppssvikt. Redan genom Wallquists initiala släktstudier stod det klart att det rörde sig om en ärftlig rubbning, senare identifierad som akut intermittent porfyri.
Dödsfallen under inläggning berodde oftast på att de oroliga patienterna regelmässigt ordinerades barbiturater som lugnande medel. Efter det att Jan Waldenström på 1930-talet pekat på sambandet mellan medicineringen och den akuta porfyriattacken, blev anlagsbärarnas känslighet för läkemedel uppmärksammad i sjukvården. Den första internationella förteckningen över riskläkemedel vid akuta porfyrier gjordes 1976 av Lennart Wetterberg. Han tog också initiativet till patientföreningen, Riksföreningen mot porfyrisjukdomar (RMP), som med sin kontaktyta effektivt kunde förmedla informationen till anlagsbärarna [2]. Sedan dess har Porfyricentrum Sverige, under sista decenniet i samarbete med docent Atle Brun och medarbetare vid Haukeland universitetssjukehus i Bergen, utökat mängden riskklassificerade preparat i takt med nyregistreringarna, och genom utveckling av metodiken även ökat kvaliteten i prediktionen.
Ny läkemedelslista
En ny lista över läkemedelsrisk vid akuta porfyrier har nyligen publicerats [Läkemedel vid akuta porfyrier och några råd till anlagsbärare. Stockholm: Riksföreningen mot porfyrisjukdomar; 2015]. Den omfattar ca 1 300 preparat registrerade i Sverige och beställs via föreningens hemsida (www.porfyri.se). De 110 sidorna innehåller också patientanpassad information om akut porfyri och mekanismerna bakom den akuta attacken, samt råd rörande bland annat egenmedicinering, livsstil, kosthållning, viktreduktion, preventivmedel och klimakterium. För läkaren finns mallar för behandling av porfyriattacken, kontroller av anlagsbäraren och vad som är att tänka på vid kirurgi och narkos.
Prediktionen av läkemedlens porfyrogenitet utgår från hur de fysiologiskt eller i sin metabolism påverkar metabola förlopp som mynnar ut i porfyriattacken, så som det kan härledas in silico ur deras farmakokinetik, farmakodynamik och sidoeffekter [3]. Spelplan för effekterna är en ny molekylär modell för mekanismerna (Figur 1).
De flesta bedömningarna publiceras tillsammans med farmakologisk och klinisk evidens också i databasen www.drugs-porphyria.org (NAPOS).
Porfyriattacken
Porfyriattacken är det kliniska uttrycket för mutationer i gener för enzym i den katalytiska kedja som svarar för biosyntesen av järnporfyrinet hem [4].
De tre autosomalt dominant nedärvda akuta porfyrierna akut intermittent porfyri (AIP), porfyria variegata (PV) och hereditär koproporfyri (HCP) skiljer sig sinsemellan när det gäller vilket av enzymen som primärt är drabbat. De neuropsykiatriska manifestationerna är dock desamma eftersom alla tre formerna primärt eller sekundärt medför sänkt aktivitet av ett redan konstitutionellt svagt enzym, porfobilinogendeaminas (PBGD). Den reducerade enzymaktiviteten gör anlagsbäraren känslig för varje agens som påskyndar bildningen av hem, därför att den åtföljande överbelastningen av PBGD ger upphov till proximal stas i syntesvägen med ansamling av porfyrinförstadierna porfobilinogen (PBG), som ger röd urin, och 5-aminolevulinsyra (ALA) som utlöser de kliniska manifestationerna.
Antalet registrerade anlagsbärare i Sverige är i storleksordningen 1 200, fördelade över alla län i landet. Mörkertalet är troligen litet och AIP dominerar stort med drygt tusentalet individer.
Leverns roll
Levern är motor i porfyriattacken, substanser som levercellen metaboliserar är bränsle i förloppet, medan nervsystemet utgör målorgan för den toxiska metabolit som bildas.
För avgiftningen av fettlösliga endogena och exogena substanser producerar levern stora mängder hemberoende cytokrom P450 (CYP)-enzym [5]. Biosyntesen av hem för ändamålet (Figur 1) drivs av enzymet 5-aminolevulinatsyntas (ALAS1). Det är aktivt i mitokondrierna där det kondenserar utgångssubstanserna glycin och bärnstenssyra till det första porfyrinförstadiet ALA. Aktiviteten av ALAS1 beror i varje läge på levercellens tillgång till fritt hem. Så länge tillräckligt finns för att mätta nybildat CYP-protein, är aktiviteten blockerad genom att pre-enzymet som transkriberats samtidigt med CYP-proteinet hålls utanför mitokondrierna av cellens fria hem [6].
En för anlagsbäraren riskabel ALAS1-produktion startar när levern svarar på toxisk exponering med att nybilda cytokrom P450. Under sammansättningen av det aktiva CYP-enzymet uppstår ett sug efter hem som den enzymsvaga biosynteskedjan till slut inte förmår tillgodose. När cellens pool av tillgängligt hem är tömd upphör blockaden för translokation av pre-ALAS1 till mitokondrierna. Från detta ögonblick ökar risken för porfyrogen acceleration av hembiosyntesen (Figur 1).
Aktivering av xenobiotiska kärnreceptorer
Ett läkemedel utlöser porfyriattacken genom att som ligand aktivera den ena eller båda av leverns xenobiotiska kärnreceptorer, PXR (pregnane xenobiotic receptor) och CAR (constitutive androstane receptor). Dessa DNA-proteiner i cellkärnan reagerar på vissa steroider och fettlösliga kroppsfrämmande substanser med att utlösa nybildning av specifika CYP-enzymer för metabolismen [7].
Aktiveringsfickorna för PXR och CAR utmärks av ovanligt stor plasticitet och medger tillträde för substanser av mycket varierande storlek, även om makromolekyler och polymera föreningar inte får plats. Kärnreceptorerna aktiveras porfyrogent av terapeutiska koncentrationer av hundratalet för närvarande registrerade läkemedel.
Porfyrogeniteten hos ett läkemedel beror av hur mycket, och vilken typ av cytokrom P450 som nybildas. Vanligast och kraftigast – och därför av störst betydelse vid akut porfyri – induceras enzymer av klasserna CYP2C och CYP3A4 [3]. Koncentrationen av läkemedlet och graden av fettlöslighet bestämmer affiniteten till kärnreceptorn och därmed vilken exponering som krävs för signifikant CYP-induktion. Acetylen-, amin- och vissa heterocykliska funktioner i strukturen är markörer för kapacitet hos läkemedlet att förstöra det cytokrom P450 som engageras för dess oxidativa metabolism. De förvandlar substansen till ett suicidsubstrat för enzymet och gör det porfyrogent genom den kompensatoriska CYP-nybildning med tillhörande ALAS1-induktion som dess destruktion utlöser.
Aktivering av PGC-1-alfa
Erfarenheten visar att anlagsbärarens sårbarhet för porfyrogena agens ökar under stress eller när cellernas energinivåer sjunker vid fasta eller kroppsansträngning. Bedömningen av läkemedlets risk för porfyrogen CYP-induktion omfattar därför eventuella effekter på de molekylära mekanismer som aktiveras vid dessa tillstånd, och som propageras inom nätverk av transkriptionsfaktorer, aktivatorer och hämmare med effekter som möjliggör och förstärker aktiveringen av PXR eller CAR [8].
Inbindningen till den xenobiotiska receptorn av en tillräckligt potent ligand bäddar för porfyriattacken, men förloppet startar först efter aktivering av en central faktor som behövs för uppregleringen av generna för ALAS1 och CYP-proteinet, det vill säga PGC-1-alfa (peroxisome proliferator-activated receptor-gamma coactivator-1-alpha) [9]. Denna centrala medaktivator ingår i ett kluster tillsammans med transkriptionsfaktorerna FOXO1 och HNF4, vilket under fasta ökar tillgången på energi genom att aktivera nyckelenzymen i cellernas mekanism för nybildning av glukos, det vill säga glukoneogenes [10]. Vid behov av CYP-kapacitet för avgiftning riktas emellertid klustrets aktivitet i stället till medaktivering av ligandaktiverad PXR eller CAR [11].
Aktiveringen av PGC-1-alfa är en följd av att det blodsockerhöjande hormonet glukagon har frisatts från pankreas alfaceller [12]. Detta inträffar också när sjunkande energinivåer i cellerna leder till att sirtuiner, enzymer som generellt styr uppreglering av gener, engageras i glukoneogenes [13]. Ghrelin genererat under fasta, liksom alla andra former av stress, har samma effekt genom att öka frisättningen av dopamin i mellanhjärnan [14].
Som följd aktiveras hypotalamus–hypofys–binjureaxeln, där de dominerande peptidhormonen kortikotropinfrisättande hormon och vasopressin aktiverar det sympatikotona systemet och startar glukagonsignalering från pankreas [15].
Normalt inhiberas alfacellernas frisättning av glukagon av gammahydroxismörsyra (GHB), som produceras i betacellen via en förlängning av GABA-shunten [16]. Vid energibrist avtar hämningen från GHB i takt med TCA (trikarboxylsyra)-cykelns sjunkande aktivitet och minskar ytterligare vid stigande blodhalter av ALA, som genom stukturlikhet inhiberar GABA och därmed GHB-produktion.
Vid porfyriattacker med skada på blod–hjärnbarriären exponeras hjärnan för systemisk ALA [17], som genom att inhibera GABA-dämpningen av mellanhjärnans dopaminerga signalering förstärker stressreaktionen och därmed attackens progression.
Progesterons porfyrogenitet
Ovarialhormonet progesteron bildas också i binjurarna och centrala nervsystemet. Vid hormonets reduktiva deaktivering bildas ett metabolitpar, pregnanolon och allopregnanolon, vilka på sinsemellan motsatt sätt modulerar GABA-signaleringen och därmed det dopaminerga trycket på hypotalamus [18].
Halterna av de två metaboliterna och deras inbördes proportioner bestämmer de fysiologiska effekterna. Vissa konstellationer reproducerar det porfyrogena, dopaminstyrda cerebrala, metabola och autonoma reaktionsmönstret vid stress. Styrkan i reaktionen, och dess inriktning, varierar mellan personer beroende på skillnader i individuell känslighet hos de receptorer som engageras av respektive metabolit.
Anlagsbäraren för akut intermittent porfyri är specifikt utsatt för denna mekanism. Av oklar anledning är ytterligare en enzymbrist kopplad till rubbningen [19], vilken missgynnar bildningen av den ena av metaboliterna och därmed förändrar balansen mellan de två molekylslagen med förstärkt dopaminerg tonus som följd. Under faser av ökad omsättning av hormonet ökar risken för att stressreaktionen bryter igenom och manifesterar sig i den akuta porfyriattacken (Figur 1).
Modellen förklarar varför porfyriattacker inte uppträder före puberteten, varför kvinnor drabbas oftare och allvarligare än män och är speciellt känsliga under den premenstruella progesteronfasen samt varför läkemedel som innehåller progesteron utlöser porfyriattacker. Symtomatologin under attacken är adrenerg, och de typiska mentala manifestationerna dysfori, irritabilitet, ängslan och depression är identiska med dem som kan drabba kvinnor premenstruellt, när den metabolt gynnade av de två metaboliterna, allopregnanolon, dominerar systemiskt [18].
Klinisk och farmakologisk evidens
In silico-bedömningarna av läkemedlen valideras med hjälp av kliniska iakttagelser där sådana finns rapporterade. Eftersom tillförlitligheten av dessa är begränsad [20] krävs ett flertal rapporter för att med rimlig sannolikhet få bekräftat att ett läkemedel är porfyrogent, och ett relativt stort antal för att frikänna ett läkemedel från att vara förknippat med en sådan risk [3]. Vid ett tillräckligt antal tillförlitliga rapporter visar sig den in silico-underbyggda förutsägelsen överensstämma med de kliniska observationerna. Metoden har dock principiella osäkerhetsmoment som vi med hjälp av relativiserade svarsrutiner dämpar genomslaget av.
Sammanfattningsvis har förändringar när det gäller stress och livsstil förmodligen ökat exponeringen för porfyrogen påverkan genom åren. Morbiditeten har trots detta gått ner på grund av att anlagsbärarna fått ökad kunskap om sjukdomens mekanismer och om utlösande agens.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Läs även: Författarintervju med Stig Thunell
Fakta 1. Porfyriattacken (se Figur 1)
Hos en anlagsbärare av akut porfyri är porfyriattacken följden av överproduktion av neurotoxisk effektor, 5-aminolevulinsyra (ALA), utlöst av endogent eller kroppsfrämmande stimulus, närd av ett hormonellt styrt nätverk av interagerande gener och transkriptionsfaktorer och drabbande den genetiskt specifikt känsliga anlagsbäraren för akut porfyri.
Överproduktion av ALA är en följd av induktion av cytokrom P450 (CYP). Nybildning av CYP är resultatet av aktivering dels av genen för enzymproteinet i fråga, dels av genen för enzymet ALAS1, vilken initierar syntesen av porfyrin för enzymets aktiva grupp hem. Accelererar trafiken genom enzymkedjan mot hem ökar risken för att det försvagade enzymsteget PBGD överbelastas. Stasen i syntesvägen leder till överproduktion av porfyrinförstadierna PBG och ALA som då uppträder systemiskt i ökade mängder. Bildningen av hem sker under feedbackkontroll. Storleken av levercellens fria hempool styr hastigheten i syntesen genom att styra aktiveringen av ALAS1.
Induktion av CYP initieras av ligandaktiverade kärnreceptorer, PXR och CAR. Via aktivering av kärnreceptorerna PXR eller CAR startar ett hundratal fettlösliga läkemedel nybildning av CYP för sin oxidativa metabolism. I egenskap av suicidsubstrat orsakar några kompensatorisk CYP-induktion genom att förstöra enzymet.
Glukagon förstärker aktiveringen av PXR och CAR genom bildning av ett kluster transkriptionsfaktorer. Sänkt energiproduktion i TCA-cykeln vid hypoglykemi minskar betacellernas bildning av GHB som normalt hämmar alfacellernas frisättning av glukagon i pankreas.
Frisättningen av glukagon aktiverar den centrala transkriptionsfaktorn PGC-1-alfa, som i sin tur aktiverar HNF4. Inhiberad insulinaktivitet under hypoglykemi aktiverar FOXO1 som tillsammans med PGC-1-alfa och HN4 bildar ett kluster som initierar glukoneogenesen.
Avgiftning har prioritet framför energibalans. Nybildningen av glukos som aktiveras av PXR eller CAR är blockerad under behandling med läkemedel som aktiverar kärnreceptorerna. Den induktiva kraften hos det glukagonaktiverade FOXO1–PGC-1-alfa–HNF4-klustret koncentreras i stället på porfyrogen CYP-induktion.
Glukagon frisätts vid energibrist i cellerna. Vid energibrist under fasta och hårdare muskelarbete stiger cellernas AMP/ATP-kvot, enzymet AMPK aktiveras och NAD/NADH-kvoten ökar. Dessa signaler aktiverar blodsockerhöjande frisättning av glukagon från pankreas och sirtuiner från vävnaderna.
Ökad dopaminerg tonus vid stress. Hot mot kroppens homeostas uppfattas och reläas av centrum i hjärnbarken som utlöser en avvärjande neuroendokrin, metabol och mental reaktion kontrollerad av dopamin. Stressreaktionen har komponenter som är aktiverade också vid olika psykiska störningar och som förklarar mentala symtom under porfyriattacken. [Gold PW. Mol Psychiatry. 2015;20:32.] [Brisch R, et al. Front Psychiatry. 2014;5:47.]
Kortikotropinfrisättande hormon och vasopressin dominerar vid stressreaktionen. Stressreaktionen domineras av dopaminaktiverad sekretion av peptidhormonen kortikotropinfrisättande hormon och vasopressin från hypotalamus, som hämmar hormonen som styr reproduktiv aktivitet, tyreoideafunktion och funktioner styrda av tillväxthormon.
Ökad utsöndring av vasopressin ger upphov till SIADH (inadekvat ADH-sekretion). Ökad frisättning av det natriuretiska hormonet vasopressin ligger bakom den allvarliga hyponatremi som kan uppträda under porfyriattacken.
Stress åtföljs av nyproduktion av glukos. Med understöd av vasopressin möter kortikotropinfrisättande hormon kroppens krav på energi vid stress genom att nybilda glukos. Glykogenolys och glukoneogenes startar efter aktivering av det sympatikomedullära systemet, vilket snabbt leder till omfattande adrenerg signalering, så småningom förstärkt av glukagon från pankreas.
CYP-inducerande läkemedel omdirigerar stressreaktionen till ALAS1-aktivering. När kärnreceptorerna PXR och CAR är aktiverade av CYP-inducerande läkemedel kopplas glukoneogenes bort och stressvaret koncentreras på att förstärka bildningen av detoxifierande CYP. För anlagsbäraren av akut porfyri innebär detta förstärkt aktivering av porfyrogen CYP-induktion.
Progesteron förstärker stressreaktionen. Ytterligare ett bristenzym hos anlagsbäraren för AIP, betareduktas, gynnar överproduktion av progesteronmetaboliten allopregnanolon som ökar nervsystemets dopaminerga tonus och beredskap för stressreaktion.
Genom sina effekter på vävnaderna aktiverar progesteron och andra progestiva hormoner CYP-beroende membranreceptorer, som fordrar tillgång på hem för sin verkan. Vid tillräckligt massiv progestiv exponering kan behovet av nysyntes av CYP ge upphov till porfyrogen ALAS1-induktion.
ALA är självgenererande. På grund av likhet i struktur kan ALA sannolikt fungera som GABA-hämmare. Föreningen blir självgenererande genom att i pankreas inhibera betacellernas produktion av glukagonhämmaren GHB och i hypotalamus hämma den normala GABA-dämpningen av dopamin. Neurotoxiska effekter fria radikaler av ALA kan förklara förlamningarna under porfyriattacken.