5-fluorouracil är ett viktigt cancerläkemedel som kan ge allvarliga biverkningar vid nedsatt aktivitet av dihydropyrimidindehydrogenas (DPD), som inaktiverar 5-fluorouracil.
Inför behandling med 5-fluorouracil rekommenderar den europeiska läkemedelsmyndigheten sedan 2020 screening för nedsatt DPD-aktivitet.
Analyser av genen för DPD, DPYD, vid Akademiska sjukhuset i Uppsala visar att genvarianter förenliga med nedsatt DPD-aktivitet hittades hos 8 procent av 368 cancerpatienter.
Vid nedsatt DPD-aktivitet tolererades dosreducerad behandling, medan 4 av de 5 patienter som inte fick reducerad dos, då analyssvar saknades före start, fick allvarliga biverkningar.
Kartläggningen stöder rekommendationen att testa för DPYD-genotyp eller DPD-aktivitet och visar att testen är kostnadsbesparande.
Drygt 50 år efter introduktionen i Sverige har 5-fluorouracil (5-FU) en central plats i kurativ och palliativ behandling av framför allt cancer i gastrointestinalkanalen, men även av till exempel huvud–halscancer och bröstcancer [1-3]. Det kan numera ges som en prekursor i tablettform, kapecitabin, som metaboliseras till 5-fluorouracil i lever och tumörceller [4, 5]. Fortfarande är dock 5-fluorouracil intravenöst, i kombination med reducerat folat som förstärker effekten, en vanlig behandlingsform. 5-fluorouracil kan kombineras med ett eller flera andra cancerläkemedel i effektförstärkande syfte [2]. Vanliga biverkningar till 5-fluorouracil och kapecitabin är mukosit, ofta manifesterad som diarré, men även leukopeni, dermatit, illmående och trötthet. Biverkningarna är vanligen lindriga till måttliga, men upp till 20 procent av de behandlade kan få svåra biverkningar, och dödsfall förekommer [2, 6].
Ca 80 procent av 5-fluorouracil inaktiveras i levern av enzymet dihydropyrimidindehydrogenas (DPD) [5]. Därför har normalt sett endast en liten del av den administrerade dosen en cytotoxisk effekt. Genen för DPD, DPYD, innehåller ibland genetiska varianter som medför sänkt enzymaktivitet, vilket leder till anrikning av cytotoxiska metaboliter till 5-fluorouracil [3]. Detta anses vara en huvudförklaring till att vissa patienter får allvarliga biverkningar [7, 8]. Ca 5–9 procent av västerländsk befolkning har någon av fyra kända DPYD-varianter som påverkar enzymaktiviteten (Tabell 1) [3, 4]. Bland 1 000 svenskfödda kontrollpersoner beräknas 6,5 procent ha någon av dessa varianter (Tabell 1) [9]. Respektive variant medför en viss aktivitetssänkning av DPD, och vanligen rekommenderas 50–75 procent av normal dos till en patient med en genvariant (Tabell 1) [3, 10]. Personer med två genvarianter som leder till avsaknad av DPD bör inte behandlas med 5-fluorouracil.
Mot denna bakgrund är det logiskt att kartlägga DPD-aktivitet med genetisk analys av DPYD och/eller funktionell analys av DPD-aktivitet inför start av behandling med 5-fluorouracil [4]. Retrospektiva studier har visat att DPYD-testning med åtföljande dosreduktion ger minskad risk för allvarlig biverkan och kan vara kostnadseffektiv [7, 11, 12]. DPYD-testning inför behandlingsstart har således föreslagits, men kritiserats för att ha låg precision och ge en falsk säkerhet avseende dosval och risk för underbehandling vid schablonmässig dosreduktion samt vidare för att funktionella test för DPD-aktivitet, såsom koncentrationsmätning i serum av uracil och/eller 5-fluorouracil, bättre predicerar biverkningar [4, 13-15].
I april 2020 utfärdade den europeiska läkemedelsmyndigheten EMA (European Medicines Agency) en rekommendation om att förebyggande testning, genetisk och/eller fenotypisk, av DPD-aktivitet bör införas [16]. Rekommendation nådde svensk sjukvård i juni 2020. Sektionen för onkologi vid Akademiska sjukhuset började redan i september 2018 med rutinmässig genetisk testning för de fyra vanligaste DPYD-varianterna inför behandling med 5-fluorouracil. Utifrån den nya rekommendationen fann vi det motiverat att rapportera vår erfarenhet av den förebyggande testningen avseende genomförbarhet och nytta.
Metod
Gentestning av DPYD. Testning för de fyra DPYD-varianterna (DPYD*2A, c.2846A>T, c.1679T>G (*13) och c.1236G>A) gjordes vid avdelningen för klinisk farmakologi, Akademiska sjukhuset, med realtids-PCR (Taqman SNP genotyping assay kit, Thermo Fisher Scientific) på DNA-preparerat från perifert blod. Tiden från mottaget prov till svar var vanligen högst 7 dagar. Blodprovet ordinerades i samband med remissgenomgång utifrån bedömning att patienten kunde bli aktuell för behandling baserad på 5-fluorouracil.
Insamling av kliniska data. DPYD-testade patienter identifierades via en testdatabas, varefter data extraherades ur elektroniska patientjournaler i Cosmic och fördes in i en studiedatabas i Excel. Detaljer om biverkningar insamlades från löpande journaltext och kategoriserades och graderades enligt CTCAE (Common terminology criteria for adverse events). Detaljer om given cytostatikabehandling inhämtades från IT-applikationen Cytodos. Perioden för datainsamling begränsades till de första 3 eller 4 behandlingscyklerna för 3 respektive 2 veckors cykellängd. Datainsamlingen gjordes inom ramen för ett examensarbete på läkarprogrammet efter sekretess- och etikbedömning av verksamhetsområdets chef och FoU-råd.
Kostnadsanalys. Kostnadsanalys gjordes med beaktande av priset för DPYD-testet, aktuell vårddygnskostnad samt utifrån premisserna från erhållna studiedata.
Datapresentation och statistisk analys. Data presenteras deskriptivt i tabellform. Statistiska skillnader mellan grupperna med och utan DPYD-variant beräknades med χ2-test eller, vid litet antal, Fishers exakta test. Ingen korrigering gjordes för multipla analyser.
Resultat
Från september 2018 till september 2020 DPYD-testades totalt 368 patienter. Testningen gjordes huvudsakligen på patienter med gastrointestinalcancer, varför den vanligast förekommande cancertypen var kolorektalcancer (n = 252), följd av pankreascancer (n = 40), gallvägscancer (n = 28), ventrikelcancer (n = 18) och esofaguscancer (n = 17). DPYD-varianter hittades hos 28 patienter (7,6 procent). Prevalens och fördelning av de olika varianterna överensstämde tämligen väl med publicerade internationella data (Tabell 1) [10]. Könsfördelning, ålder och cancerdiagnos var nästintill identisk mellan grupperna med normal DPYD-genotyp respektive DPYD-variant.
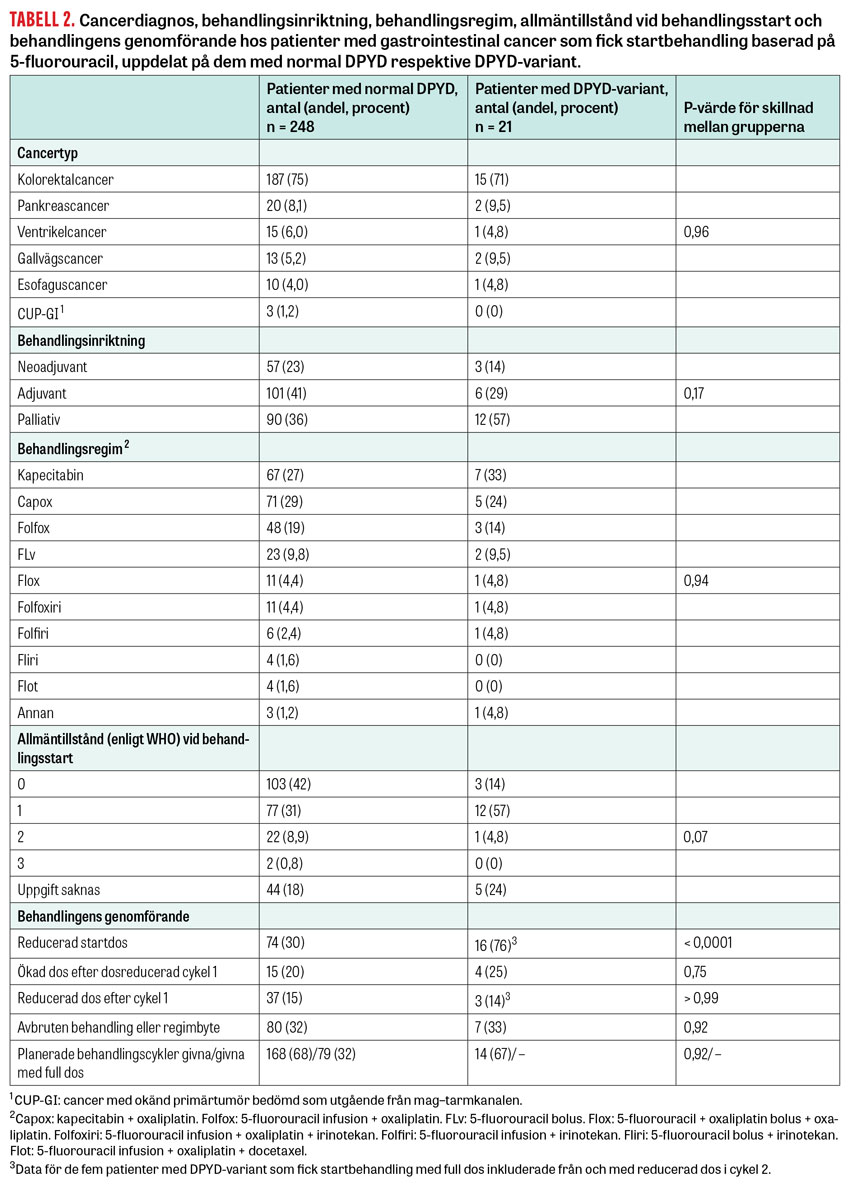
Hos 269 patienter med gastrointestinalcancer, 248 med normal DPYD och 21 med DPYD-variant, startades behandling baserad på 5-fluorouracil vid Akademiska sjukhuset eller lasarettet i Enköping, och de kunde följas upp avseende behandling och biverkningar. Patienter med DPYD-variant fick startbehandling med reducerad dos, vanligen 50 procent av standarddos, med undantag för 5 patienter för vilka testresultatet ännu inte förelåg inför behandlingsstart.
Cancertyper och behandlingskarakteristika skiljde sig inte signifikant mellan grupperna, men variantgruppen hade en högre andel patienter behandlade med palliativ inriktning och en lägre andel patienter med opåverkat allmäntillstånd vid behandlingsstart (Tabell 2). Reducerad startdos (< 85 procent av standarddos för respektive regim) och ytterligare reducerad dos, regimändring eller avbruten behandling var vanliga även i gruppen med normal DPYD-genotyp. Endast 32 procent av dessa patienter behandlades planenligt med full dos. Notabelt är att doshöjning efter en första dosreducerad behandlingscykel bara gjordes hos 20 och 25 procent i normal- respektive variantgruppen.
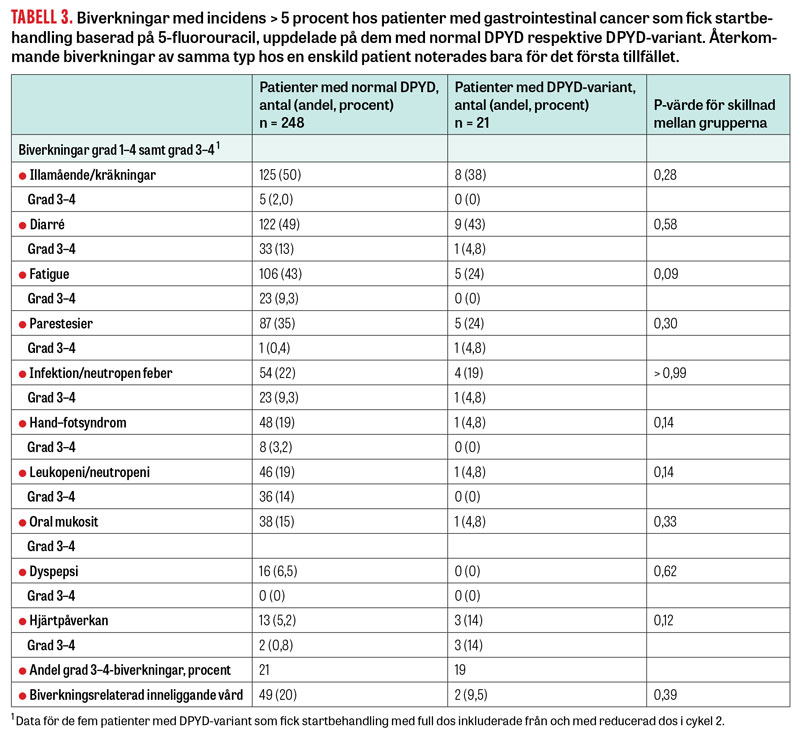
De vanligaste biverkningarna i båda grupperna var illamående/kräkningar, diarré och trötthet, vilket stämmer väl med känd biverkningsprofil för 5-fluorouracil (Tabell 3). Med undantag för hjärtbiverkningar var biverkningar något mindre vanligt förekommande i variantgruppen, dock inte statistiskt signifikant. Allvarliga biverkningar av grad 3–4 var lika vanliga i båda grupperna, men inneliggande vård för behandlingsbiverkan var dubbelt så vanlig i gruppen med normal DPYD jämfört med variantgruppen.
Hos 5 patienter med DPYD-variant startades behandling innan testresultat förelåg; detta i början av testningens införande då den senare väl fungerande testlogistiken ännu inte var fullt etablerad. Behandlingen inleddes därmed med standarddos. En av dessa patienter, adjuvant behandlad med kapecitabin, sökte akutmottagning för bröstsmärtor, men kunde återvända hem efter utredning med DT torax och ultraljud av hjärtat. Övriga 4 patienter fick samtliga biverkningar av grad 3–4 som föranledde inneliggande vård med en medelvårdtid på 4,5 dygn. Två patienter behandlade med 5-fluorouracil, irinotekan och folinsyra (Folfiri) respektive 5-fluorouracil, irinotekan, oxaliplatin och folinsyra (Folfoxiri) fick neutropen feber, diarré och illamående/kräkningar. Två patienter behandlade med kapecitabin respektive kapecitabin och oxaliplatin (Capox) fick bröstsmärta. Samtliga 5 patienter kunde återuppta sin behandling efter dosreduktion och hade under den fortsatta behandlingen inga eller bara lindriga biverkningar.
En kostnadsberäkning gjordes baserad på studieresultat samt kostnader för DPYD-testet och inneliggande vård. Vi utgick från ett scenario med 100 patienter som får startbehandling baserad på 5-fluorouracil utan eller med ett föregående DPYD-test (Tabell 4). Beräkningen indikerar att förebyggande testning ger en besparing på ca 280 000 kronor genom att inneliggande vård kan undvikas för majoriteten av patienter med DPYD-variant.
Diskussion
De fyra DPYD-varianterna förekom något oftare hos våra cancerpatienter jämfört med 1 000 svenskfödda kontrollpersoner: 7,6 respektive 6,5 procent [9]. Huruvida denna skillnad är slumpmässig eller uttryck för någon form av selektion är oklart. Standarddos av behandling baserad på 5-fluorouracil medförde påtagligt hög risk för allvarliga biverkningar hos patienter med nedsatt enzymaktivitet. Patienter med nedsatt enzymaktivitet som fick reducerad dos hade, till skillnad från i en tidigare liknande studie, något lindrigare biverkningsprofil jämfört med normalgruppen [7]. Förklaringen kan vara att den dosreduktion vi vanligen tillämpade (50 procent) var den mest konservativa och att försök till doshöjning efter den inledande behandlingscykeln var ovanliga.
Tendensen till lägre förekomst av biverkningar hos dem med nedsatt enzymaktivitet skulle också kunna indikera att denna grupp underbehandlades. Utfallet avseende effekt på cancersjukdomen var dock inte möjligt att se i denna studie. Den andel patienter som fick förhöjd dos efter den första behandlingscykeln, vilket enligt riktlinjer rekommenderas för bärare av DPYD-variant med god tolerans [3], var låg, och så var fallet även i gruppen med normal genotyp. Detta kan tolkas som att onkologer vanligen inte beaktar möjligheten till biverkningsstyrd individualiserad dosering med risk för otillräcklig behandlingseffekt hos vissa patienter.
Denna och liknande studier visar på nyttan med förebyggande testning av DPYD-varianter kopplade till nedsatt DPD-aktivitet. Samtidigt är det uppenbart att testningen av de fyra varianterna är otillräcklig då bara en minoritet, ca 20 procent, av patienter som får allvarlig biverkan fångas upp [4]. Testningen bör således utvecklas med testning av DPYD-varianter kombinerad med fenotypisk testning av DPD-aktivitet, till exempel genom mätning av uracil i serum, varvid testprestandan ökar [15]. Ett kompletterande steg för att optimera effekt och säkerhet vid behandling med 5-fluorouracil är så kallad terapeutisk dosmonitorering, som baseras på koncentrationsmätning av 5-fluorouracil i blodet, följd av individualiserad dosjustering för att nå ett terapeutiskt koncentrationsintervall [17, 18]. Kliniska studier visar att behandling med 5-fluorouracil styrd med terapeutisk dosmonitorering jämfört med behandling enligt rutin förbättrar såväl effekt som säkerhet [17, 18].
En styrka med denna studie är att den baseras på data från ett relativt stort antal patienter. Detta möjliggör rapportering av prevalensen av DPYD-varianter i en kohort av svenska cancerpatienter med hygglig precision. Vidare härrör data från rutinsjukvård, där behandling av patienter med DPYD-variant jämförts med patienter med normal DPYD behandlade vid samma sjukhus och under samma tidsperiod. Studiens externa validitet kan därför bedömas vara hög.
Den låga prevalensen av DPYD-varianter ger å andra sidan otillräcklig statistisk styrka för jämförelser mellan grupperna. Då biverkningar inte insamlats prospektivt enligt protokoll finns utrymme för subjektivitet och bristande precision. Vidare baseras kostnadsberäkningen på ett mycket litet antal observationer, och den beaktar inte heller andra kostnader kopplade till provtagning och biverkningar.
Sammantaget talar studieresultaten för att förebyggande DPYD-testning inför cancerbehandling baserad på 5-fluorouracil är genomförbar i ett svenskt sjukvårdsperspektiv och att den, förutom att vara etiskt välmotiverad, även kan vara kostnadsbesparande. Resultaten ger stöd åt den rekommendation om förebyggande DPYD-testning som nyligen utfärdats av EMA.
Läs även:
Författarintervju med Peter Nygren
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2021-10-12)