Transfusionsstrategi (patient blood management) innebär att optimera vården av patienter som skulle kunna behöva blodtransfusion.
I Sverige ges fler blodtransfusioner än i andra länder med jämförbar hälso- och sjukvård.
Stringenta transfusionsindikationer och uppföljning av transfusionspolicyer saknas i svensk sjukvård.
Preoperativ anemi och blodtransfusion är oberoende av varandra associerade med högre risk för komplikationer, morbiditet, mortalitet och längre vårdtider efter kirurgi.
Preoperativ anemi är associerad med ökat behov av blodtransfusion.
Preoperativ anemi ska diagnostiseras och om möjligt behandlas inför elektiva operationer.
En restriktiv hållning till transfusion ger inte sämre vårdresultat än en liberal hållning.
Blodtransfusion är en vanlig medicinsk behandling, men med stor variation i användning mellan länder, regioner, sjukhus och ordinerande läkare. Under det senaste decenniet har bristen på stringenta indikationer för blodtransfusion uppmärksammats. Jämförande randomiserade prospektiva studier av liberala och restriktiva transfusionsriktlinjer visar färre blodtransfusioner vid restriktiv policy och oftast ingen skillnad i morbiditet och mortalitet [1]. Liberal transfusionspolicy har ingen fördel, men ger potentiell risk för transfusionskomplikationer [2, 3].
Detta har medfört att proaktiva förhållningssätt för att minska behovet av blodtransfusion har identifierats, här benämnt »transfusionsstrategi« (patient blood management; PBM). Transfusionsstrategi definieras som ett evidensbaserat multidisciplinärt förhållningssätt med syfte att optimera vården av patienter som kan behöva blodtransfusion och inkluderar alla aspekter av bedömning och handläggning inför ordination av blodtransfusion. Det finns stöd för att anemi och blodtransfusion oberoende av varandra är associerade med ökad morbiditet och mortalitet [4, 5].
I en Cochrane-analys från 2016 inkluderades 31 randomiserade studier med 12 587 patienter från olika kliniska discipliner, där restriktiva och liberala transfusionspolicyer jämfördes. Konklusionen var att en mer restriktiv transfusionspolicy med hemoglobin (Hb)-gräns på 70–80 g/l var associerad med färre blodtransfusioner och utan sämre kliniska resultat än en högre Hb-gräns för transfusion [6]. Det är viktigt att poängtera att det inte är ett egenvärde att undvika blodtransfusion. Blodtransfusion på adekvata indikationer räddar liv och kan höja livskvaliteten vid anemi som inte kan behandlas på annat sätt. Det finns också ett visst stöd för att transfusionsgränsen för äldre och hjärtsjuka patienter bör vara högre [7].
Implementering av konceptet transfusionsstrategi rekommenderades av Världshälsoorganisationen (WHO) 2010, och EU-kommissionen har publicerat rekommendationer riktade till hälsomyndigheter och sjukhus [8, 9]. I dessa rapporter understryks att det är ett ansvar för vårdgivare som ger blodtransfusioner i sina organisationer att implementera evidensbaserade indikationer och arbeta efter bästa praxis.
Internationella erfarenheter
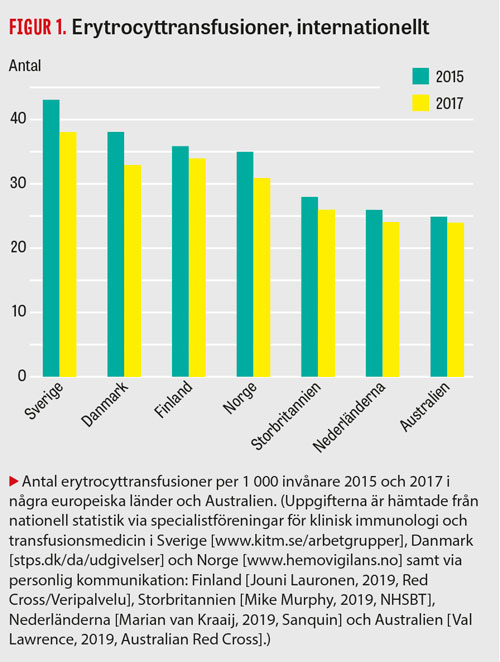
I Sverige ges fler erytrocyttransfusioner än i andra länder med jämförbar sjukvård (Figur 1). Australien har varit ett föregångsland när det gäller implementering av transfusionsstrategi. Australiens nationella blodorganisation tillsatte för 10 år sedan multidisciplinära arbetsgrupper, som har utarbetat riktlinjer för kritisk blödning/massiv transfusion, perioperativ anemi, invärtesmedicin, intensivvård, obstetrik och mödravård samt neonatologi och pediatrik [10].
I Storbritannien har den nationella blodorganisationen National Health Service Blood and Transplants (NHSBT) genomfört utbildningsinsatser. National Institute for Health and Care Excellence (NICE) har publicerat riktlinjer för blodtransfusion, och British Committee for Standards in Haematology (BCSH) har publicerat riktlinjer för diagnostik och behandling av preoperativ anemi [11, 12].
I Danmark har man tidigare givit mycket blod, men har genom utbildning och nationella riktlinjer [13] kunnat minska antalet erytrocyttransfusioner med nästan 50 procent, från 60 till 33/1 000 transfusioner under 2009–2018 (Dansk selskab for patientsikkerhed [http://stps.dk/da/udgivelser]).
Att ge blodtransfusion på korrekt indikation har betydelse för behandlingsresultat och påverkar vårdtider och kostnader i sjukvården [14, 15]. Under senare år har många studier publicerats på området transfusionsstrategi, framför allt perioperativ transfusionsstrategi, där det finns rutiner som kan förbättras [16]. Inför elektiva operationer anges prevalensen av preoperativ anemi till ca 30 procent, enligt WHO:s definition Hb <130 g/l för män och <120 g/l för kvinnor, och 36 procent i studier där anemi definierats som Hb <130 g/l för alla [17]. Prevalensen av preoperativ anemi och järnbrist är hög (30–60 procent) vid kolorektal cancer och inför gynekologiska operationer och lägre (10–20 procent) vid ortopediska operationer [17].
Inom elektiv kirurgi är det möjligt att på ett strukturerat sätt adaptera de »tre pelarna« i transfusionsstrategi (Figur 2):
- optimera patientens hemoglobinnivå
- identifiera och genomföra åtgärder som minskar blödningsrisken
- optimera patientens fysiologiska tolerans för anemi.
Relevant laboratoriestatus ska tas i god tid så att t ex järnbristanemi hinner korrigeras och ökad blödningsrisk identifieras och beaktas, och optimala anestesi- och kirurgimetoder ska erbjudas. Det finns internationella riktlinjer som delvis är implementerade i svensk sjukvård, men logistiska utmaningar kvarstår. Dessutom är rutinerna inte brett förankrade, vilket indikeras av stor variation i blodanvändning mellan regioner och sjukhus i Sverige (Figur 3).
I april 2018 hölls en konsensuskonferens i Frankfurt: »Towards evidence-based patient blood management«. Konferensen organiserades av International Society of Blood Transfusion (ISBT), American Society of Blood Banks (AABB), European Blood Alliance (EBA) och de tyska, franska och italienska föreningarna för transfusionsmedicin. Tre huvudteman analyserades – preoperativ anemi, transfusionsgränser och implementering av transfusionsstrategi – och litteratur granskades och evidensgraderades. Konferensen resulterade i 10 kliniska rekommendationer med varierande grad av evidens och ytterligare 12 forskningsrekommendationer där det saknas tillräcklig kunskap för att ge rekommendationer [18].
Svenska riktlinjer för behandling vid blödning efterfrågades tidigt, och på initiativ av Svenska sällskapet för trombos och hemostas (SSTH) utarbetades riktlinjer av en multidisciplinär arbetsgrupp. Riktlinjerna publicerades 2011, revideras regelbundet och är i dag väl implementerade [19].
Majoriteten av blodtransfusioner ges vid diagnoser inom hematologi, internmedicin och geriatrik, med varierande transfusionsgränser och ordinerad volym. Generellt rekommenderas en restriktiv policy [11, 13], men hänsyn ska naturligtvis tas till livskvalitetsvariabler gentemot potentiella negativa effekter av blodtransfusion.
Inom obstetrik ges mer än 80 procent av blodtransfusionerna som 1–2 enheter erytrocyter [opubl data], och det kan övervägas huruvida optimerad järnbehandling antenatalt och postnatalt skulle minska transfusionsbehovet [20]. Inom neonatologi och pediatrik varierar tranfusionspolicyn mycket, och även här rekommenderas internationellt restriktiva indikationer [21].
Hittills har transfusionsstrategi mest handlat om indikationer och riktlinjer för erytrocyttransfusion, men även användningen av plasma- och trombocyttransfusion varierar och bör utvärderas. I en nyligen publicerad randomiserad studie av trombocyttransfusion till prematura barn visades lägre mortalitet och färre blödningar vid transfusionsgräns TPK 25 × 109/l än vid 50 × 109/l [22].
Transfusionsstrategi vid hjärtkirurgi
Blödningskomplikationer är vanliga under och efter öppen hjärtkirurgi. Ungefär 5 procent av patienterna blöder så mycket att de behöver tas tillbaka till operationssalen för reexploration, och hälften behöver transfunderas med blodprodukter [23]. Det finns ofta flera faktorer som leder till blödningskomplikationerna, såväl det kirurgiska traumat och försämrad hemostas orsakad av hemodilution när hjärt–lungmaskinen ansluts som nedsatt trombocytantal och -funktion vid användning av hjärt–lungmaskin. Dessutom är det vanligt att patienterna behandlas med antikoagulantia och trombocythämmare före operationen, vilket också ökar blödningsrisken.
De europeiska specialistorganisationerna för toraxanestesi (EACTA) och toraxkirurgi (EACTS) publicerade 2018 gemensamma riktlinjer för transfusionsstrategi vid hjärtkirurgi [24]. I dessa finns behandlingsrekommendationer om bl a preoperativ hantering av antitrombotiska läkemedel, patienter med preoperativ anemi, kirurgiska metoder för att minska blödningsrisk, antikoagulation vid användning av hjärt–lungmaskin och extrakorporeal membranoxygenering (ECMO), transfusionspolicyer och användning av fibrinolyshämmare. Riktlinjerna är mycket detaljerade, och många av rekommendationerna är applicerbara även vid annan stor kirurgi.
Lokala initiativ med transfusionsstrategi vid hjärtkirurgi hade redan innan de europeiska riktlinjerna publicerades visat sig vara ett effektivt sätt att minska transfusioner av blodprodukter och kostnader för sjukvården, utan att öka riskerna för patienterna. På toraxkliniken på Sahlgrenska universitetssjukhuset i Göteborg genomfördes 2010 ett projekt för att minska antalet transfusioner [23]. Projektet innebar 1) utbildning av all personal på operation, intensivvård och vårdavdelning, 2) reviderade lokala behandlingsrekommendationer för transfusion och 3) att alla transfusioner bokfördes tillsammans med information om indikation för transfusionen, patientens status före transfusionen och vem som var förskrivande läkare. Dessa enkla förändringar minskade andelen patienter som transfunderades med erytrocyter med 22 procent, plasma med 37 procent och trombocyter med 21 procent utan någon påvisbar skillnad i morbiditet och mortalitet [22]. Besparingen av blodprodukter uppgick till minst 1,5 miljoner kronor under 1 år. Liknande projekt har genomförts i andra länder med god effekt [25-29].
Transfusionsstrategi inom ortopedi
I Sverige opereras årligen 16 000–17 000 patienter med primär höftprotes och ungefär lika många med knäprotes. Dessutom opereras ca 17 500 med osteoporosrelaterad höftfraktur.
Behandling med blodtransfusion inom ortopedisk kirurgi är vanligt. Vid operation med artroplastik i höft eller knä har blodtransfusion till 2–70 procent av patienterna rapporterats [30]. En stor variabilitet rapporteras mellan länder och sjukhus beroende av olika riktlinjer och/eller avsaknad av generella transfusionskriterier [31]. Med tanke på avsaknaden av gemensamma riktlinjer vid ortopedisk kirurgi i Sverige finns sannolikt stora skillnader i blodtransfusionsfrekvens mellan svenska sjukhus.
Preoperativ anemi är associerad med ökad mortalitet och morbiditet (infektioner, njurskada) vid kirurgi [32], och ökad risk för postoperativa komplikationer har bekräftats från artroplastikstudier [33]. Därför har en multidisciplinär panel bestående av experter från ortopedi, anestesi, hematologi och epidemiologi inom ramen för NATA (Network for the Advancement of Patient Blood Management, Haemostasis and Thrombosis) tagit fram en praktisk riktlinje [34]. Den första rekommendationen är att Hb-värdet ska kontrolleras hos ortopediska patienter inom 28 dagar före planerat ingrepp (grad 1C-evidens). Den andra rekommendationen är att fastställa normala Hb-värden enligt WHO-kriterier, >120 g/l för kvinnor och 130 g/l för män (grad 2C-evidens). Om Hb-värdet inte är normalt ska det utredas och normaliseras före elektiv operation.
Preoperativ anemi är associerad med ökad risk för blodtransfusion vid knä- och höftplastik [35], och blodtransfusion i sig är associerad med ökad risk för postoperativ infektion [36].
I flera studier har man försökt ange gränsvärden för blodtransfusion. I en systematisk genomgång av 9 randomiserade studier anges ett tröskelvärde på Hb <80 g/l för att transfundera. Det finns ett måttligt stöd för att detta restriktiva förfaringssätt ger färre infektioner postoperativt vid höft- och knäplastik och höftfrakturoperationer utan att andra komplikationer ökar [37].
Det finns goda exempel i Sverige där man använt lokala standardiserade protokoll, vilket minskat såväl antalet intraoperativa blödningar som antalet blodtransfusioner [30].
Transfusionsstrategi vid kolorektal kirurgi
Anemi är vanligt vid diagnos av kolorektal cancer och vanligare vid koloncancer än rektalcancer [38, 39]. I de nationella riktlinjerna för kolorektal cancer saknas riktlinjer för hur anemin bör behandlas [40]. I de nationella registren för koloncancer och rektalcancer registreras blodförlust under operation, men inte anemi eller om patienten har fått blodtransfusion. Av 496 patienter som opererades för kolorektal cancer i stadium I–III på Karolinska universitetssjukhuset i Stockholm 2007–2010 hade 52 procent anemi [41]. Anemi var associerad med högre ASA-klass (American Society of Anaesthesiologists) och tumörstadium (djupväxt i tarmväggen) och med sämre total överlevnad. Något signifikant samband sågs emellertid inte mellan preoperativ anemi och risk för recidiv [41].
Patienter med preoperativ anemi fick oftare blodtransfusion i samband med operation (inom 1 dygn) (58 procent) än patienter utan anemi (21 procent) [41].
Den perioperativa transfusionsstrategin innebär i praktiken en strävan efter en Hb-koncentration på >80 g/l. Orsaken till detta är att den perioperativa blödningen i kombination med spädningseffekten av kristalloida vätskor annars lätt ger en Hb-koncentration under önskad nivå. En stor del av de patienter som genomgår kolorektal kirurgi på Karolinska universitetssjukhuset har samsjuklighet i form av hjärt-, lung- och njursjukdom, och för denna grupp är det extra viktigt att inte hamna i ett läge utan marginaler för Hb-värdet [42]. Vid pågående stor blödning följs protokollet för massiv transfusion.
Direkt postoperativt finns oftast ingen anledning att transfundera patienter med Hb-koncentration >70 g/l och stabil hemodynamik [43].
Oral järnbehandling är inte något bra alternativ för patienter med bukproblem som ska opereras inom några veckor. Nu ökar intresset för att ge patienter med kolorektal cancer och anemi intravenöst järn före operation, eftersom det ger snabbare effekt och färre gastrointestinala biverkningar. Vid tidpunkten för studien på Karolinska universitetssjukhuset gavs inte intravenöst järn till patienter med kolorektal cancer och anemi [41].
Järnsubstitution vid perioperativ anemi
Anemi är vanligt hos patienter som ska opereras. Det är angeläget att anemin, oavsett bakomliggande operationsorsak, påvisas och karakteriseras i god tid före operationen och att behandling inleds.
Den vanligaste anemiorsaken är järnbrist, oftast i kombination med inflammationsrelaterad järnbrist förorsakad av hepcidinpåslag, med åtföljande blockering av frisättningen av järn från depåerna och minskat upptag från tarmen. Järn är essentiellt för cellulär syretransport, oxidativ metabolism och energiproduktion och är dessutom involverat i erytropoesen.
Diagnosen järnbrist baseras främst på ferritin, transferrinmättnad och CRP. Ferritin <30 μg/l indikerar alltid järnbrist liksom transferrinmättnad <16 procent. Vid samtidig inflammation (CRP-stegring) kan ferritinnivåer upp till 300 μg/l i kombination med transferrinmättnad <20 procent fortfarande vara förenliga med absolut järnbrist. Vid tveksamhet kan diagnostiken skärpas med analys av löslig transferrinreceptor alternativt andel hypokromatiska erytrocyter eller hemoglobinhalt i retikulocyter.
Peroral behandling är sällan tillräcklig för att hinna korrigera järnbrist preoperativt. Peroral behandling är också oftast olämplig på grund av gastrointestinala biverkningar och inflammatoriskt betingad blockad av järnupptag från tarmen. I stället erbjuder intravenös järntillförsel snabb och effektiv behandling. Moderna intravenösa järnpreparat är väldokumenterade och säkra under förutsättning att tillförseln inte sker alltför snabbt [44]. Dessa preparat bör undvikas under pågående kliniskt signifikant infektion tills infektionen är under kontroll. Den rapporterade frekvensen av svåra överkänslighetsreaktioner i biverkningsregister är för järnkarboximaltos 0,3–0,5/100 000 definierade dagliga doser om 100 mg och för järnisomaltosid något högre: 2,4–5,0 [45]. Publicerade data från randomiserade prospektiva studier saknas dock.
Hypofosfatemi är en nyligen uppmärksammad biverkan av intravenösa järnpreparat, med en högre risk associerad med järnkarboximaltos än med järnisomaltosid [46]. Låga serumfosfatnivåer (<0,6 mmol/l) betingade av renala förluster uppträder mest uttalat ca 2 veckor efter given dos och kan innebära konsekvenser för både respiration, muskelfunktion och cirkulation. Hypofosfatemi är svårbehandlad eftersom såväl peroral som intravenös tillförsel av fosfat snabbt elimineras via njurarna. Det är således viktigt att monitorera fosfat i serum preoperativt i samband med intravenös järnbehandling, även om den kliniska signifikansen inte är klarlagd. Låga nivåer av serumfosfat kan dessutom kvarstå längre tid än 2 veckor.
Intravenös järnbehandling ges i doser om 1–1,5 gram beroende på grad av anemi, vikt och samtidig inflammation. Tömda järndepåer hos en vuxen utan anemi innebär ett järndeficit på 1 gram. Vid samtidig anemi och inflammation kan det totala järnbehovet uppgå till 3 gram eller mer. När det beräknade järnbehovet tillförts bör behandlingen följas upp med analys av Hb och ferritin, optimalt efter ca 3 veckor, innan behov av ytterligare järn bedöms. I de perioperativa situationerna föreligger liten risk för överdosering, däremot är underdosering vanlig. Postoperativt är det viktigt att följa upp Hb-värde och järnstatus med normalt Hb-värde och återfyllda järndepåer (ferritin >100 μg/l) som mål, vid behov efter kompletterande behandling.
Målsättning och rekommendationer
Sannolikt ges ibland blod på tveksamma indikationer med potentiellt negativ effekt och risk för transfusionskomplikationer. Det finns också stöd för att överbehandling med blodtransfusion är associerad med ökade kostnader i sjukvården. Det är en stor utmaning att ändra traditioner och rutiner. Uppdaterade nationella och/eller lokala riktlinjer för behandling med blodtransfusion vid olika indikationer bör utformas, implementeras och regelbundet följas upp.
På uppdrag av Svenska blodalliansen bildades 2017 en svensk transfusionsstrategigrupp som består av representanter från transfusionsmedicin vid universitets- och regionsjukhus, med syfte att samarbeta med kliniker lokalt i utformning av transfusionsriktlinjer (www.sweba.se).
Potentiella bindningar eller jävsförhållanden: Stefan Lindgren har erhållit ersättning från Vifor Pharma och Pharmacosmos för deltagande i rådgivande kommitté; Agneta Wikman har erhållit föreläsningsarvode från CSL Behring och Octapharma; Anders Jeppsson har erhållit föreläsningsarvode från CSL Behring, Octapharma och LFB; Monika Egenvall har erhållit föreläsningsarvode från Ferring och ersättning från Medtronic för deltagande i rådgivande kommitté; Jan van der Linden har erhållit föreläsningsarvode från Nordic Pharma. (Vifor Pharma och Pharmacosmos har de två intravenösa järnpreparat som är godkända i Sverige, övriga företag har inget med den aktuella artikeln att göra.)