Trousseaus syndrom är en kombination av cancer och hyperkoagulabilitet och anses vara en kronisk disseminerad intravasal koagulation, som leder till venös tromboembolism och artärtrombos.
Vid stroke presenteras tillståndet vanligen med multipla bilaterala ischemiska hjärnlesioner både supra- och infratentoriellt.
Trousseaus syndrom uppträder oftast hos patienter med lung-, pankreas-, bröst- och koloncancer, oftast mucinproducerande.
Syndromet uppträder oftast inom 30 dagar efter cancerdiagnosen vid lokalt avancerad cancer eller senare vid metastaserad cancer.
Oavsett vilken underliggande mekanism som framkallar stroke vid Trousseaus syndrom är den primära åtgärden att avlägsna tumören.
Standardbehandling är lågmolekylärt heparin. Direktverkande orala antikoagulantia (NOAK) har hittills inte visat bättre effekt, men ytterligare studier krävs.
Trousseaus syndrom är en kombination av cancer och hyperkoagulabilitet, först beskrivet 1865 av den franske läkaren Armand Trousseau [1]. Hundra år senare rapporterades att Trousseaus syndrom är ett tillstånd av kronisk disseminerad intravasal koagulation, som leder till venös tromboembolism och artärtrombos hos cancerpatienter [2]. Vid Trousseaus syndrom är trombbildning resultatet av hemostasaktivering med olika mekanismer [3]. Patienter med cancer kan drabbas av stroke med eller utan sedvanliga strokemekanismer (Fakta 1) [4]. Kardioembolisk stroke är den vanligaste typen hos patienter med malignitet, delvis på grund av cancerrelaterad hyperkoagulabilitet [5].
Lämplig behandling av stroke hos patienter med cancer kräver förståelse av patogenetiska mekanismer och kliniska och radiologiska tecken, och detta är förutsättningen för val av korrekt behandling.
Fallbeskrivning
Patienten var en 61-årig man, rökare sedan ungdomen, nykter alkoholist med anamnes på upprepade pankreatiter, diabetes, depression och lungcancer av skivepiteltyp, som tidigare strål- och cytostatikabehandlats och som varit recidivfri i ungefär 9 år.
Patienten sökte på hälsocentralen på grund av nytillkommen svullnad i höger underarm. D-dimer visade förhöjt värde på 6,31 mg/l (referensvärde <0,50 mg/l), varför patienten remitterades för ultraljudsundersökning av armen, vilken dock gav negativt resultat. Hans allmäntillstånd hade försämrats under den senaste månaden med tilltagande trötthet, nedsatt aptit och viktnedgång. Han hade svårt att röra sig i hemmet utan rullator och hade tilltagande smärta i höger ben.
Datortomografi (DT) av torax visade en 2,5 cm stor tumör i vänster underlob med lymfkörtelmetastaser i vänster hilus och supraklavikulärt till höger. Han hade en palpabel knöl i bröstet på höger sida, vilken visade sig vara malign på mammografiundersökning. Komplettering med DT-buk visade inga metastaser. DT-ledd punktion av lungförändringen visade lungadenokarcinom.
Vid mottagningsbesöket uppgav han sig ha huvudvärk, yrsel, synbesvär och smärtor i höger axel och höger höft.
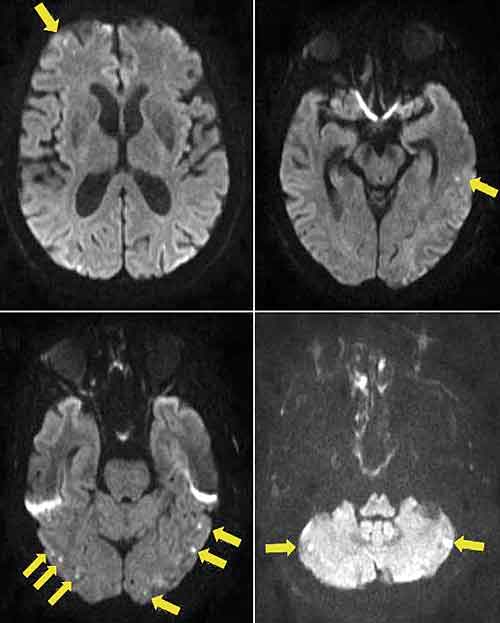
Undersökning med magnetkamera (MR) av hjärna, bäcken/höftled och axelled visade spridd sjukdom med metastaser i höger glenoid, i övre delen av bäckenet på båda sidorna, förutom i hjärnan där flera bilaterala akuta och även enstaka subakuta infarkter visades både infra- och supratentoriellt. De flesta infarkterna fanns i båda lillhjärnshemisfärerna, occipitalt och parietalt, enstaka frontoparietalt höger och frontalt vänster samt ett par misstänkta punktformiga subakuta infarkter frontobasalt på höger sida (Figur 1).
Vid inläggning på strokeavdelning hade patienten inga fokala neurologiska bortfall, men klagade över yrsel och illamående, och han kräktes ett par gånger under vårdtiden. Telemetriövervakning under 24 timmar visade ingen avvikande hjärtrytm. Ultraljud av halskärl visade lindrig generell ateromatos men inga stenoser eller ocklusioner.
Han genomgick transtorakal i stället för transesofageal ekokardiografi på grund av strikturanamnes utan fynd av embolikälla; inte heller påvisades några tecken till infektiös endokardit, signifikanta klaffläckage eller vitier, persisterande foramen ovale eller förmaksseptumaneurysm. Ögonundersökning visade trombos i nedre grenen av retinalartären i vänster öga.
Tillståndet bedömdes som Trousseaus syndrom med multipla ischemiska hjärnförändringar från både främre och bakre cirkulationen, bilateralt i storhjärnshemisfärer och infratentoriellt samt i retinalartär. Patienten behandlades med dalteparin (200 IE/kg). Under den resterande vårdtiden avtog illamåendet och yrseln.
Inga andra neurologiska symtom tillkom under 3 månaders uppföljning via strokemottagningen.
Diskussion
Cancer är associerad med högre risk för ischemisk stroke [6], med högst incidens hos patienter med lung-, pankreas-, bröst- eller koloncancer, särskilt mucinproducerande [7, 8]. Risken är störst inom de första 30 dagarna efter cancerdiagnosen och senare hos patienter med metastaserad cancer [9]. Ischemisk stroke kan vara den första manifestationen av systemisk cancer [10], och cancer anses vara en av orsakerna till kryptogen stroke [11].
Cancerrelaterad hyperkoagulabilitet har en viktig roll för uppkomsten av ischemisk stroke vid Trousseaus syndrom [12, 13]. Patienter med cancer och ischemisk stroke har ett karakteristiskt mönster på diffusionsviktad MR, vilket kallas för »three territory sign« och består av multipla bilaterala infarkter från både främre och bakre cirkulationen [14]. Det finns en korrelation mellan grad av hyperkoagulabilitet och D-dimernivå [15] med sensitivitet och specificitet över 93 procent hos patienter med stroke och odiagnostiserad cancer som har D-dimer >5,5 mg/l [16].
Detta MR-mönster i kombination med symtomatologi som tyder på cancer (feber, svettningar och viktnedgång), närvaro av riskfaktorer för cancer (rökning, exponering för cancerframkallande ämnen m m) och förhöjd D-dimernivå kan fungera som ledtråd till cancerdiagnos hos patienter med kryptogen stroke [10, 16, 17]. Stroke utan konventionella strokemekanismer (ateroskleros, kardiell emboli och småkärlssjukdom) inträffar hos 40 procent av patienter med stroke och cancer [18].
Bland patienter med cancer som drabbas av stroke har lungcancer högst prevalens, särskilt adenokarcinom som debuterar utan konventionella strokemekanismer i 70 procent av fallen [19]. Cancer och stroke är båda prevalenta i de äldre åldersgrupperna. Äldre patienter med lungcancer har fördubblad risk för ischemisk stroke 1 år efter cancerdiagnos [5]. Dessutom är metastasering redan vid tidpunkten för stroke mer prevalent hos patienter med Trousseaus syndrom [18, 20].
En annan mekanism relaterad till hyperkoagulabilitet kan vara icke-infektiös endokardit, som ger liknande radiologisk bild och där transtorakal ekokardiografi inte alltid visar kardioembolisk källa [17].
Primära åtgärden att avlägsna tumören
Oavsett vilken underliggande mekanism som framkallar stroke vid Trousseaus syndrom är den primära åtgärden att avlägsna tumören. Antikoagulationsbehandling kan förbättra symtomen och förebygga flera tromboemboliska anfall. Standardbehandling anses vara lågmolekylärt heparin, vilket föredras framför vanligt heparin (icke-fraktionerat heparin), eftersom lågmolekylärt heparin inte kräver monitorering och metaanalyser har visat att lågmolekylärt heparin är överlägset vanligt heparin i termer av minskad totalmortalitet och lägre blödningsincidens [2, 21, 22].
Data från de flesta stora studier kommer från prövningar vid venös tromboembolism, där primära utfall varit lungemboli och djup ventrombos men inte stroke [23]. De senaste åren har direktverkande orala antikoagulantia (NOAK) fått en framträdande plats i behandlingen av venös tromboembolism och arteriell trombos hos patienter med Trousseaus syndrom. Enligt riktlinjerna från American Society of Clinical Oncology (ASCO) som publicerades 2015 rekommenderas emellertid inte NOAK för behandling av stroke eller venös tromboembolism hos patienter med Trousseaus syndrom [24].
En senare studie, publicerad 2017, visade att behandling med NOAK hos patienter med kryptogen stroke och Trousseaus syndrom hade liknande kliniska utfall och säkerhet som lågmolekylärt heparin, men studien omfattade endast 48 patienter [25]. Ytterligare större studier bör utföras i framtiden för att få svar på denna frågeställning.
Slutsatser
Här beskrivs ett fall av Trousseaus syndrom hos en man med mucinproducerande metastaserat lungadenokarcinom som manifesterade sig med ischemisk stroke i form av multipla bilaterala infarkter både supra- och infratentoriellt samt i retina.
Syftet med denna artikel är att väcka uppmärksamhet på att även cancerpatienter med lindriga neurologiska symtom bör utredas med diffusionsviktad MR-undersökning, särskilt inom de första 30 dagarna efter cancerdiagnos. Även provtagning med D-dimer är av stort värde för att påvisa aktiverat koagulationssystem.
Dessutom kan underliggande Trousseaus syndrom finnas hos patienter med kryptogen stroke utan känd cancer, varför malignitetsutredning och testning med D-dimer i dessa fall är av stort värde.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Strokemekanismer vid cancer
Konventionella och icke-konventionella strokemekanismer hos patienter med cancer [4].
Icke-cancerrelaterade mekanismer (konventionella)
- Ateroskleros
- Kardioembolism
- Lakunära infarkter
- Ovanliga orsaker
Cancerrelaterade mekanismer (icke-konventionella)
Koagulopati orsakad av
- tumörceller (särskilt adenokarcinom)
- vävnadsfaktor (tissue factor) och cancerprokoagulant
- cytokiner såsom TNF-alfaα och interleukiner
- icke-bakteriell (marantisk) och icke-reumatologisk trombotisk endokardit
Tumörocklusion
- tumöremboli
- intravaskulärt lymfom
Direkt tumörrelaterad (metastas eller hjärntumör)
- kompression eller infiltration av kärl
Behandlingsrelaterad
- hyperkoagulabilitet orsakad av cancerbehandling (cisplatin, metotrexat, L-asparaginas, bevacizumab)
- kärlstenos orsakad av strålbehandling eller kirurgi
- komplikationer i form av svampinfektioner eller infektiös endokardit
(uppdaterad 2021-07-13)