Det är viktigt att känna till icke-infektiösa och infektiösa transfusionskomplikationer som förekommer vid behandling med blodtransfusioner.
Transfusionsreaktioner ska rapporteras till den transfusionsmedicinska enhet som lämnat ut blodkomponenten.
Transfusionsassocierad volymöverbelastning (TACO) är sannolikt underrapporterad.
Vid svåra transfusionsreaktioner ska kontakt med transfusionsmedicinare tas omedelbart.
Att ge blodtransfusioner på rätt indikationer är ett aktuellt ämne nationellt och internationellt (»patient blood management«, PBM) [1]. Risk för transfusionskomplikationer är en viktig faktor i avvägningen inför transfusion. I denna översikt beskriver vi typ och förekomst av transfusionskomplikationer baserat på vetenskapliga publikationer och rapporterade hemovigilansdata.
Trots kontinuerligt arbete för att optimera säkerheten kring blodtransfusioner finns fortfarande risker med behandlingen [1]. I en stor internationell sammanställning av biverkningar anges incidensen transfusionskomplikationer till 77,5/100 000, 25 procent av dessa allvarliga. Frekvensen av transfusionsassocierade dödsfall var 0,26/100 000 [2]. I Storbritanniens senaste hemovigilansrapport för 2018 är 20 transfusionsassocierade dödsfall och 109 fall av allvarlig morbiditet i samband med transfusion dokumenterade [3].
Allvarliga transfusionsreaktioner ska enligt Socialstyrelsens föreskrifter rapporteras till Inspektionen för vård och omsorg (Ivo) [4]. Alla transfusionsreaktioner ska rapporteras till den transfusionsmedicinska enhet som lämnat ut blodkomponenten. Uppgifter om incidenser varierar internationellt beroende på olika system för dokumentation av biverkningar samt en sannolik underdiagnostik och underrapportering [3, 5].
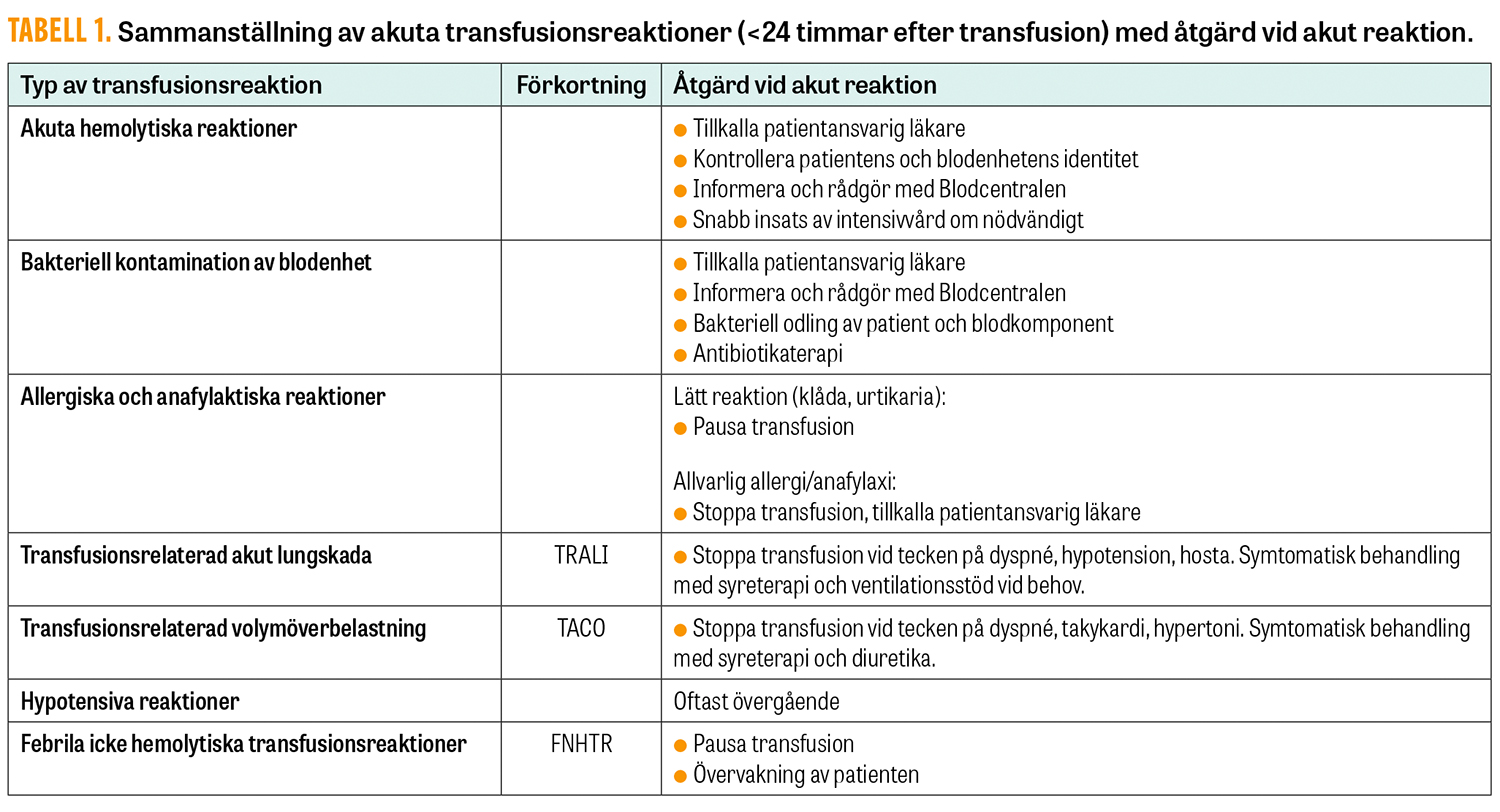
Syftet med sammanställningen är att ge en överblick över oönskade effekter av blodtransfusioner (översikt i Tabell 1) [6-8], samt en uppskattning av förekomst i Sverige [9].
Akuta transfusionsreaktioner (Tabell 1)
Akuta transfusionsreaktioner (ATR) observeras inom 24 timmar efter en transfusion. Akuta transfusionsreaktioner varierar i allvarlighetsnivå från lindrig till allvarlig.
Differentialdiagnoser vid livshotande svåra akuta transfusionsreaktioner inkluderar transfusionsöverförd infektion med bakterier, akuta hemolytiska reaktioner (vanligtvis på grund av ABO-inkompatibel transfusion av erytrocyter), anafylaxi, TRALI (transfusion-related acute lung injury) och TACO (transfusion-associated circulatory overload).
Akuta hemolytiska reaktioner (<10 fall/år)
De mest allvarliga hemolytiska reaktionerna [10] orsakas av transfusion av ABO-inkompatibla erytrocyter som reagerar med patientens anti-A- respektive anti-B-antikroppar. Erytrocyterna kan förstöras omedelbart intravasalt med frisättning av hemoglobin och inflammatoriska cytokiner. Chock, akut njursvikt samt disseminerad intravaskulär koagulation kan uppstå.
ABO-inkompatibla transfusioner av erytrocyter inträffar några gånger årligen och är oftast orsakade av fel vid provtagning eller märkning av prov inför transfusion, fel vid hämtning av komponenter från blodkylen och bristfällig kontroll av komponent- eller patientidentitet vid transfusion. Om erytrocyter transfunderas till fel patient är risken för ABO-inkompatibilitet ca 30 procent. Intensivvård eller dialys krävs vid upp till 30 procent av inkompatibla transfusioner, och i 5–10 procent av fallen bidrar feltransfusionen till ett dödligt utfall. Om felhantering ingår ska anmälan enligt lex Maria göras.
Kliniska symtom är plötslig sjukdomskänsla, frossa, buk- och ländryggssmärta samt rodnad. Hos nedsövda eller medvetslösa patienter kan takykardi, blodtrycksfall eller blödning, till exempel vid insticksställen, vara de första tecknen på inkompatibel transfusion.
Patienthantering vid misstanke om akut hemolytisk reaktion inkluderar
- upprätthålla venös infart
- tillkalla patientansvarig läkare omedelbart
- kontrollera patientens och blodenhetens identitet
- informera och rådgör med den transfusionsmedicinska enhet som lämnat ut komponenten
- intravenös vätska, diuretika och snabb insats av intensivvård om nödvändigt
- eventuellt plasmabyte vid allvarlig hemolys.
Kontamination med bakterier (<10 fall/år)
Blodkomponenter kan vara kontaminerade med bakterier, oftast härstammande från blodgivarens hud vid punktion under blodtappning. Bakterierna kan föröka sig under lagring och leda till toxiska eller septiska reaktioner vid transfusion.
Denna sällsynta komplikation sker oftare i samband med transfusion av trombocytenheter, som lagras vid 22–24 °C. Patogenreducering av trombocyter minskar risken för överlevnad av bakterier i trombocytenheter betydligt [11]. Kontamination av komponenter med bakterier kan få letala konsekvenser hos mottagaren.
Typiska symtom är feber (vanligtvis >2 °C temperaturstegring), hypotension samt snabb utveckling av chock och sänkt medvetande.
Allvarlig allergi och anafylaxi (<50 fall/år)
Chock eller allvarlig hypotension associerad med bronkospasm, larynxödem eller svullnad av ansikte, slemhinnor (angiödem) och extremiteter kan vara tecken på anafylaxi, som är en akut livshotande komplikation. Andra hudsymtom är rodnad och urtikaria, vilket också förekommer vid mindre allvarliga allergiska reaktioner. Allvarliga allergiska och anafylaktiska reaktioner kan orsakas av alla blodkomponenter men ses oftast i samband med transfusion av plasma eller trombocyter.
Behandling av anafylaxi inkluderar adrenalin, efter initial behandling även steroider och antihistaminer vid behov.
Efter en anafylaktisk reaktion ska laboratorieundersökningar och en framtida transfusionsstrategi diskuteras med en specialist i transfusionsmedicin. Oftast förekommer enstaka reaktioner, och nödvändiga transfusioner kan fortsätta under övervakning.
Allvarliga reaktioner kopplade till IgA-brist (<10 fall/år)
Ett fåtal patienter med IgA-brist kan utveckla allvarliga allergiska reaktioner i samband med blodtransfusion.
Störst risk har patienter med IgA-brist (< 0,07 g/l) som också har anti-IgA-antikroppar. Vid sjukdomar med generellt låga antikroppsnivåer som till exempel variabel immunbrist eller lymfoproliferativ sjukdom ses ingen ökad risk för allergiska reaktioner.
Patienter utan tidigare allvarliga transfusionsreaktioner kan transfunderas med standardblodkomponenter [12]. Den lilla grupp av patienter med grav IgA-brist och antikroppar, samt dokumenterade allvarliga allergiska reaktioner vid transfusion, kräver transfusionsplanering med en specialist i transfusionsmedicin.
Transfusionsrelaterad akut lungskada (<10 fall/år)
Klassisk TRALI är orsakad av antikroppar i den transfunderade komponenten som reagerar med patientens neutrofiler, monocyter eller endotelceller i lungorna, men det finns även andra cellaktiverande faktorer som kan orsaka TRALI [13]. Inflammatoriska celler samlas i lungan och orsakar läckage av plasma i de alveolära utrymmena (icke-kardiogent lungödem). TRALI uppträder i tidsspannet från transfusion till 6 timmar efter transfusion, i typiska fall med allvarlig dyspné och hosta med skummande rosa sputum. Ofta förekommer hypotension på grund av förlust av plasmavolym och feber. Toraxröntgen visar bilaterala nodulära skuggor med normal hjärtstorlek. TRALI förväxlas ofta med akut hjärtinsufficiens på grund av cirkulatorisk överbelastning (TACO, se nedan) [14].
Behandlingen är symtomatisk med syreterapi och ventilationsstöd vid behov.
Fall av misstänkt TRALI ska rapporteras och diskuteras med en specialist i transfusionsmedicin för att bedöma om blodkomponenter, respektive deras blodgivare, behöver testas för antikroppar mot humant leukocytantigen (HLA) eller humant neutrofilantigen (HNA).
TRALI förekommer vanligtvis efter transfusion av plasmainnehållande komponenter. Oftast kommer komponenterna från kvinnliga givare, som blivit HLA-/HNA-immuniserade under graviditet. I Sverige används nästan bara plasma och aferestrombocyter från manliga givare eller leukocytantikroppsscreenade kvinnliga givare, vilket har lett till en avsevärd minskning av misstänkt TRALI.
Transfusionsrelaterad volymöverbelastning (<10 fall/år)
TACO definieras som akut uppträdande lungödem inom 6 timmar efter transfusion. Typiskt noteras akut dyspné, takykardi, förhöjt blodtryck och positiv vätskebalans [14]. Numera anges TACO som den vanligaste orsaken till transfusionsrelaterad mortalitet i länder med utvecklad sjukvård [2].
Äldre patienter har en högre risk med predisponerande faktorer som inkluderar hjärtsvikt, njursvikt, låg albuminkoncentration och övervätskning.
Erytrocytenheter har hög viskositet med hematokrit på över 60 procent och är oftast orsak till TACO, men även andra blodkomponenter som transfunderas för snabbt medför risk.
Behandling av TACO består av omgående avslutande av transfusionen, syretillförsel och diuretisk terapi med noggrann övervakning och intensivvård vid behov.
Risken för TACO reduceras genom klinisk bedömning av riskfaktorer, ordination av volym och transfusionshastighet i förhållande till patientens status samt övervakning under transfusion.
Hypotensiva reaktioner (<10 fall/år)
Hypotensiva reaktioner kännetecknas av fall av systoliskt blodtryck med ≥30 mm Hg (till under 80 mm Hg) inom en timme efter transfusion, utan tecken på annan orsak som allergisk reaktion eller blödning. Oftast är de övergående, men kan i enstaka fall övergå i chock och organdysfunktion. Orsaken till reaktionen är oftast okänd, möjligen förekommer den oftare hos patienter som medicineras med ACE-hämmare. Andra orsaker till svåra akuta transfusionsreaktioner ska uteslutas genom kliniska och laboratorieundersökningar.
Mindre allvarliga transfusionsreaktioner
Febrila icke-hemolytiska transfusionsreaktioner (FNHTR) (<50 fall/år) kännetecknas av feber, ibland med skakningar, muskelsmärta och illamående. De kan uppträda upp till 2 timmar efter avslutad transfusion och förekommer oftare hos multitransfunderade patienter. Leukocytreducering av blodkomponenter har minskat febrila reaktioner. Orsaken är oftast leukocytantikroppar hos mottagaren eller frisatta lösliga inflammationsmarkörer i blodkomponenten.
Lätta FNHTR med feber >38 °C, men mindre än 2 °C höjning från ursprungsvärdet kan ofta behandlas genom att pausa transfusionen. Antipyretika kan ges. Noggrann övervakning är viktig eftersom febern kan vara tecken på en mer allvarlig transfusionsreaktion.
Vid mer allvarliga FNHTR med feber >39 °C, eller mer än 2 °C höjning från ursprungsvärdet, eller symtom som stelhet och myalgi, ska transfusionen avbrytas. Om symtomen inte förbättras omgående ska eventuell hemolys eller bakteriell kontamination av komponenten utredas.
Lätta allergiska reaktioner. Symtomen är oftast begränsade till klåda och/eller hudutslag utan påverkan på vitalparametrar. Utlösande är ofta komponenter som innehåller plasma.
Symtomen förbättras ofta genom att minska transfusionshastighet och medicinering med antihistamin. Noggrann övervakning är viktig eftersom reaktionen kan utvecklas till en allvarlig allergisk reaktion.
Fördröjda transfusionsreaktioner (Tabell 2)
Fördröjda hemolytiska reaktioner (DHTR) (<10 fall/år)
Fördröjda hemolytiska transfusionsreaktioner [10] uppträder mer än 24 timmar efter transfusion hos patienter som har blivit alloimmuniserade vid tidigare blodtransfusion eller graviditet. Alloantikroppsnivåerna är för låga för att kunna upptäckas vid förenlighetsprövningen, men stiger snabbt efter reexponering för det oförenliga antigenet vid erytrocyttransfusion.
Transfusion av antigenpositiva erytrocyter orsakar en »boostring« av patientens antikroppstiter, vilket kan leda till hemolys av de transfunderade cellerna. Hemolysen kan diagnostiseras så sent som 14 dagar efter transfusion. Symtomen inkluderar sjunkande hemoglobinnivåer (eller ingen respons till transfusion), ikterus, feber, ibland hemoglobinuri eller njursvikt. DHTR förbises ofta, speciellt om patienten har blivit utskriven från vårdavdelningen.
Behandling är vanligtvis stödjande och ibland är ytterligare transfusioner nödvändiga.
Transplantat kontra värd-sjukdom (GVHD) (<1 fall/år)
Denna sällsynta och nästan alltid letala komplikation orsakas av lymfocyter i en blodkomponent som prolifererar och angriper patientens celler och vävnad [16]. Symtom ses primärt från hud, tarm och lever. Riskgruppen är patienter med nedsatt cellmedierad immunitet, exempelvis foster vid intrauterina transfusioner, eller immunsupprimerade patienter, som vid allogen stamcellstransplantation. Konventionell kombinationskemoterapi för cancer utgör inte risk för transfusionsrelaterad GVHD (TA-GVHD).
Det är viktigt att bestråla alla erytrocyt- och trombocytenheter till riskpatienter för att förebygga TA-GVHD.
Posttransfusionspurpura (PTP) (<1 fall/år)
Hos berörda patienter sjunker trombocyterna plötsligt efter transfusion av erytrocyter, vilket kan leda till blödningar [17]. Patienterna är vanligen kvinnor som har bildat trombocytantikroppar under graviditet. PTP orsakas av restimulation av trombocytspecifika alloantikroppar som sedan skadar de egna, antigennegativa trombocyterna (»innocent bystander reaction«).
Transfusion av trombocyter är vanligtvis ineffektiv men kan bli nödvändig vid livshotande blödning. De flesta patienter svarar på behandling med intravenöst immunoglobulin (IVIg).
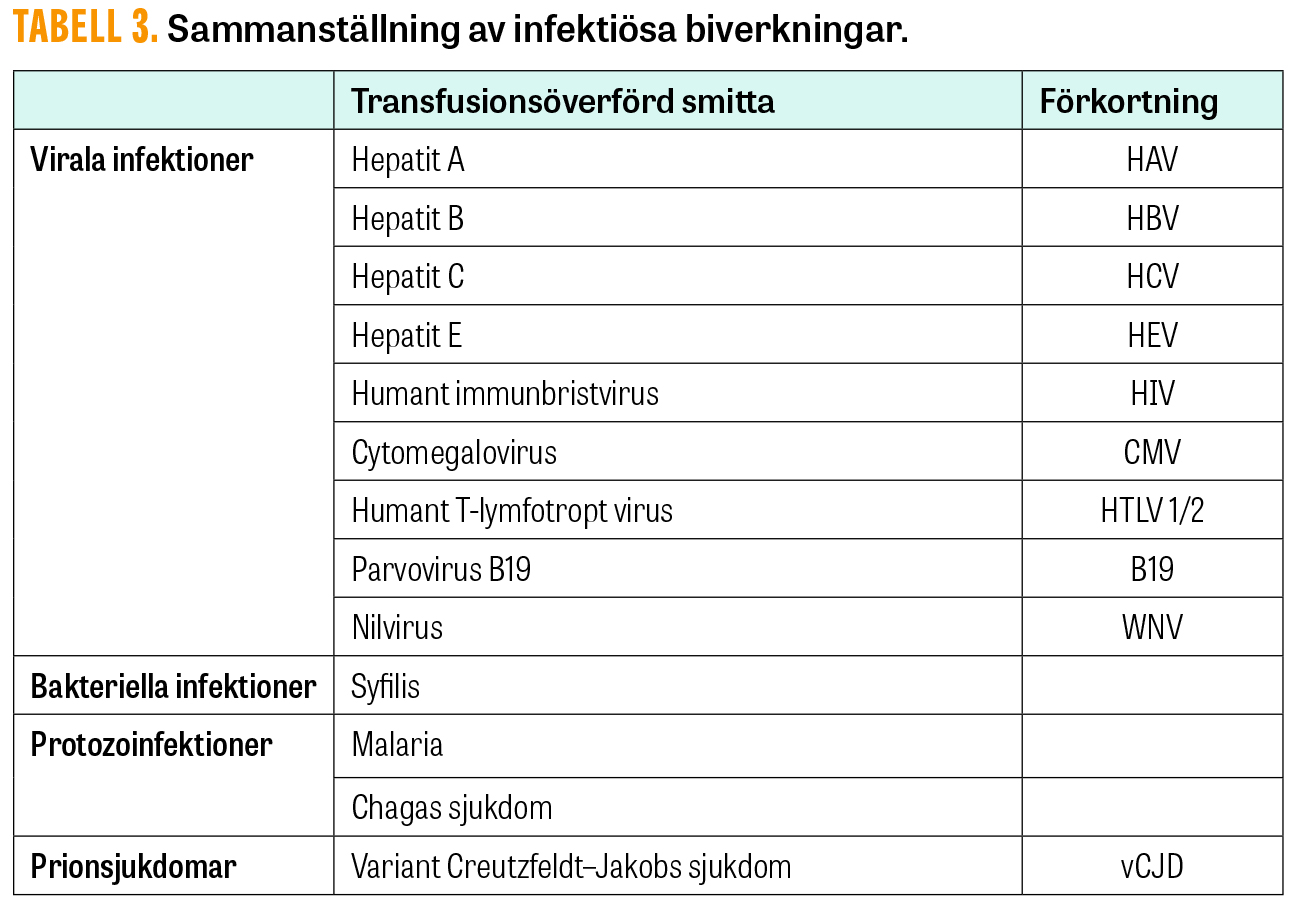
Transfusionsöverförd smitta (Tabell 3)
Transfusionsöverförd smitta har traditionellt dominerat diskussionen kring blodsäkerhet, men genom urval av blodgivare och testning av komponenter har blodsmittor numera blivit ovanliga. Trots detta är kontinuerlig vaksamhet viktig, särskilt med tanke på nya patogener i en föränderlig miljö med ökat internationellt resande.
Virala infektioner
Med hjälp av urval av blodgivare samt traditionell serologisk testning har hepatit B- (HBV), hepatit C- (HCV) och hivsmitta via blodkomponenter blivit mycket sällsynta i Sverige.
Det diagnostiska fönstret, från smittillfället tills smittan visar sig i de serologiska testen, kan förkortas om nukleinsyratestning (nucleid acid testing, NAT) tillämpas [18]. Enligt en remiss från Socialstyrelsen om ändring i föreskrifterna (SOSFS 2009:28) om blodverksamhet [19] diskuteras om NAT eventuellt ska introduceras i Sverige.
Hepatit A (HAV) är en oftast akut tarminfektion som smittar via den fekal-orala vägen. Blodkomponenter är inte testade för HAV-antikroppar eller antigen. Som icke höljeförsett virus är HAV resistent mot vissa metoder av patogenreducering av blodkomponenter. Blodsmitta är sällsynt eftersom berörda individer oftast är symtomatiska och därmed har karens för blodgivning. Det senaste kända fallet med transfusionsöverförd HAV i Sverige är från 2009.
Hepatit B-virus (HBV) kan överföras via infekterat blod eller kroppsvätskor. De flesta patienter återhämtar sig efter den akuta episoden, men vissa förblir kroniska bärare av viruset med risk för levercirros och hepatocellulär cancer.
Blodkomponenter i Sverige testas för hepatit B-virus och 2 fall med överförd smitta har rapporterats, 2005 och 2008.
Hepatit C-virusinfektion (HCV) är ofta symtomfri, men ungefär 80 procent av patienter blir kroniska bärare med senare risk för levercirros, leversvikt och cancer i levern. Före utvecklingen av antikroppstest var hepatit C, då kallad för »non-A, non-B hepatit«, en vanlig transfusionsöverförd smitta. Sedan 2005 har 3 fall av transfusionsöverförd smitta rapporterats i Sverige. Fallet år 2018 upptäcktes hos plasmaköparen som med NAT-teknik kunde påvisa HCV, vilket senare bekräftades på Blodcentralen för både givare och transfunderad patient.
Hepatit E. Infektion med hepatit E-virus (HEV) hos friska personer ger oftast ett asymtomatiskt sjukdomsförlopp. HEV överförs via blodkomponenter och kan orsaka kroniska infektioner med risk för levercirros hos immunsupprimerade patienter. Viremi hos blodgivare i olika europeiska länder varierar från 1:726 to 1:3333 [20]. Flera länder (till exempel Storbritannien, Nederländerna och Tyskland) har påbörjat NAT-screening för HEV i blodkomponenter.
Humant immunbristvirus (hiv). Smittöverföring via transfusion var vanlig i den tidiga aids-epidemin. I Sverige screenas bloddonationer med ett kombinerat antigen/antikroppstest. Sedan 1985, när testning startades, har det inte funnits något rapporterat fall av hivsmitta via blod i Sverige.
Cytomegalovirus (CMV) är ett vanligt herpesvirus som vid infektion orsakar lätta symtom eller förblir asymtomatiskt. Viruset kan persistera i monocyter även efter serokonversion, vilket kan göra en del personer till livslånga bärare. Transfusionsassocierad smitta kan vara svår att skilja från reaktivering i berörda patienter. CMV kan orsaka allvarliga infektioner hos foster, nyfödda och immunsupprimerade patienter. Leukocytreducering av komponenter skyddar mot CMV-överförd smitta.
Humant T-lymfotropt virus typ I och II (HTLV I /II). Dessa retrovirus kan överföras med blodkomponenter och är associerade till förekomsten av adult T-cellsleukemi/lymfom [21]. Antikroppsscreening av nyanmälda blodgivare samt leukocytreducering av cellulära blodkomponenter har minskat risken för smittöverföring.
Parvovirus B19 är ett litet DNA-virus som angriper framför allt omogna röda blodceller. En infektion är ofta asymtomatisk. Parvovirus B19 kan orsaka allvarliga graviditetskomplikationer, som hydrops fetalis och intrauterin fosterdöd, samt anemi hos immunsupprimerade individer. Viruset kan överföras via cellulära blodkomponenter och plasma. Blodkomponenter i Sverige screenas inte för parvovirus B19.
Nilvirus (West Nile-virus, WNV) är ett flavivirus som sprids via myggor och förekommer i stora delar av världen, inklusive södra och östra Europa [22]. De flesta infektioner är lätta eller asymtomatiska, men allvarlig encefalit kan uppstå i ca 0,5 procent av fallen. Blodgivning i den 3–15 dagar långa inkubationsperioden kan orsaka smittöverföring via blodkomponenter. I Sverige tillämpas en 28 dagars karens efter resa i berörda områden. I många länder testas blodgivarna, ibland endast lokalt där WNV påvisats och under säsong.
Bakteriella infektioner
Syfilis. Alla bloddonationer testas för förekomsten av antikroppar mot Treponema pallidum. Blodsmitta är extremt sällsynt.
Andra bakteriella infektioner. Se ovan under »Kontamination med bakterier«.
Protozoinfektioner
Malaria. Trots ökande internationella resor har transfusionsöverförd malaria inte rapporterats i Sverige. Reseanamnes vid blodgivning samt karens efter vistelse i riskområden verkar således vara effektivt.
Chagas sjukdom. Allvarlig multisystemsjukdom orsakad av Trypanosoma cruzi, endemisk i Latinamerika, kan överföras med blodkomponenter. Personer som bott längre tid i endemiska områden får därför inte bli blodgivare.
Prionsjukdomar
Variant Creutzfeldt–Jakobs sjukdom (variant Creutzfeldt–Jakob disease, vCJD) orsakas av samma förändrade prionprotein som orsakar bovin spongiform encefalopati (BSE) i nötkreatur. I Storbritannien har fyra fall av transfusionsrelaterad överföring av vCJD rapporterats före 1999 [3]. Inget screeningtest för blodkomponenter är tillgängligt.
Sammanfattning
Blodtransfusioner anses i dag som en relativt säker behandling, men transfusionskomplikationer är sannolikt både underrapporterade och underdiagnostiserade. Transfusionskomplikationer och misstänkta transfusionskomplikationer ska alltid rapporteras till aktuell transfusionsmedicinsk enhet, helst i nära anslutning till reaktionen. Information om provtagning och utredning finns på webbplatsen för transfusionsmedicinsk enhet vid respektive sjukhus. Allvarliga transfusionskomplikationer ska enligt Socialstyrelsens föreskrifter anmälas till Ivo, och om felhantering ingår ska en lex Maria-anmälan övervägas.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2021-03-17)