Venös tromboembolism (VTE) associerad till cancer är vanligt och grundsjukdomen ökar ofta recidivrisk och risk för blödning vid behandling med antikoagulantia.
Faktor Xa-hämmare har visat sig vara minst lika effektiva som lågmolekylärt heparin för att förhindra recidiv vid cancerassocierad VTE samt medför en liknande blödningsrisk.
Venös tromboembolism (VTE), i form av djup ventrombos eller lungemboli, utgör en vanlig orsak till morbiditet och mortalitet vid många former av cancer [1]. Cancerpatienter har en 4 till 7 gånger ökad risk för VTE [1]. Behandling av cancerassocierad VTE kompliceras av att grundsjukdomen medför ökad risk för blödning och samtidigt risk för recidiv [1]. Behandling med cytostatika, strålning eller hormoner kan påverka risken för VTE samt komplicera behandling med antikoagulantia.
Traditionellt har behandling med lågmolekylärt heparin (LMH) i minst 3–6 månader varit standard som behandling av manifest VTE hos patienter med cancer eller så länge cancern anses aktiv [2]. LMH innebär dock dagliga subkutana injektioner, vilket kan upplevas besvärande av patienten och ofta kräver resurser från vårdpersonal. Behandlingen blir ofta långvarig, och lokala hudblödningar är vanliga. Förenklad behandling skulle därför sannolikt förbättra följsamheten.
Direktverkande orala antikoagulantia (NOAK) är välbeprövade som emboliprofylax vid förmaksflimmer och som behandling vid VTE [1]. Emellertid har tidigare studier inte specifikt värderat behandling av cancerassocierad VTE.
NOAK vid cancerassocierad VTE
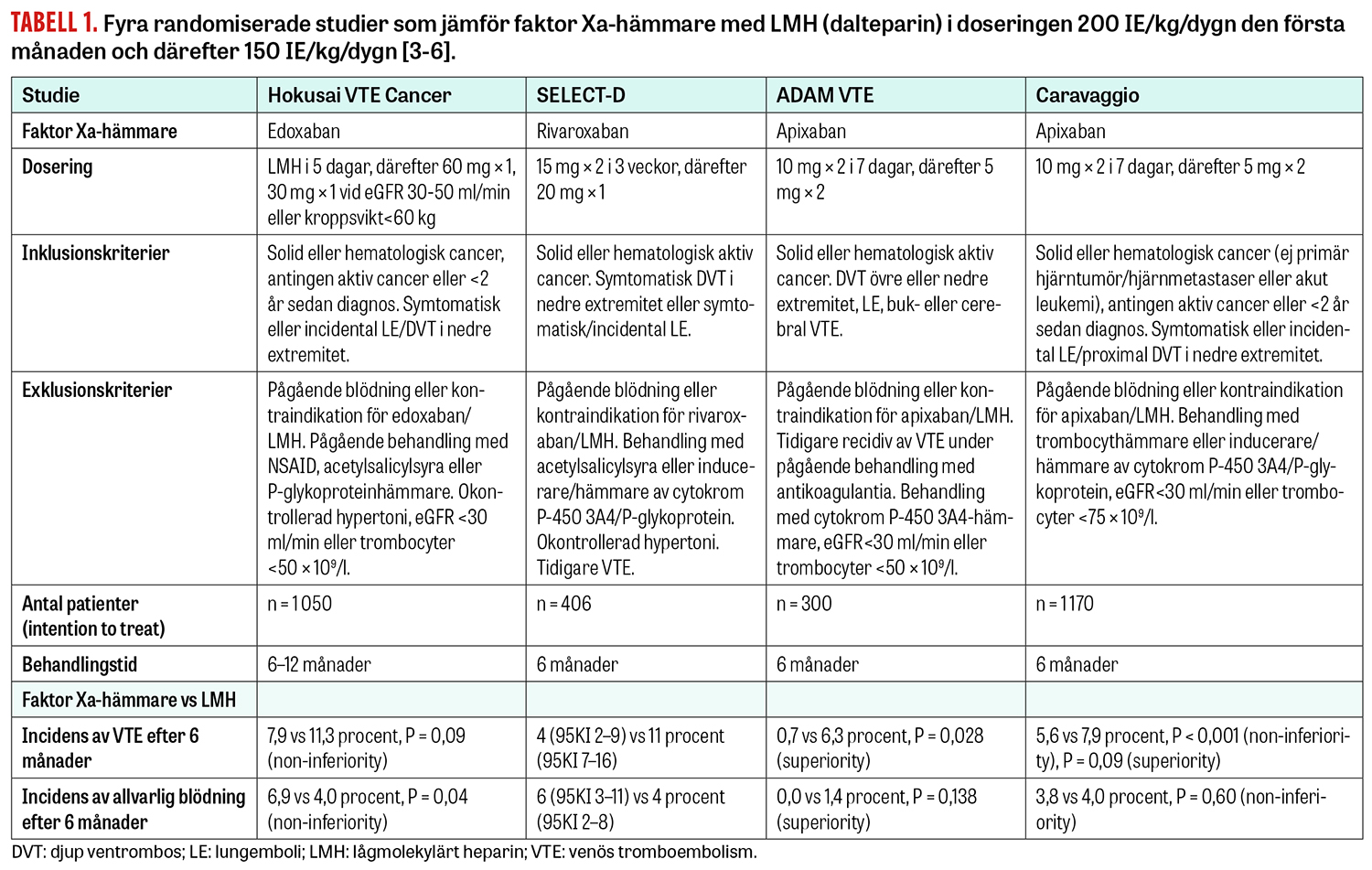
Det finns några randomiserade kontrollerade prövningar där NOAK jämförts med LMH avseende behandling av VTE hos patienter med cancer (Tabell 1).
Hokusai VTE Cancer är en studie med non-inferiority-design med 1 050 cancerpatienter, vilka randomiserades till behandling med antingen edoxaban eller LMH i 6–12 månader [3]. Primärt utfall (recidiv av VTE eller allvarlig blödning) inträffade hos 12,8 procent i edoxabangruppen och hos 13,5 procent i LMH-gruppen (hazardkvot [HR] 0,97, 95 procents konfidensintervall [95KI] 0,70–1,36; P = 0,006 för non-inferiority, P = 0,87 för superiority). I edoxabangruppen fick 7,9 procent recidiv av VTE, jämfört med 11,3 procent i LMH-gruppen. Allvarlig blödning inträffade hos 6,9 procent i edoxabangruppen jämfört med 4,0 procent i LMH-gruppen. Skillnaden i blödningar drevs huvudsakligen av fler övre gastrointestinala blödningar hos de patienter som behandlades med edoxaban.
SELECT-D är en studie med 406 cancerpatienter, vilka randomiserades till behandling med antingen rivaroxaban eller LMH under 6 månader [4]. Detta var en pilotstudie, vilket reflekteras i en relativt liten studiepopulation. Primärt utfallsmått var recidiv av VTE under denna period. I rivaroxabangruppen fick 4 procent recidiv av VTE inom 6 månader jämfört med 11 procent i LMH-gruppen (HR 0,43, 95KI 0,19–0,99; P-värde anges ej). Numeriskt fler allvarliga blödningar inträffade hos patienter behandlade med rivaroxaban (6 procent) jämfört med patienter som fick LMH (4 procent) (HR 1,83, 95KI 0,68–4,96). Fler kliniskt relevanta icke-allvarliga blödningar inträffade i rivaroxabangruppen,13 procent jämfört med 4 procent i LMH-gruppen (HR 3,76, 95KI 1,63–8,69; P-värde anges ej). Det noterades en särskild risk för blödning vid gastrointestinal cancer, varför inklusion av dessa patienter avbröts under studiens gång.
Dessa nya data inkorporerades i rekommendationer från International Society on Thrombosis and Haemostasis (ISTH) 2018 avseende behandling av cancerassocierad VTE [2]. Rekommendationen i riktlinjerna var i första hand edoxaban eller rivaroxaban till patienter med låg blödningsrisk och utan risk för läkemedelsinteraktioner, medan patienter med hög blödningsrisk (till exempel patienter med gastrointestinal cancer) i första hand skulle erhålla LMH enligt tidigare riktlinjer. Vikten av en individuell bedömning för varje patient underströks.
I den nyligen publicerade studien ADAM VTE randomiserades 300 patienter med cancerassocierad VTE till behandling med apixaban eller LMH under 6 månader [5]. Primärt utfallsmått var allvarlig blödning. Sekundärt utfallsmått var recidiv av VTE samt ett kombinerat utfallsmått av allvarlig blödning och kliniskt relevant icke-allvarlig blödning. Totalt 287 patienter inkluderades i den primära analysen. I apixabangruppen drabbades ingen av allvarlig blödning jämfört med 1,4 procent i LMH-gruppen. Ny VTE inträffade hos 0,7 procent i apixabangruppen jämfört med 6,3 procent i LMH-gruppen (HR 0,099, 95KI 0,013–0,780; P = 0,028). Förekomsten av allvarliga blödningar samt kliniskt relevanta icke-allvarliga blödningar låg på 6 procent i båda grupperna. Studien var förhållandevis liten och utmärker sig även med en låg andel allvarliga blödningar.
Caravaggio är den senast presenterade studien, i vilken 1 170 patienter med cancerassocierad VTE randomiserades till 6 månaders behandling med apixaban eller LMH [6]. Primärt utfallsmått var recidiv av VTE, medan säkerhetsutfallsmått var allvarlig blödning. Ny VTE inträffade hos 5,6 procent i apixabangruppen jämfört med 7,9 procent i LMH-gruppen (HR 0,63, 95KI 0,37–1,07), signifikant för non-inferiority (P < 0,001), men inte för superiority (P = 0,09). Allvarlig blödning inträffade hos 3,8 procent i apixabangruppen jämfört med 4,0 procent i LMH-gruppen (HR 0,82, 95KI 0,40–1,69; P = 0,60. Det förekom ingen skillnad avseende gastrointestinala blödningar mellan behandlingsgrupperna. Studiens slutsats är att apixaban är lika effektivt som LMH för att förebygga recidiv av VTE utan ökad risk för allvarlig blödning.
En ny systematisk översiktsartikel och metaanalys [7] finns nu tillgänglig och inkluderar dessa fyra ovan nämnda studier (2 894 patienter) [3-6]. De NOAK som studerades var faktor Xa-hämmarna apixaban, edoxaban och rivaroxaban. Recidiv av VTE inträffade hos 5,2 procent bland de patienter som behandlades med NOAK och hos 8,2 procent av patienterna behandlade med LMH (relativ risk 0,62, 95KI 0,43–0,91). Allvarlig blödning noterades hos 4,3 procent av patienterna behandlade med NOAK jämfört med 3,3 procent av patienterna behandlade med LMH (relativ risk 1,31, 95KI 0,83–2,08).
Diskussion
NOAK är minst lika effektiva som LMH för att förebygga recidiv hos patienter med cancerassocierad VTE [1, 7]. Behandlingen med NOAK, bedömd på gruppnivå, förefaller också ha liknande säkerhet avseende allvarlig blödning som LMH, särskilt om man väljer bort patienter med gastrointestinala tumörer [1, 7]. Skillnaden i förekomsten av allvarliga blödningar med NOAK jämfört med LMH varierade mellan studierna, vilket kan vara viktigt att beakta vid val av NOAK till den enskilde patienten. Det saknas dock studier som direkt jämför olika faktor Xa-hämmare.
NOAK innebär en enklare och bekvämare behandling för patienten [5] och är mindre resurskrävande för sjukvården. Detta medför troligen bättre följsamhet till behandling hos patienten, vilket är särskilt viktigt eftersom behandlingen ofta kan bli långvarig. Dessutom är priset för NOAK lägre än för LMH. LMH bör dock vara ett alternativ hos vissa patienter, exempelvis de med gastrointestinal cancer där primärtumören är kvar och de som har svårt att inta eller behålla orala läkemedel. Val av behandling, speciellt i det akuta skedet, bör ta hänsyn till blödningsrisk, kroppsvikt, aktuell njurfunktion, leverfunktion, trombocytnivå samt interaktioner med andra läkemedel. Preparatval och uppföljning bör vid samtidig cellgiftsbehandling eller vid speciellt hög blödningsrisk av annan anledning (till exempel kroppsvikt under 60 kg) ske i samråd med läkare förtrogen med detta.
Riktlinjer från brittiska National Institute for Health and Care Excellence (NICE) från 2020, vilka betonar vikten av en individualiserad behandling med hänsyn till patientens preferenser, samsjuklighet och kontraindikationer, rekommenderar att behandling med NOAK övervägs, och om detta bedöms olämpligt övervägs LMH [8]. Nyligen publicerades även rekommendationer från National Comprehensive Cancer Network (NCCN) som rekommenderar NOAK i första hand, men LMH till patienter med gastrointestinal cancer [9]. Vi välkomnar därför en svensk uppdatering på området.
Potentiella bindningar eller jävsförhållanden: Peter Magnusson har erhållit föreläsningsarvode eller forskningsmedel från Abbott, Alnylam, Amicus Therapeutics, Astra Zeneca, Bayer, Boehringer Ingelheim, Internetmedicin, Lilly, MSD, Novo Nordisk, Octopus Medical, Orion Pharma, Pfizer, Vifor Pharma och Zoll. Gustav Mattsson har erhållit arvode från Alnylam, MSD och Internetmedicin.