I hela världen inklusive Sverige ökar förekomsten av ESBL-producerande tarmbakterier.
Framför allt multiresistenta ESBLCARBA-producerande tarmbakterier utgör ett stort behandlingsproblem på grund av brist på effektiva antibiotika. Samma problem gäller dock även multiresistenta Pseudomonas aeruginosa och Acinetobacter-arter.
Nya antibiotika (betalaktamashämmare i kombination med betalaktamantibiotika) som nu genomgår kliniska prövningar kan bli behandlingsalternativ inom några år.
Utöver nya läkemedel behövs det omfattande vårdhygieniska insatser för att bekämpa resistensspridningen.
Betalaktamantibiotika, dvs penicilliner, cefalosporiner och karbapenemer, är oftast förstahandsval vid behandling av såväl okomplicerade som svårare infektionstillstånd. Den vanligast förekommande resistensmekanismen mot betalaktamer hos gramnegativa tarmbakterier är betalaktamaser, enzymer som bryter ned betalaktamantibiotika.
ESBL (extended-spectrum beta-lactamases) är en typ av betalaktamaser som inaktiverar penicilliner, de flesta cefalosporiner och i vissa fall även karbapenemer.
Växande problem
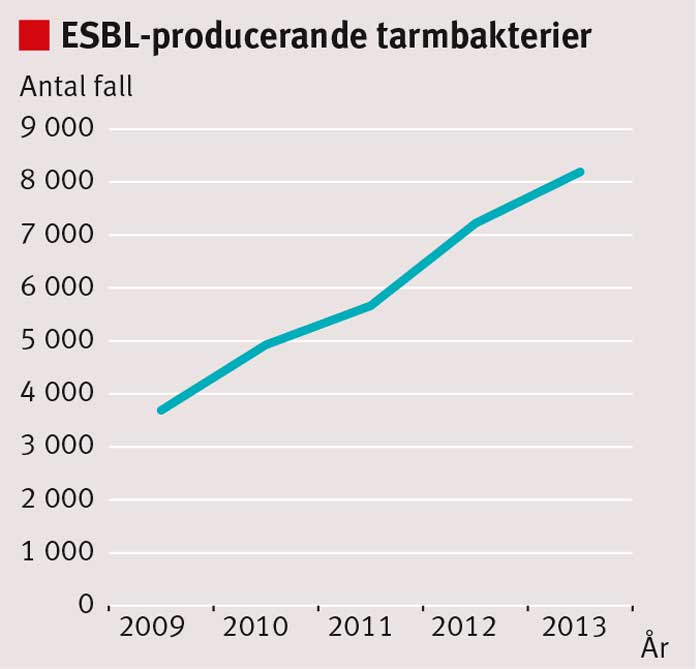
Infektioner orsakade av tarmbakterier som producerar ESBL är ett växande problem. Statistik från Folkhälsomyndigheten visar en ökning av inrapporterade fall av ESBL-producerande tarmbakterier (Figur 1) [1]. De vanligaste ESBL-enzymerna (ESBLA) (Tabell I) bryter ned penicilliner och cefalosporiner men inte karbapenemer.
ESBLCARBA-producerande tarmbakterier är resistenta mot i princip samtliga betalaktamer. Under 2012 rapporterades 7 225 och under 2013 8 131 fall av ESBL-producerande tarmbakterier, varav 23 (2012) respektive 38 (2013) ESBLCARBA-producerande [2].
Utöver karbapenemer kan man i vissa fall använda kombinationsantibiotika i form av betalaktam–betalaktamashämmare som piperacillin/tazobaktam mot infektioner med ESBLA-producerande tarmbakterier, under förutsättning att resistensbestämning visar känslighet för dessa preparat [3]; de för närvarande godkända betalaktamashämmarna kan ofta inaktivera ESBLA. Detsamma gäller tyvärr inte ESBLCARBA, vilket innebär att antalet effektiva antibiotika är kraftigt begränsat. I de flesta fall är ESBLCARBA-producerande tarmbakterier känsliga enbart för kolistin, tigecyklin och fosfomycin [4].
Flera rapporter har påpekat vikten av att använda kombinationsbehandlingar som inkluderar en karbapenem och/eller kolistin vid behandling av infektioner orsakade av ESBLCARBA-producerande stammar [5-7]. Men komplikationer (t ex njurtoxicitet) till följd av kolistinbehandling är vanliga, och mortaliteten vid dessa infektioner är fortfarande hög [8].
Samma behandlingsproblem som vid ESBLCARBA gäller även multiresistenta Acinetobacter-arter och Pseudomonas aeruginosa, vilka oftast orsakar nosokomiala infektioner hos svårt sjuka patienter [9]. Dessa två bakteriearter har flera mekanismer utöver betalaktamaser som medför resistens mot karbapenemer och övriga betalaktamer.
Orsakar 25 000 dödsfall per år i Europa
Bristen på nya antibiotika mot tarmbakterier är mycket allvarlig med hänsyn till den snabba globala ökningen av multiresistenta bakterier. Sedan 1980-talet då karbapenemerna godkändes har det bara kommit ett nytt preparat för intravenöst bruk på marknaden (tigecyklin) som har effekt mot multiresistenta tarmbakterier. Det har dock rapporterats terapisvikt vid tigecyklinbehandling av allvarliga infektioner orsakade av karbapenemresistenta tarmbakterier [8].
I en rapport från den europeiska smittskyddsmyndigheten ECDC uppskattades att 25 000 patienter/år dör på grund av infektioner med multiresistenta bakterier i Europa [10].
Under de senaste åren har dock några nya antibiotika utvecklats för behandling av multiresistenta tarmbakterier (Tabell II). Preparaten är ännu inte godkända av den europeiska läkemedelsmyndigheten EMEA och är därmed inte tillgängliga för allmänt bruk.
Nya kombinationsantibiotika på väg
Ceftazidim–avibaktam och ceftolozan–tazobaktam, som har kommit längst i utvecklingsprocessen (fas 3), har god aktivitet mot gramnegativa tarmbakterier (Escherichia coli, Klebsiella pneumoniae osv) inklusive bakteriestammar som producerar bl a ESBLA-enzymer. De har dock ingen aktivitet mot metallobetalaktamaser.
Ceftazidim och ceftolozan har aktivitet mot Pseudomonas aeruginosa, och därför tillför dessa kombinationspreparat en alternativ behandling för multiresistenta Pseudomonas när resistensen inte beror på metallobetalaktamaser.
Ceftolozan, som är en ny bredspekt-rumcefalosporin, är i högre grad än ceftazidim, imipenem och piperacillin/tazobaktam stabil mot de kromosomala resistensmekanismer som kan finnas hos Pseudomonas [11]. Båda preparaten har när de kombinerats med metronidazol visats vara likvärdiga med meropenem vid behandling av komplicerade bukinfektioner, och de skulle kunna bli alternativ till karbapenemer vid behandling av akuta bukinfektioner [12, 13].
De medel som har effekt mot metallobetalaktamaser befinner sig i ett tidigt utvecklingsstadium (fas 1). Ett av dem, ME1071, är en selektiv metallobetalaktamashämmare, dvs har ingen aktivitet mot andra ESBLCARBA-enzymer [14]. I kombination med karbapenem (biapenem) är preparatet effektivt mot både tarmbakterier och Acinetobacter-arter som producerar metallobetalaktamaser [14].
BAL30072, som är ett monobaktamderivat, har aktivitet mot samtliga ESBL-enzymer, undantaget KPC. Därför kan det bli ett alternativ vid behandling av infektioner orsakade av bakterier som producerar flera olika typer av ESBL. I kombination med meropenem har medlet aktivitet även mot multiresistenta Acinetobacter-arter och Pseudomonas aeruginosa [15, 16].
Goda hygienrutiner avgörande
Med tanke på att många bakterier ofta har flera resistensmekanismer verkar det som om kombinationsbehandling med ytterligare antibiotika kommer att bli oundviklig i framtiden.
Utveckling av nya antibiotika kräver dock lång tid. Det behövs därför ytterligare insatser för att bemöta detta problem. Goda och väl implementerade hygienrutiner i vården är avgörande. Det behövs även fortsatt minskning och optimering av användning av bred-spektrumantibiotika samt övervakning av resistensläget på nationell och lokal nivå för att åstadkomma en förbättrad antibiotikapolicy. Tidig diagnostik inklusive aktiv screening är viktiga faktorer som bör effektiviseras och utvecklas.
Potentiella bindningar eller jävsförhållanden: Christian G Giske har mottagit föreläsararvode från AstraZeneca och Meda.
Håkan Hanberger och Christian G Giske representerar Referensgruppen för antibiotikafrågor.