Förekomsten av pacemaker, implanterbar defibrillator och hjärtsviktspacemaker ökar, men infektioner relaterade till dessa ökar än mer.
Implantatinfektioner inkluderar dosfickeinfektion, systemisk infektion och/eller endokardit.
Postoperativt hematom och tidig reoperation är starka riskfaktorer för implantatinfektion.
Implantatinfektion medför ökad morbiditet och mortalitet och kräver långvarig parenteral antibiotikabehandling samt skyndsam extraktion.
Certifiering av operatörer, följsamhet till riktlinjer om rekommenderat antal ingrepp per år samt korrekt rapportering till nationella register är förutsättningar för en välfungerande verksamhet med låg komplikationsfrekvens.
Förekomsten av pacemaker, implanterbar defibrillator (ICD) och hjärtsviktspacemaker (CRT) har stadigt ökat i takt med successivt utvidgade indikationer, både nationellt och internationellt [1, 2]. År 2020 hade 74 090 personer (7,1 procent) i Sverige något av dessa implantat, jämfört med 43 194 personer (4,7 procent) år 2006 (www.pacemakerregistret.se). Den relativa incidensen av pacemaker-, ICD- och CRT-relaterade infektioner har dock ökat ännu snabbare än förekomsten av implantat, enligt internationella studier [1, 2]. Incidensen av dessa infektioner varierar beroende på bland annat definition, uppföljningstid, typ av system, noggrannhet i rapportering och patient- och procedurrelaterade riskfaktorer, och den varierar mellan 1,2 och 3,4 procent [2-4]. Behandling av implantatinfektioner är förenad med långa vårdtider eftersom parenteral antibiotikabehandling krävs samtidigt som hela systemet måste extraheras [5]. Implantatinfektioner medför ett stort lidande för patienten, en ökad morbiditet och mortalitet samt även en påtaglig hälsoekonomisk belastning för sjukvården [6, 7].
I många länder finns nationella register för pacemaker, ICD och CRT med syfte att fortlöpande säkra det egna centrumets kvalitet inklusive komplikationsfrekvensen. Svenska ICD- och pacemakerregistret samlar in operationsrelaterade data från samtliga 43 opererande centrum, vilka sammanställs i årliga rapporter (www.pacemakerregistret.se). Registrering är frivillig – till skillnad från till exempel amerikanska register, där detta är indirekt obligatoriskt för att få ersättning – och inkluderar mer än 95 procent av alla pacemaker-, ICD- och CRT-procedurer i landet. Underrapportering av komplikationer till nationella register har beskrivits i flera internationella publikationer [8, 9] och torde vara ett hinder för adekvat kontroll och prevention av pacemaker-, ICD- och CRT-relaterade infektioner. Denna översikt syftar till att öka medvetenheten om dessa infektioner, belysa förebyggande åtgärder samt ge en uppdatering av handläggning av misstänkt och säkerställd implantatinfektion.
Riskfaktorer och prevention av implantatinfektioner
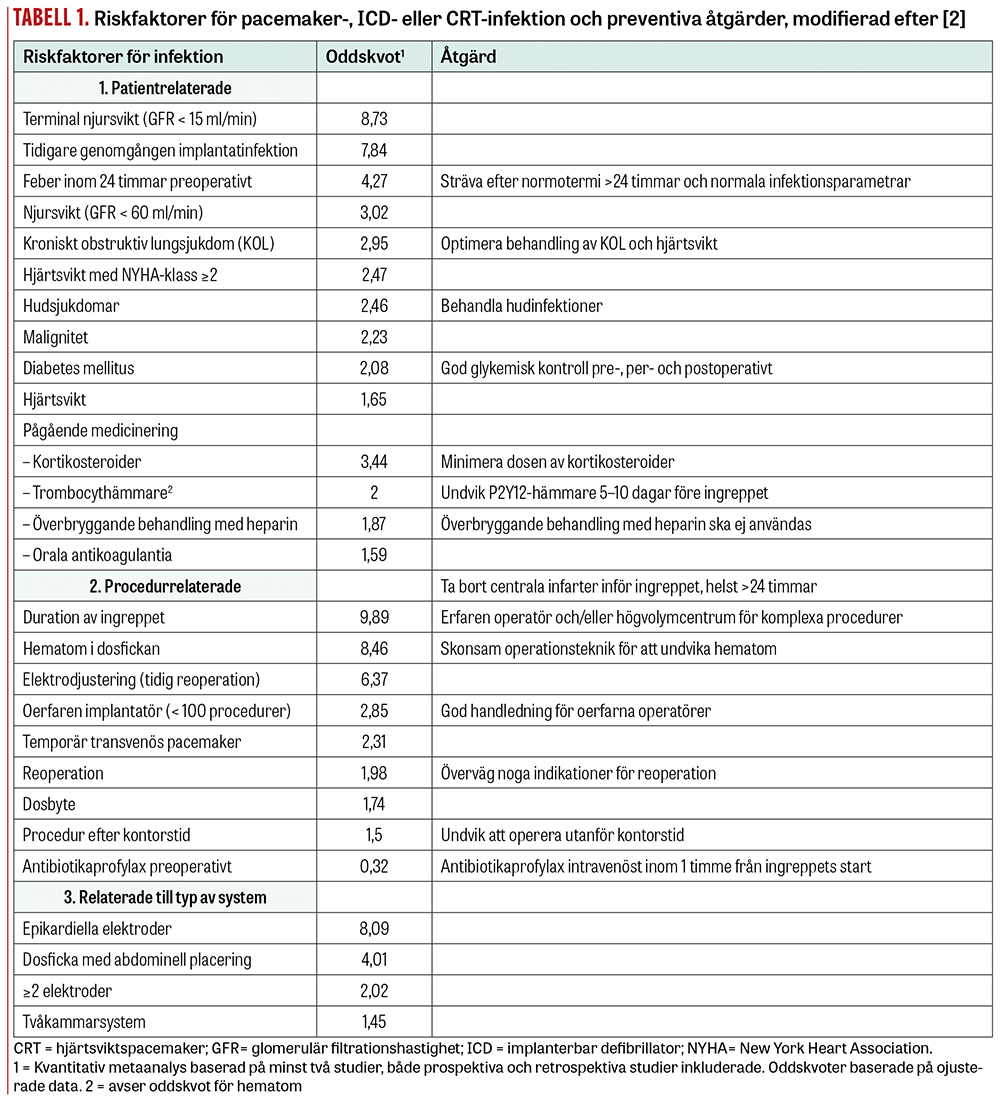
Riskfaktorer för pacemaker-, ICD- eller CRT-relaterad infektion kan vara patient- eller procedurrelaterade eller relaterade till typ av system (Tabell 1) [2]. Vissa av dessa är modifierbara.
Patientrelaterade riskfaktorer inkluderar avancerad njursvikt, tidigare genomgången implantatinfektion [3], feber inom 24 timmar före implantationen, diabetes, kroniskt obstruktiv lungsjukdom, kroniska hudsjukdomar, hjärtsvikt och malignitet samt viss läkemedelsbehandling, som kortikosteroider och antikoagulantia [2].
Procedurrelaterade riskfaktorer inkluderar temporära pacemakrar och centrala infarter som är ingångsportar för bakterier [2]. Infektionsrisken för implantat är högst vid postoperativt hematom, tidig reoperation på grund av elektroddislokation och revisioner [2, 3]. Det är oklart om senareläggning av reoperation minskar denna risk. För oerfarna operatörer är infektionsfrekvensen nästan fördubblad jämfört med erfarna, där även kortare operationstider och färre reoperationer spelar en stor roll [2]. Likaså har lågvolymcentrum högre förekomst av implantatinfektioner jämfört med högvolymcentrum [5].
Riskfaktorer relaterade till typ av system inkluderar implantation av flera elektroder, mer komplexa system och större dosor, där ICD och framför allt CRT medför en ökad infektionsrisk jämfört med pacemaker [2, 3]. Epikardiella elektroder och abdominell placering av dosan är andra faktorer som ökar infektionsrisken [2].
Preventiva åtgärder. Hos patienter med mycket hög risk för postoperativa komplikationer behöver man både väga vinsten av implantation mot risker och överväga andra alternativ, såsom sladdlös pacemaker eller subkutan ICD [10]. Behandling av patientens övriga sjukdomar bör optimeras inför planerad implantation, dosbyte eller uppgradering [2, 10]. En god glykemisk kontroll pre- och postoperativt minskar infektionsrisken signifikant hos patienter med diabetes [2]. Vid medicinering med kortikosteroider bör man eftersträva lägsta effektiva dos [2, 10]. Patienter som behandlas med antikoagulantia har en högre risk för postoperativt hematom och därmed infektion [2]. Här rekommenderas en individuell anpassning, utifrån risken för tromboemboliska händelser. Så kallad överbryggning (bridging) med heparin eller lågmolekylärt heparin ökar risken för hematom i dosfickan femfaldigt och är inte indicerad ens vid mekanisk klaff [10, 11]. I stället bör warfarin behållas med INR inom terapeutiskt intervall [5, 10]. Trombocythämmare i form av P2Y12-hämmare bör sättas ut minst 5 dagar före ingrepp med undantag för vissa högriskgrupper, till exempel efter nyligen genomgången perkutan koronarintervention [2, 10].
Vid feber före implantation bör en pågående infektion misstänkas och behandlas, om möjligt med ett antibiotikafritt intervall före proceduren [2, 10]. Temporär transvenös pacemaker bör undvikas och annan behandling, som isoprenalininfusion eller beredskap för transkutan pacing, tillämpas [10].
Patientförberedelse med hud- och hårtvätt med klorhexidininnehållande medel, noggrann preoperativ avtvättning av operationsområdet med klorhexidin i etanol (5 mg/ml), samt en operationssal som uppfyller standardkrav avseende ventilation och sterilitet är av stor vikt i infektionsförebyggande syfte [10]. Preoperativ antibiotikaprofylax med kloxacillin eller klindamycin har en bevisad förebyggande effekt och bör ges intravenöst inom en timme från hudincisionen [10]. Ytterligare antibiotika rekommenderas inte efter avslutat ingrepp, då detta inte har visat sig minska infektionsrisken [12]. Användning av ett resorberbart kuvert med minocyklin och rifampicin som långsamt utsöndras kring dosan (Tyrx, Medtronic) har en infektionsförebyggande effekt hos högriskpatienter [4, 13]. En god operationsteknik med minimering av vävnadsskada, adekvat hemostas och slutligen en adekvat sårsuturering i flera lager är av yttersta vikt för att undvika hematom [10]. Både Svenska kardiologföreningen [14] och European Society of Cardiology rekommenderar certifiering av pacemaker-, ICD- och CRT-operatörer och har tagit fram riktlinjer för minimigränsen för rekommenderat antal ingrepp per år för att upprätthålla hög kvalitet, förhindra komplikationer och minska infektioner [5]. I Sverige genomförde dock knappt en tredjedel av landets operatörer det rekommenderade minimiantalet 20 CRT-implantationer per år 2020, enligt Svenska ICD- och pacemakerregistrets årsrapport.
För en mer detaljerad genomgång av riskfaktorer för implantatinfektion och deras prevention hänvisar vi till en nyligen publicerad översiktsartikel [10].
Mikrobiologi
De flesta implantatinfektioner utvecklas inom de första 6 månaderna efter ett pacemaker-, ICD- eller CRT-ingrepp, oftast inom de första 90 dagarna [2, 3]. Dessa tidiga infektioner kan bero på en kontamination under ingreppet, där patogener kan komma från patientens hud, operationsinstrumentariet, luftburet på grund av otillräcklig ventilation eller via operationspersonalen [5]. Vid tidiga infektioner dominerar Staphylococcus aureus. Enbart en tredjedel av infektioner debuterar kliniskt senare än ett år efter ingreppet, och dessa kan antingen vara relaterade till proceduren, om lågvirulenta bakterier har kontaminerat systemet, eller till en hematogen spridning från annat fokus [5]. Koagulasnegativa stafylokocker (KNS) är vanligast vid sena infektioner och efter revisioner. Stafylokocker anges i studier svara för 68–83 procent av alla infektioner och har en benägenhet att fästa på främmande material och bilda så kallad biofilm, vilket försämrar effekten av det egna immunförsvaret respektive antibiotikabehandling, och det kan förklara svårigheten att bota infektion med mindre än att extraktion utförs [15]. Mindre vanliga orsaker till infektioner (ca 10 procent) är gramnegativa bakterier och svamp [5].
Klinisk bild
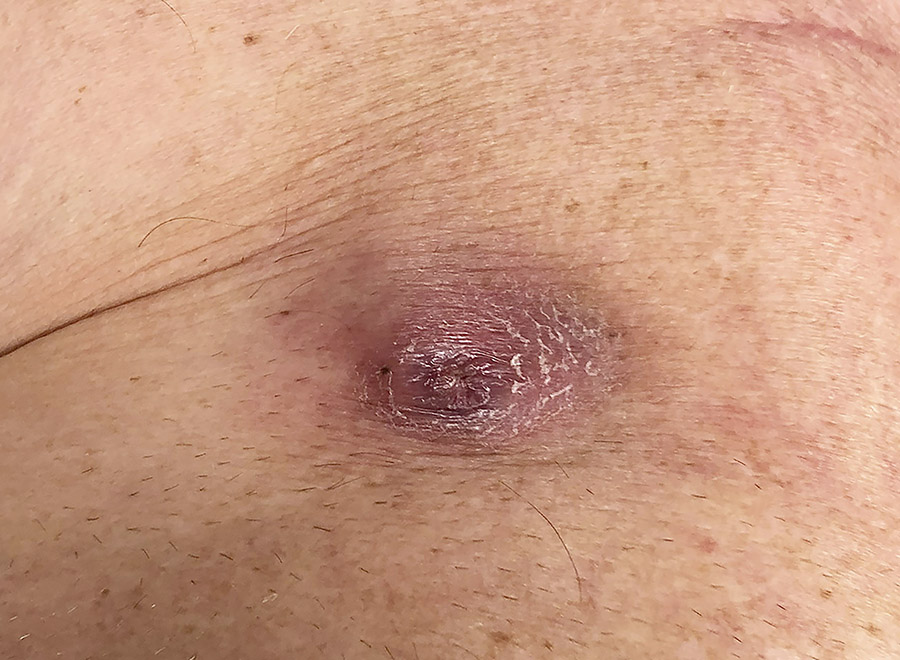
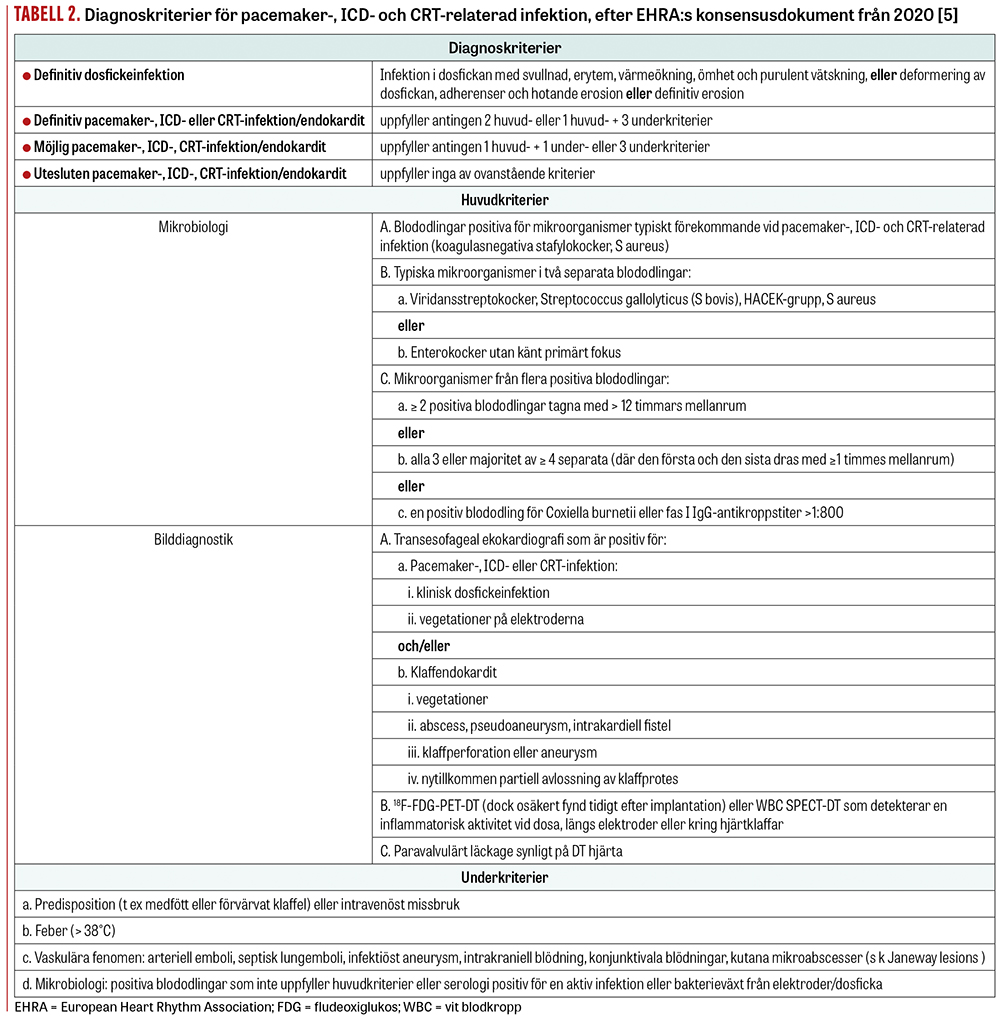
Symtombilden vid infektioner är heterogen och beror på etiologiskt agens, utbredning av infektionen, hematogen spridning och patientens övriga tillstånd. En infektion kan manifestera sig som enbart dosfickeinfektion eller som systemisk infektion (positiv blododling med eller utan vegetationer på elektrod eller hjärtklaff). Infekterad dosficka är inte obligat vid systemisk infektion [5]. European Heart Rhythm Association har nyligen publicerat nya riktlinjer för diagnostik av pacemaker-, ICD- och CRT-relaterade infektioner som delas in i fyra kategorier enligt särskilda kriterier baserat på resultat av blododling och bilddiagnostik (Tabell 2) [5]. Vid definitiv dosfickeinfektion utgörs lokala symtom av svullnad, rodnad, värmeökning (Figur 1), smärta och purulent sekretion, eller deformering av dosfickan, adherenser och hotande erosion, eller blottläggning av dosa eller elektroder [5]. Vid lågvirulenta patogener kan symtom från dosfickan variera över lång tid [5]. Definitiv systemisk infektion kännetecknas av antingen två huvudkriterier, som positiva blododlingar, klinisk dosfickeinfektion, vegetationer på elektrod eller klaff, eller ett huvud- och tre underkriterier, som predisposition (till exempel hjärtsjukdom eller intravenöst missbruk), feber, vaskulära fenomen och mikrobiologiska fynd som inte uppfyller huvudkriterier. Möjlig systemisk infektion omfattar antingen ett huvud- samt ett underkriterium eller tre underkriterier. Vid utesluten implantatinfektion/endokardit uppfylls inga av ovanstående kriterier. Tidiga och ytliga postoperativa sårinfektioner som inte involverar dosfickan ingår inte i begreppet pacemaker-, ICD- eller CRT-infektion [5].
Diagnostik och handläggning av infektioner
Vid klinisk misstanke om infektion eller vid oklar feber hos patient med pacemaker, ICD eller CRT ska följande utföras; minst tre blododlingar med förlängd odlingstid 10 dygn, odlingar från eventuella sår över dosfickan samt transesofageal ekokardiografi för att visualisera vetgetationer på elektroder och /eller klaffar [5]. Andra metoder såsom 18F-fludeoxiglukos-PET-DT kan underlätta diagnostiken [5].
Vid säkerställd implantatinfektion är en förutsättning för framgångsrik behandling en komplett extraktion av alla delar av systemet (klass I-indikation) samt samtliga centrala infarter som patienten har vid infektionstillfället [5]. Om en komplett extraktion inte är möjlig, på grund av exempelvis patientens val eller tekniska svårigheter, och enbart antibiotikabehandling tillämpas ökar den redan höga mortalitetsrisken kraftigt [16]. Ett transvenöst extraktionsingrepp bör utföras utan dröjsmål inom 3 dygn från diagnosen [5]. Utförandet bör ske på centrum med stor erfarenhet och certifierade pacemaker-, ICD- och CRT-operatörer [5]. I samband med extraktion bör vävnadsodlingar från dosficka och elektrodspetsar tas [5]. Vid endokardit med klaffengagemang, som i samråd med toraxkirurg bedöms kräva klaffkirurgi, extraheras elektroder och pulsgenerator i samband med öppen kirurgi (Figur 2).
Vid systemisk pacemaker-, ICD-eller CRT-infektion ges empirisk antibiotikabehandling i form av vankomycin och cefotaxim för att täcka stafylokocker, inklusive stammar med meticillinresistens, samt gramnegativa bakterier [5]. Antibiotikabehandlingen ges intravenöst under 4 veckor och anpassas efter svar på blododlingar och resistensmönster [5]. Vid växt av S aureus i blododlingar och/eller klaffvegetation ges ofta antibiotika i 4–6 veckor efter extraktion [5]. Vid isolerad dosfickeinfektion kan behandlingen efter extraktion övergå till att ges som peroral behandling under ca 10–14 dagar [5]. För behandlingsrekommendationer hänvisas till Infektionsläkarföreningens vårdprogram för infektiös endokardit (www.infektion.net).
Beslut om reimplantation bör övervägas noga eftersom en väsentlig andel av patienterna saknar fortsatt indikation för pacemaker, ICD eller CRT efter extraktion [17, 18]. Om reimplantation är indicerad bör denna fördröjas så länge som möjligt efter extraktion och genomföras först när alla lokala infektionstecken är utläkta, infektionsparametrarna normaliserats och tidigast efter att blododlingar varit negativa i minst 72 timmar [5]. Reimplantation bör göras i ett icke-infekterat område, i regel på motsatta sidan [5]. Alternativa system med lägre infektionsrisk, såsom sladdlösa pacemakrar eller subkutana ICD, kan övervägas [5].
Komplikationer och överlevnad efter infektion
Pacemaker-, ICD- eller CRT-relaterad infektion medför en mortalitetsrisk på 6–15 procent under första året och 14–33 procent de första tre åren, vilket är 1,5–2,4 gånger högre jämfört med personer med dessa implantat utan infektion [5, 7]. Prognosen är ännu sämre hos patienter med hög komorbiditet, särskilt vid avancerad njursvikt [19]. Systemisk infektion och i synnerhet endokardit medför betydligt sämre prognos än enbart dosfickeinfektion [5].
En tidig extraktion av hela systemet är avgörande för prognosen, och vinsten med extraktion överväger oftast risken för komplikationer (2–3 procent risk för allvarliga komplikationer inkluderande en mortalitet på 0,5–1,2 procent) [1]. Fördröjd extraktion medför ökad mortalitet, längre sjukhusvård samt högre kostnader [5, 16]. Vid konservativ behandling med antibiotika utan extraktion rapporteras mortaliteten under första året uppgå till 44 procent, och dessutom har dessa patienter en hög risk för recidiv av infektion [20]. I samband med infektion kan även andra allvarliga komplikationer tillstöta, såsom abscesser, septiska embolier, destruktion av hjärtklaffar, multiorgansvikt eller njursvikt [5].
Rapportering av komplikationer till nationella register
Prevalensen av infektioner och komplikationer relaterade till pacemaker, ICD eller CRT har i vissa studier och register rapporterats vara låg, ca 1–2 procent [2, 9]. En betydligt högre infektionsfrekvens rapporterades nyligen vid reoperationer av CRT från danska kohortstudier [4]. I en nyligen publicerad rapport från ett svenskt centrum baserad på detaljerad journalgranskning från samtliga CRT-ingrepp under en tvåårsperiod uppgick frekvensen infektioner till 7 procent och allvarliga komplikationer till 36,8 procent [20]. Man fann även en betydande underrapportering till Svenska ICD- och pacemakerregistret (prevalens 0,6 procent respektive 4,1 procent) [21]. Rapporten är en varningssignal om att underrapportering och kvalitetsproblem kan föreligga även vid andra centrum, då underrapportering till nationella register har belysts i flera tidigare publikationer [2, 8].
Underrapportering av komplikationer till register undergräver våra möjligheter till förbättrad verksamhet och utbildning. Ansvaret för rapportering åligger alla verksamheter som handlägger dessa patienter – både opererande centrum och sjukhus som vårdar patienter med komplikationer. En mer öppen och fortlöpande redovisning av komplikationer och infektioner kan sannolikt förbättra rapportering till register samt underlätta tidiga preventiva åtgärder. Professionell granskning utförd av externa personer kan vara ett sätt att bedriva kontroll men är resurskrävande och kan bidra till en selektion, där man väljer att inte operera högriskpatienter på det egna centrumet. På sikt bör man kunna göra kvalitetskontroller via diagnoskoder, där komplikationer paras ihop med pacemaker-, ICD- eller CRT-diagnos.
Slutsatser och rekommendationer
Den ökade infektionsfrekvensen hos patienter med pacemaker, ICD eller CRT beror sannolikt på utvidgade indikationer med användning av mer komplexa system hos allt fler äldre patienter med högre grad av samsjuklighet. Beslut om implantation bör alltid vara välgrundat och noga genomtänkt, med övervägande av alla risker och hänsyn tagen till patientens riskprofil kontra vinsten med behandlingen. Preventiva åtgärder som optimering av patientens övriga sjukdomar och läkemedelsbehandling, undvikande av centrala infarter samt temporär pacemaker är essentiella för att minska infektionsrisken. Hos högriskpatienter bör placering av pulsgeneratorn i ett antibakteriellt kuvert övervägas, särskilt vid tidigare implantatinfektion, reoperation eller dosbyte.
Infektioner hos patienter med pacemaker, ICD eller CRT bör handläggas på centrum med stor erfarenhet och hög kompetens och sköts bäst i multidisciplinära team där pacemakerspecialiserad kardiolog, infektionsläkare, klinisk fysiolog och toraxkirurg ingår. Vid säkerställd implantatinfektion bör hela systemet extraheras och empirisk antibiotikabehandling styras av blododlingar och resistensmönster. Beslut om reimplantation bör föregås av en ytterligare fördjupad diskussion om huruvida indikation för implantatet fortfarande föreligger och vinsten med ingreppet överväger risken för ny infektion, samt övervägande av sladdlös pacemaker eller subkutan ICD.
En strukturerad utbildning av pacemaker-, ICD- och CRT-operatörer med god handledning, krav på certifiering samt följsamhet till riktlinjer om rekommenderat minsta antal ingrepp per år är nödvändig. Även pacemakersköterskor och personal på uppföljande centrum bör genomgå upprepad utbildning. Dessa åtgärder tillsammans med en förbättrad rapportering till kvalitetsregistret genom professionell granskning och/eller diagnoskoder ökar sannolikt möjligheterna till en välfungerande pacemaker-, ICD- och CRT-verksamhet med låg komplikationsfrekvens.
Läs även:
Författarintervju: 5 frågor till Anna Björkenheim
Medicinsk kommentar: Kvalitetsregister – viktig del av patientsäkerhetsarbetet
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2022-04-25)