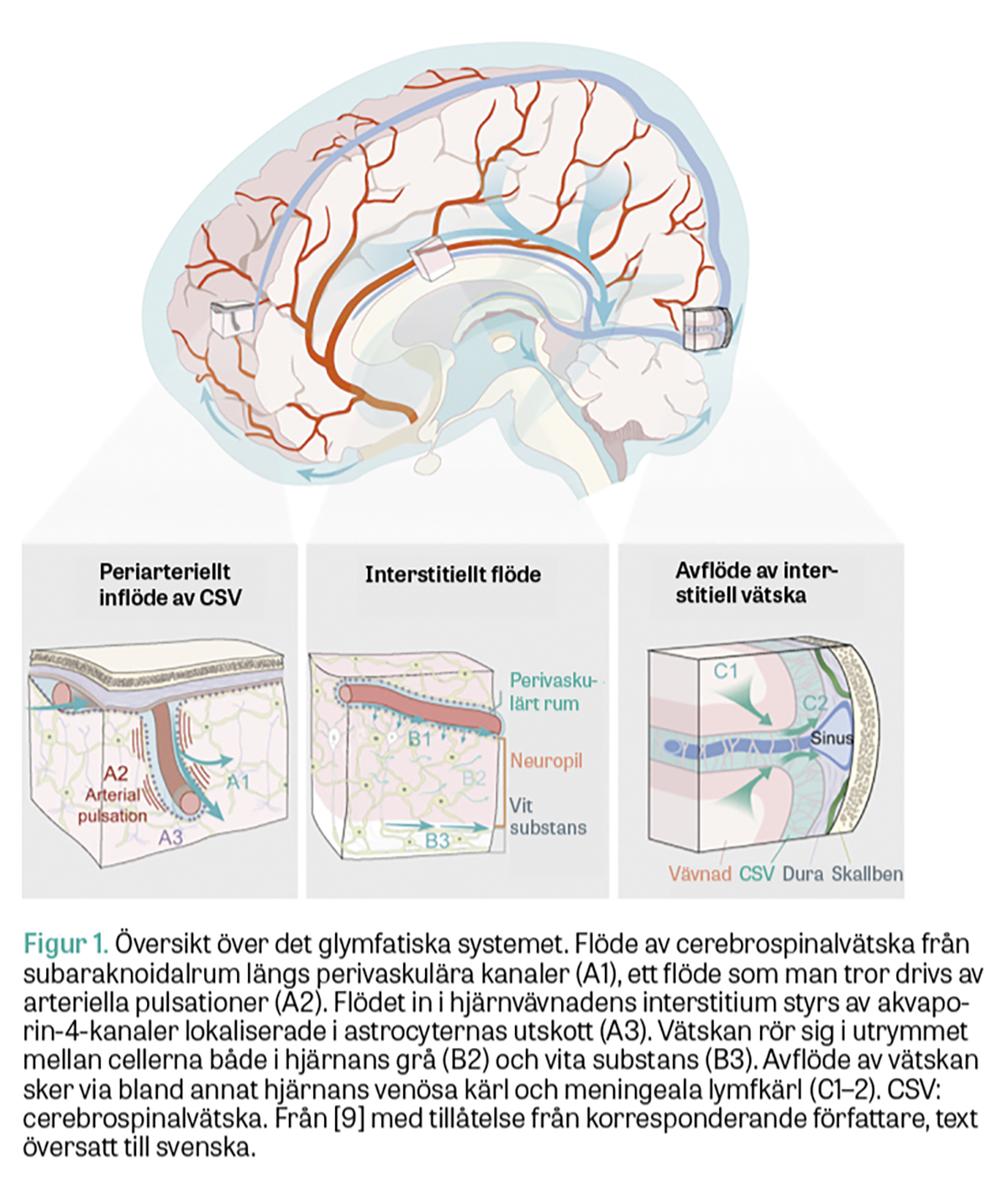
Via det glymfatiska systemet kan cerebrospinalvätska flöda genom hjärnvävnaden.
Systemet har till uppgift att rena hjärnvävnaden genom att föra bort slaggprodukter.
Flödet i det glymfatiska systemet ökar under sömn.
Studier antyder att sjukdomar som alzheimer och hydrocefalus skulle kunna vara orsakade av störningar i det glymfatiska systemet.
Det är nu drygt 10 år sedan begreppet »glymfatiska systemet« introducerades och vår syn på cirkulationen av cerebrospinalvätskan i centrala nervsystemet fick revideras [1]. Mycket är fortfarande oklart, men kunskapsmassan inom detta forskningsfält ökar just nu snabbt. De första studierna byggde på experiment på djur, men man har nu också kunnat visa att det glymfatiska systemet finns hos människa och att det delvis går att avbilda och även kvantifiera med MR-teknik [2, 3]. Flera studier pekar också på det glymfatiska systemets roll vid olika sjukdomsprocesser i hjärnan. I denna översikt försöker vi presentera en del av det nuvarande kunskapsläget och systemets roll vid olika neurologiska tillstånd och vid skalltrauma.
Bakgrund och anatomi
För snart 110 år sedan kunde Lewis Weed, neurokirurg vid Harvard Medical School i Boston, visa att ett färgämne försiktigt injicerat i cerebrospinalvätskan snart dök upp i halsens lymfkörtlar. Därmed visade han att dränaget av cerebrospinalvätskan inte bara sker till hjärnans venösa system utan också till det lymfatiska systemet [4]. Under det kommande seklet har ett flertal studier visat att den modell av cirkulationen av cerebrospinalvätskan som beskrivs i läroböcker, med produktion i plexus choroideus, cirkulation genom ventrikelsystemet och i subaraknoidala rummet och därefter tömning till hjärnans venösa avflödeskärl, inte är komplett.
För 10 år visade Iliff et al att cerebrospinalvätska också flödar genom hjärnvävnadens interstitium, det vill säga i utrymmet mellan cellerna [1]. Genom att injicera ett litet fluorescerande spårämne i cerebrospinalvätskan kunde man med så kallad tvåfotonmikroskopi avbilda hur cerebrospinalvätskan flödar från subaraknoidalrummet in genom hjärnvävnaden. Vätskan når interstitiet från subaraknoidalrummet via kanaler som följer artärer ned i hjärnvävnaden (Figur 1). Dessa perivaskulära kanaler, kallade »Virchow–Robin space«, beskrevs redan på 1850-talet, men deras funktion har varit okänd. Runt dessa kanaler finns utskott från astrocyter, en av hjärnans olika typer av gliaceller. Utskotten är försedda med akvaporin-4-kanaler (AQP4), som man tror reglerar flödet av cerebrospinalvätska in i utrymmet mellan hjärncellerna [1]. Cerebrospinalvätskan flödar i interstitiet och samlas sedan upp i perivaskulära kanaler runt vener. Från dessa venösa perivaskulära kanaler kan sedan vätskan nå halsens lymfsystem.
Iliff et al föreslog att systemet skulle kallas för det glymfatiska systemet (glia-lymfatiska systemet), då det bygger på vattenflöde styrt av gliaceller och till viss del liknar kroppens lymfatiska system [1].
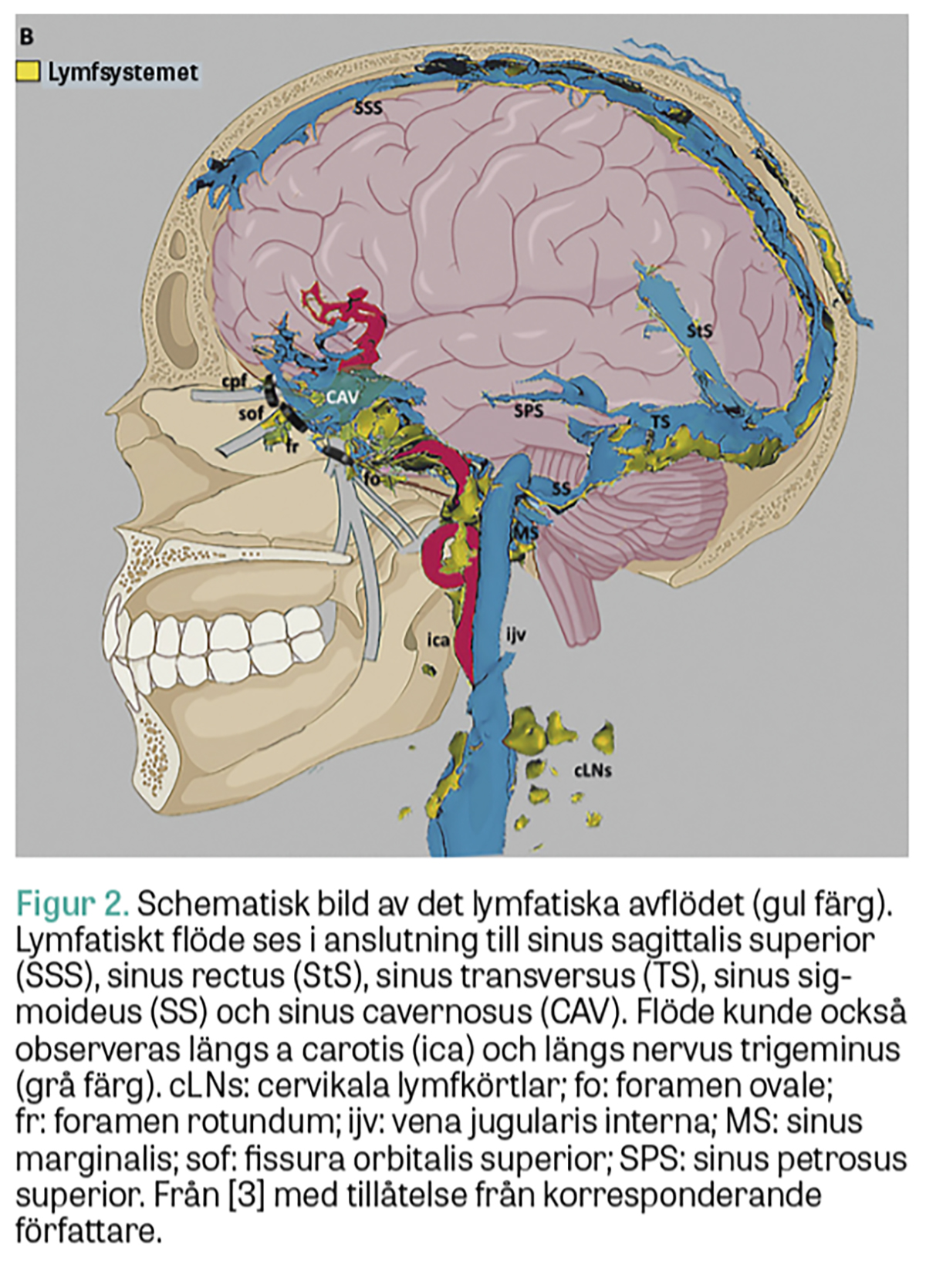
Kopplingen mellan de ovan nämnda perivaskulära kanalerna och det lymfatiska systemet fick sin förklaring 2015 när man upptäckte ett lymfatiskt system beläget i dura mater, den hårda hjärnhinnan, hos möss [5]. Man kunde också påvisa liknande strukturer i människans dura mater [6]. Det rörde sig dock egentligen om en återupptäckt, då Mascagni redan 1787 beskrivit förekomsten av lymfkärl i dura mater hos människa [7].
I en studie från 2022 har man nu med MR-kamera, som möjliggjorde detektion av lågflödessystem, kartlagt detta system hos människa (Figur 2). Tredimensionella rekonstruktioner visar hur det lymfatiska flödet sker längs sinus sagittalis, sinus rectus, transversus och sigmoideus och sinus cavernosus. Vätskan kan därefter via extrakraniella lymfatiska kärl nå cervikala lymfkörtlar [3].
Funktion och sömnens betydelse
Redan i den första artikeln om glymfatiska systemet visade man att systemet spelar roll vid bortforslande av beta-amyloid (Aβ), ett i hjärnan naturligt förekommande protein som också ingår i de plack som ses hos patienter med Alzheimers sjukdom [1]. Den föreslagna funktionen hos systemet är att vätskeflödet genom hjärnvävnaden drar med sig avfallsprodukter och därmed kan sägas fungera som en hjärntvätt. Möss som på grund av genetisk knockout saknar akvaporin-4 visade sig ha kraftigt nedsatt flöde av vätska i hjärnvävnadens interstitium och ökad förekomst av beta-amyloid [1].
2013 kunde man påvisa att flödet i det glymfatiska systemet påverkas av sömn [8]. Naturlig sömn eller anestesi ökade flödet av vätska i hjärnans interstitium, och denna ökning leder till ökat bortforslande av beta-amyloid från hjärnvävnaden. Därmed kunde man presentera en ny funktion hos sömnen: hjärnan renas från de potentiellt neurotoxiska ämnen som ansamlats i vaket tillstånd.
Möjlig klinisk signifikans vid sjukdomstillstånd
När det gäller det glymfatiska systemets betydelse vid olika sjukdomstillstånd är mycket fortfarande oklart, men de senaste åren har studier publicerats där dess möjliga kliniska relevans diskuteras. Det gäller dels sjukdomar som skulle kunna förklaras av dysfunktion i systemet, som Alzheimers demens, dels sjukdomar som i sig skulle kunna leda till dysfunktion och därmed påverka sjukdomsförloppet, till exempel tillstånd när blod kommer in i cerebrospinalvätskan.
Metoder för att analysera systemets funktion hos människa bygger framför allt på MR-tekniker [9]. Genom att injicera ett kontrastmedel i cerebrospinalvätskan och därefter följa kontrastmedlets förlopp genom hjärnvävnaden med upprepade MR-undersökningar kan funktionen till viss del kvantifieras. En annan MR-teknik, som bygger på diffusiontensoranalys, så kallad DTI-ALPS (diffusion tensor image analysis along the perivascular space), kan icke-invasivt kvantifiera vattendiffusionen längs de perivaskulära kanalerna.
Degenerativa hjärnsjukdomar. Då Iliff et al 2012 visade att systemet hade betydelse för borttransport av betaamyloid spekulerade man redan i den första artikeln om systemets roll vid degenerativa hjärnsjukdomar [9]. Som nämnts ovan ses plack med beta-amyloid histologiskt vid Alzheimers demens, medan man hos patienter med Parkinsons sjukdom finner ansamling av proteinet alfa-synuklein i form av Lewykroppar. Ett flertal studier har påvisat avvikande uttryck av akvaporin-4 hos patienter med Alzheimers demens [10], och MR-studier med DTI-ALPS-teknik har påvisat avvikelser både hos patienter med Alzheimers demens och med Parkinsons sjukdom [11].
Glymfatiska systemet har också studerats hos patienter med multipel skleros (MS), en inflammatorisk demyeliniserande sjukdom. Patienterna uppvisade försämrad glymfatisk funktion jämfört med en kontrollgrupp, och man såg även en mer uttalad dysfunktion hos patienter i progressiv fas av sjukdomen [12].
Normaltryckshydrocefalus ger symtom i form av kognitiv svikt, balans- och gångsvårigheter samt inkontinens. Datortomografi av hjärnan visar ett vidgat ventrikelsystem, men det intrakraniella trycket är inte förhöjt. Orsaken har varit okänd, men det finns studier som pekar mot att det glymfatiska systemet kan spela roll. När systemets funktion har analyserats genom injektion av kontrastmedel i cerebrospinalvätskan har försämrat glymfatiskt flöde noterats hos patienter med normaltryckshydrocefalus jämfört med kontroller [2]. Med DTI-ALPS-teknik har man visat att patienter med tillståndet har ett lägre ALPS-index, vilket tolkas som försämrad funktion i det glymfatiska systemet [13]. Post mortem-studier av hjärnor från patienter med normaltryckshydrocefalus har dessutom visat på minskad förekomst av akvaporin-4 [14]. Tillståndet behandlas med inläggning av en shunt som leder en del av cerebrospinalvätskan till bukhålan eller den stora hålvenen, och studier har kunnat påvisa förbättrat vätskeflöde längs perivaskulära kanalerna efter shuntoperation [15].
Ischemisk stroke. Ischemisk stroke leder, förutom till död av nervvävnad, ofta också till hjärnsvullnad. Hjärnsvullnaden bidrar till morbiditet, och även mortalitet, då den kan leda till högt intrakraniellt tryck och inklämning, vilket man till exempel kan se vid malign mediainfarkt. Det finns ingen effektiv medicinsk behandling för att minska denna typ av hjärnödem. Det finns ett antal artiklar som pekar mot att hjärnsvullnaden åtminstone delvis är orsakad av flöde av cerebrospinalvätska in i hjärnvävnaden. I en musmodell har man visat att flödet av cerebrospinalvätska längs de perivaskulära kanalerna ökar redan minuterna efter en ischemisk stroke [16]. Detta indikerar att cerebrospinalvätskan spelar roll för utvecklingen av hjärnödemet. Vid undersökningar post mortem av hjärnor från patienter med ischemisk stroke har man påvisat ökad förekomst av vätska i hjärnvävnaden just i anslutning till de perivaskulära kanalerna [16]. Med den ovan nämnda DTI-ALPS-tekniken har man också funnit försämrad funktion i det glymfatiska systemet hos patienter med genomgången ischemisk stroke [17].
Subaraknoidalblödning. Spontan subaraknoidalblödning beror oftast på ett sprucket aneurysm och leder till att blod kommer in i cerebrospinalvätskan. Trots tidig åtgärd av aneurysmet för att förhindra reblödning har sjukdomen fortsatt en betydande morbiditet och mortalitet. Patienterna uppvisar ofta störningar i blodflödet till hjärnan (kärlspasm) och problem med cirkulationen av cerebrospinalvätska. I en råttmodell för subaraknoidalblödning har man kunnat visa att det glymfatiska systemets funktion försämras, med minskat flöde av cerebrospinalvätska in i hjärnan och minskat interstitiellt flöde [18]. I en musmodell har man påvisat ökad ansamling av tau, även detta ett naturligt förekommande protein i hjärnan men med koppling till Alzheimers sjukdom. Subaraknoidalblödning bedömdes leda till försämrad rening av hjärnvävnaden, och man fann också en efterföljande nedsatt neurologisk funktion [19].
Traumatisk skallskada. Förhöjt intrakraniellt tryck är en faktor som är associerad med sämre utfall och död efter traumatisk hjärnskada. I en musmodell har man påvisat försämrad funktion i det meningeala lymfatiska systemet redan två timmar efter traumat, och den nedsatta funktionen fanns kvar också en månad senare [20]. Teorin bakom dysfunktionen är att ett förhöjt intrakraniellt tryck komprimerar de meningeala lymfatiska kärlen och därmed minskar avflödet. Man har också påvisat att möss, där man före traumat stängt de meningeala lymfatiska kärlen, fick försämrad kognitiv funktion jämfört med en kontrollgrupp vid uppföljande test [20]. Detta skulle kunna vara en förklaring till att även lindriga upprepade skalltrauman är skadliga [21, 22] – ett tidigare skalltrauma ger en långdragen försämring av det lymfatiska avflödet från hjärnan, vilket innebär en ökad känslighet vid nästkommande skalltrauma. Studier på möss har också visat att lindrig traumatisk skallskada kan leda till relokalisation av akvaporin-4-kanalerna bort från astrocytutskotten, vilket leder till försämrad funktion i det glymfatiska systemet, och man spekulerar om detta också kan bidra till ökad känslighet vid förnyat skalltrauma [23, 24].
Kan funktionen i glymfatiska systemet manipuleras?
Det enkla sättet att förbättra det glymfatiska systemets reningsfunktionen av hjärnan är att sova, och det finns ett flertal studier som pekar på sambandet mellan dålig sömn och degenerativa hjärnsjukdomar [25]. I den kliniska vardagen är återkommande väckning en del av övervakningen av patienter med akuta neurologiska tillstånd, men huruvida denna rutin negativt påverkar den glymfatiska funktionen är oklart. Det finns också studier som visar att fysisk aktivitet ökar det glymfatiska flödet [26].
Vad gäller farmakologisk påverkan har man i djurmodeller visat att substanser med osmotisk effekt, som hyperton koksaltlösning och mannitol, ökar flödet av vätska genom hjärnvävnaden [26]. Djurstudier har också visat att mannitol kan minska ansamlingen av alfa-synuklein, och studier där mannitol ges till patienter med Parkinsons sjukdom pågår [27]. I en musmodell av subaraknoidalblödning har man påvisat en förbättrad funktion i det glymfatiska systemet av nimodipin, en kalciumantagonist som ges till patienter med subaraknoidalblödning för att minska den kärlspasm som kan leda till ischemi i hjärnan. I studien noterade man bland annat en påverkan på akvaporin-4-kanalerna efter administration av nimodipin [28]. Det finns dock, så vitt vi vet, i dag inga läkemedel som har som godkänd indikation att påverka det glymfatiska systemet.
Läs författarintervju: 6 frågor till Thomas Skoglund
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
(uppdaterad 2023-04-12)