Viskoelastiska hemostatiska instrument (VHA) är komplement i värderingen av hemostas, framför allt vid akuta blödningssituationer då de ger snabb information.
VHA har utvärderats vid blödning inom trauma, obstetrik och hjärt- och leverkirurgi, där VHA-styrda algoritmer kan optimera behandling med koagulationsfaktorer och transfusion av plasma och trombocyter.
VHA har flera begränsningar, exempelvis låg precision. Effekter av antikoagulantia, trombocythämmande läkemedel och ärftliga blödningsrubbningar kan inte alltid detekteras.
VHA bör kvalitetskontrolleras regelbundet. Elektronisk överföring av provresultat till patientjournal är önskvärd.
Det är inte alltid så enkelt att värdera hemostasen i akuta situationer. Det finns flera blodprov som kan vara till hjälp vid akut blödning. Ofta analyseras protrombinkomplex (PK), aktiverad partiell tromboplastintid (APTT), trombocytantal och fibrinogenkoncentration, vilka ger viss vägledning. Det tar ofta lång tid (30–60 minuter) att få svar på dessa analyser, vilket är en nackdel i en akut blödningssituation där snabb handläggning är avgörande.
I ett icke-akut skede kan mer avancerade analyser av hemostasen göras som framför allt syftar till att ge svar på om orsaken till en blödning kan vara att patienten har en ärftlig blödningsrubbning.
Viskoelastiska hemostatiska instrument (viscoelastic homeostatic assays, VHA) kan ses som ytterligare en pusselbit i hemostasanalysen. Då analyserna utförs på helblod är en fördel att man kan få snabbare svar, vilket gör VHA användbara i akuta situationer, oftast pågående blödning. Här följer en uppdatering av kunskapsläget sedan föregående översikt [1].
VHA mäter förändringar i viskositet och elasticitet i ett koagulerande blodprov. Två av de vanligaste metoderna är tromboelastometri (ROTEM) och tromboelastografi (TEG), som har många likheter, men analysresultaten är inte direkt jämförbara. TEG har funnits längre, medan ROTEM är vanligare i Sverige.
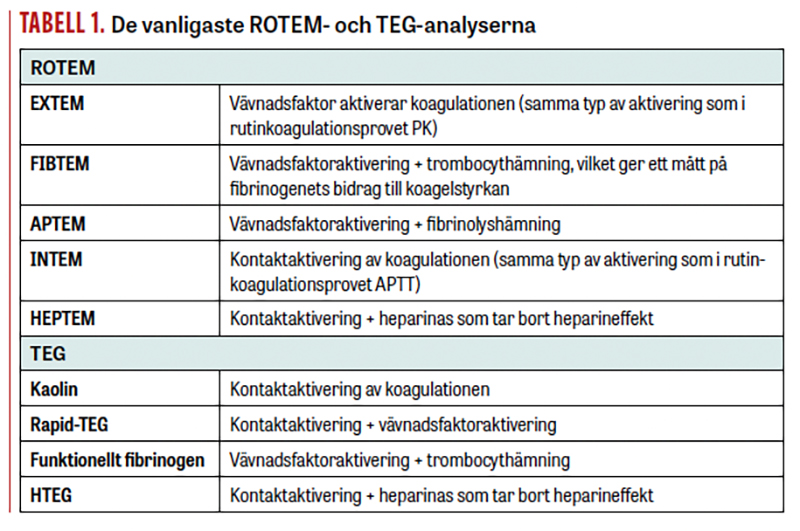
För ROTEM/TEG-analys tillsätts en aktivator av koagulationen till helblod. Ett plaströr (»pin«) roterar i förhållande till blodprovet (som finns i en plastkyvett, »cup«). När blodet koagulerar ändras viskositet och elasticitet och det blir trögare för röret att rotera i förhållande till blodprovet. Detta registreras i form av amplitudökning i en kurva (Figur 1) [2]. Tillsats av olika aktivatorer och hämmare av hemostasen ger ytterligare information. I Tabell 1 ses de vanligaste analyserna. De olika parametrarna besvaras med numeriska värden som presenteras tillsammans med ROTEM/TEG-kurvan och kan jämföras med referensintervall. Helhetstolkningen av ett tromboelastogram kräver utbildning och metodförståelse. De senaste versionerna av ROTEM (Sigma) och TEG (6S) är helt automatiserade, det vill säga kräver inte pipettering av provmaterialet.
Information som fås med ROTEM/TEG
I Figur 1 ses en klassisk ROTEM, ett tromboelastogram, med parametrarna:
- CT (clotting time) för ROTEM, vilket motsvaras av R för TEG. CT är tiden från koagulationsaktivering fram till start av koagulationen. Förlängd CT eller R beror oftast på brist på koagulationsfaktorer och/eller antikoagulantiabehandling.
- MCF (maximum clot firmness) för ROTEM, vilket motsvaras av MA (maximum amplitude) för TEG. MCF är kurvans maximala amplitud. A5 och A10 för ROTEM är amplitud redan vid 5 respektive 10 min efter CT. Amplituden påverkas av fibrinogenkoncentrationen och trombocytantalet, men även av koncentrationen av koagulationsfaktor XIII. Låg hematokrit kan ge högre amplitud, men det är ett in vitro-fenomen [3].
- LI60 (lysis index 60; amplituden i procent av MCF) och ML (max lys) för ROTEM indikerar fibrinolys. Motsvarande variabler finns för TEG, till exempel LY30. Om kurvan smalnar av snabbt och mycket (amplitudsänkning efter maxamplitud) kan det vara ett tecken på ökad fibrinolys, det vill säga att koaglet löses upp. ML mäts kontinuerligt efter MCF, medan LI60 mäts 60 min efter CT. ML är hur många procent maxamplituden minskat. Till exempel: LI60 85 procent = ML 15 procent. Det finns fallgropar i tolkning av fibrinolys, se nedan.
Vilka patienter har nytta av VHA och när?
VHA är framför allt användbara vid stora pågående blödningar för att styra behandling med blodprodukter och koagulationsfaktorkoncentrat. Vid pågående allvarlig blodförlust rekommenderas empirisk behandling enligt 4:4:1-konceptet, med transfusion i kvoten 4 enheter erytrocytkoncentrat, 4 enheter plasma och 1 enhet trombocytkoncentrat [4, 5]. ROTEM/TEG kan användas för vidare finjustering [6]. Många användare rekommenderar en algoritm med beslutsgränser för att standardisera tolkningen av resultaten [7], och flera intensivvårdsavdelningar i landet har tagit fram egna algoritmer (Tabell 2) som inkluderar övrig provtagning.
För den akut blödande patienten (till exempel vid trauma och obstetrik) är det vanligen lämpligt att, för ROTEM, fokusera på EXTEM- och FIBTEM-analys. Om man misstänker en heparineffekt kan även INTEM och HEPTEM vara av värde, och om man vill närmare undersöka fibrinolys kan APTEM vara användbart.
Vid tolkning av ROTEM ligger starkt fokus på att optimera fibrinogennivåer, det vill säga att uppnå en adekvat amplitud på FIBTEM-kurvan. Genom att trombocytbidraget är hämmat i FIBTEM-analysen kan mängden funktionellt fibrinogen bedömas.
Det är viktigt att betona att behandling av allvarlig blödning med pågående blodförlust kräver flera högprioriterade åtgärder. VHA är av lägre prioritet, men kan vara ett komplement i handläggningen. Vid avstannad blödning gäller vanligen mer återhållsam korrektion av avvikande VHA-fynd. Upprepa gärna analysen vid fortsatt blödning och för att utvärdera insatta åtgärder. Vid långdragen blödning och försämrad hemostas, trots transfusioner av blodprodukter, fibrinogenkoncentrat, tranexamsyra och optimering enligt VHA-resultat, kan det bli aktuellt att ge andra faktorkoncentrat, se Tabell 2.
Det är osäkert om VHA kan vara användbara för att värdera trombosrisk. Hyperkoagulabilitet är bara en del av Virchows triad för trombosutveckling, och det kan vara svårt att bedöma en individs trombosrisk med en enskild analys [8]. VHA-metodiken förefaller känslig nog för att registrera hyperkoagulabilitet såsom en kort CT/R och en ökad MCF/MA. Det saknas dock uppgifter om beslutsgränser för exempelvis behandling med antikoagulantia och om metodernas användbarhet som prediktor av till exempel venös tromboembolism [8, 9].
VHA kan i viss mån detektera koagulopatier (både hypo- och hyperkoagulopati) vid sepsis, men förändringar i VHA-parametrar har i metaanalyser visats vara heterogena [10, 11].
Covid-19 innefattar också en ökad trombosrisk. Ett vanligt fynd har varit ett hyperkoagulabelt tillstånd med markant förhöjd MCF (EXTEM och FIBTEM) redan tidigt i vårdförloppet, och mest uttalat hos patienter med svårast sjukdom [2, 12]. Det är dock oklart hur väl VHA faktiskt förutspår risken för trombos hos covid-sjuka och huruvida VHA kan hjälpa till att styra antikoagulantiabehandlingen [12, 13].
VHA med tillverkarens egna reagens är inte känsliga för medfödda brister i hemostasen såsom hemofili och von Willebrands sjukdom [2, 14].
För att påvisa ärftliga trombocytdefekter behövs en särskild modul till ROTEM, så kallad ROTEM platelet analysis, som använder aggregometri på liknande sätt som i instrumentet Multiplate. Modulen möjliggör även mätning av effekten av trombocythämmande läkemedel [15].
Detekterar VHA antikoagulation/trombocythämning?
Svaret är delvis, men normal VHA utesluter inte effekt av flera av de antitrombotiska läkemedlen. Vid blödning, undersök alltid om patienten har behandling med antikoagulantia och/eller trombocythämning som kan reverseras. ROTEM-analys med INTEM och HEPTEM är användbar för att detektera effekt av ofraktionerat heparin, som ses som en förlängd CT i INTEM som korrigeras i HEPTEM. Lågmolekylärt heparin påverkar i varierande omfattning VHA-resultaten beroende på preparat och dos [16, 17].
ROTEM EXTEM CT korrelerar till PK(INR) vid warfarinbehandling och har visats ha hög sensitivitet och specificitet för att detektera förhöjt PK(INR) >1,2 med Owren-metoden, som används i Norden [18]. Patienter med terapeutisk warfarinbehandling (PK(INR) 2–3) kan emellertid fortfarande ha CT inom referensintervallet, vilket begränsar användbarheten [19].
Direktverkande orala antikoagulantia (DOAK) kan förlänga ROTEM CT, men kvantitativ monitorering av läkemedelseffekt är inte tillförlitlig med VHA [16]. Vid en akut blödning där frågeställningen är om DOAK kan vara orsak, kan ROTEM vara ett komplement genom att höga läkemedelsnivåer kan påvisas. Terapeutiska eller låga läkemedelsnivåer kan emellertid inte uteslutas [16, 20, 21].
Trombocytkomponenten (som bidrar till amplituden) i VHA är i huvudsak relaterad till antalet trombocyter. Koagulationsaktiveringen i VHA är i de flesta analyser stark, och stora mängder trombin genereras som gör att andra signalvägar för trombocytaktivering hamnar i skymundan. Detta är den huvudsakliga orsaken till att VHA är okänsliga för trombocythämmande läkemedel, vars verkningsmekanism är att hämma ADP-receptorer (till exempel klopidogrel, prasugrel och tikagrelor) eller tromboxan A2-syntes (till exempel acetylsalicylsyra) [22]. Det finns möjlighet att analysera trombocytfunktionen med tilläggsanalyser enligt ovan.
Fallgroparna vid tolkning av fibrinolys med VHA
För ROTEM anges ofta att EXTEM LI60 <85 procent indikerar fibrinolys; det motsvarar även ML ≥15 procent. Det finns flera problem när man tolkar fibrinolys med VHA, bland annat kan de vara okänsliga för kliniskt signifikant fibrinolys [23].
Ett annat problem är att en liten amplitudsänkning från maxamplitud (EXTEM LI60 ca 85–99 procent) inte behöver tala för fibrinolys, utan kan vara en effekt på koaglet av trombocyter. Detta är omdebatterat i VHA-sammanhang [24], och möjliga orsaker är ett fenomen som kallas koagelretraktion [25], alternativt uttröttade kontraktila krafter hos trombocyterna [26]. Denna trombocyteffekt på koaglet syns inte i FIBTEM, där trombocyterna är starkt hämmade [25]. Vidare menar vissa att avsaknad av amplitudsänkning kan tyda på »shut-down« av fibrinolyssystemet – men detta kan ifrågasättas [24].
Diagnostiken av fibrinolys med ROTEM kan bland annat skärpas om man jämför EXTEM med APTEM [27]. En normal ROTEM eller TEG ska inte utesluta behandling med tranexamsyra när det är kliniskt indicerat – till exempel tidigt vid trauma med blödning och vid obstetrisk blödning [7, 28-30].
Evidens för VHA i kliniken
VHA har framför allt undersökts vid blödning inom trauma, obstetrik, hjärtkirurgi och levertransplantation. Flera systematiska genomgångar och metaanalyser har visat att VHA som stöd vid blödning minskar behovet av transfusion av blodprodukter, och vissa indikerar även en del mått på förbättrad utgång för patienter, inklusive lägre dödlighet [31-35]. De flesta inkluderade studier avser elektiv hjärtkirurgi, och evidensgraden kan generellt betraktas som låg.
Vid trauma är bland annat hyperfibrinolys och låg amplitud sett med VHA associerade med ökad sjuklighet och dödlighet samt kan förutspå behov av massiv transfusion [36]. Aktuella europeiska riktlinjer för allvarlig blödning vid trauma rekommenderar användning av VHA (evidensklass 1C) [30]. Nyligen publicerades Itactic-studien, som undersökte VHA (ROTEM och TEG) jämfört med rutinkoagulationsprov för att styra behandling med plasma, trombocyter och fibrinogenkoncentrat vid trauma med blödningschock [37]. Den primära effektvariabeln var överlevnad (utan massiv pågående transfusion) vid 24 timmar. Det var ingen skillnad mellan grupperna vare sig i den primära eller i de sekundära effektvariablerna. Resultaten uteluter inte, på grund av ett flertal faktorer i studiedesignen, att VHA kan användas för optimering av transfusioner av blodprodukter och behandling med fibrinogenkoncentrat.
Under graviditet förändras VHA-variabler vanligtvis åt det hyperkoagulerande hållet [38]. Låg ROTEM FIBTEM MCF (A5 < 12 mm) vid pågående postpartumblödning förutspår progress till transfusionskrävande blödning [39]. Associationer mellan användandet av ROTEM-styrda algoritmer för obstetrisk blödning och minskat transfusionsbehov, färre hysterektomier och kortare sjukhusvistelse har observerats i retrospektiva studier [40, 41].
Hemostasrubbning vid leversjukdom kan vara komplex. Trots till exempel förlängd PK och trombocytopeni kan patienten ändå vara hyperkoagulerande med risk för trombos. Stora randomiserade studier saknas, men mindre studier pekar på att VHA-användning vid levertransplantation och levercirros kan minska antalet transfusioner utan påverkan på blödningsvolymen [42, 43].
VHA är mest välstuderade inom elektiv hjärtkirurgi. Det finns dock få randomiserade studier, och de flesta har varit relativt små och av begränsad kvalitet. Resultaten har varierat från signifikant färre transfusioner i VHA-gruppen till ingen skillnad mellan grupperna. I en metaanalys inkluderades 8 randomiserade studier med totalt 1 035 hjärtkirurgiska patienter. Sammantaget visade metaanalysen att signifikant färre transfusioner av blodprodukter gavs till patienter randomiserade till VHA, utan någon skillnad i mortalitet [34]. De europeiska specialistföreningarna för toraxkirurgi och toraxanestesi rekommenderar (klass 2A) att VHA-styrda algoritmer övervägs vid hjärtkirurgi hos vuxna för att minska transfusioner [44].
Kvalitetsaspekter
Validering och standardisering av VHA-metoder har varit föremål för diskussioner, liksom tillförlitligheten [45-47]. Mätprinciperna skiljer VHA från plasmabaserade metoder, så skillnader i resultat är förväntade. Det finns inga krav på att använda metoder som används vid sjukhuslaboratorier som referensmetod vid validering, utan metodvalideringen kan sägas uppfylla krav på »lämplighet för avsedd användning« i olika kliniska sammanhang [47].
Kvaliteten på sjukhuslaboratoriernas metoder kontrolleras regelbundet genom externt kontrollprogram. Det innebär att provmaterial sänds ut från ett externt kontrollorgan (till exempel Equalis i Sverige), och analyseras varpå resultaten rapporteras in. Precisionen är betydligt lägre för VHA än för plasmabaserade koagulationstest [48]. Genom att ta bort pipetteringssteget i den automatiserade versionen av ROTEM (Sigma) blir precisionen förbättrad [49].
Ett rimligt krav för att upprätthålla kvaliteten i analysarbetet är att kliniker som dagligen använder VHA utför intern kontrollanalys en gång i veckan. Om instrumentet används mer sällan kan kontroller analyseras i samband med analys av patientprov. Deltagande i ett externt kvalitetskontrollprogram samt uppföljning av eventuella avvikelser är viktigt. Vid utplacering av patientnära analysinstrument i sjukvården bör resultat överföras elektroniskt till laboratoriedatasystem och/eller patientjournal för spårbarhet. Resultatet presenteras på bildskärm i realtid medan analysen pågår.
Sammanfattning
Värdering av hemostasen kan vara svår. VHA är ett komplement och bör ses som ett ytterligare stöd framför allt i blödningssituationer. Analysen mäter förändringar i viskositet och elasticitet i helblod, och en kurva presenteras som ger en översiktlig helhetsbild av flera komponenter av hemostasen. Man kan få numeriska svar på ett flertal olika parametrar med hjälp av olika koagulationsaktivatorer och -hämmare. Analysresultaten kan exempelvis användas för att optimera fibrinogennivåer och styra trombocyt- och plasmatillförsel.
VHA har framför allt utvärderats vid blödning inom trauma, obstetrik, hjärt- och leverkirurgi, där en VHA-styrd algoritm kan individualisera och möjligen minska transfusionsbehovet. En begränsning utgörs av att effekter av antikoagulantia och trombocythämmande läkemedel vid blödning inte alltid kan uteslutas. Mer automatiserade instrument minskar variationen i resultat till följd av handhavande.
Den stora fördelen med VHA är att analysen ger snabba svar och stöd i behandling i en akut blödningssituation. God handläggning av allvarlig blödning innefattar många viktiga åtgärder, och VHA kan vara ett givande komplement.
Potentiella bindningar eller jävsförhållanden: Vladimir Radulovic har erhållit föreläsararvode från Leo Pharma. Anders Jeppsson har erhållit konsultarvode från LFB Biotechnologies, Astra Zeneca och Werfen. Karin Strandberg har erhållit konsultarvode och föreläsningsarvoden från Novo Nordisk, Biomarin, Shire, Sobi och Octapharma.