Omhändertagandet av patienter med inflammatorisk tarmsjukdom, IBD, syftar till bästa möjliga hälsa.
Behandlingsmålen vid IBD ska förutom stabil inflammationskontroll även ta hänsyn till hälsorelaterad livskvalitet och vanliga extraintestinala manifestationer.
Fatigue är ett förbisett symtomkomplex som behöver uppmärksammas och om möjligt behandlas.
Järnbrist är mycket vanlig vid IBD och bör fortlöpande monitoreras och behandlas.
Bristtillstånd avseende vitamin D, kalcium och fosfat är sannolikt vanliga och kan vara relaterade till både sjukdomen och behandlingar, med risk för försämrad hälsorelaterad livskvalitet.
Inflammatorisk tarmsjukdom (inflammatory bowel disease, IBD), vilket innefattar ulcerös kolit och Crohns sjukdom, är ett långvarigt sjukdomstillstånd med varierande perioder av inflammation och remission [1, 2]. Utvecklingen av läkemedel för att kontrollera den kroniska inflammationen har varit snabb under det senaste decenniet. Även de kirurgiska behandlingarna har förbättrats, inte minst genom införandet av laparoskopiska operationer samt förfinad fistelkirurgi [3]. I Stride-II, som är ett konsensusdokument utarbetat av International Organisation For the Study of IBD (IOIBD), anges de långsiktiga behandlingsmålen för IBD vara symtomfrihet, endoskopisk slemhinneläkning, normaliserad hälsorelaterad livskvalitet och frånvaro av funktionspåverkan (disability) [4]. Målsättningen är således att patienterna ska kunna leva som de skulle ha gjort utan sjukdomen, inkluderande yrkesval, fritidsintressen, familjebildning och andra sociala aspekter [5]. Inflammationsfrihet är ett viktigt behandlingsmål, eftersom det minskar risken för skov och komplikationer. God hälsorelaterad livskvalitet (health-related quality of life, HRQL) förutsätter dock att vården tillsammans med patienterna och deras närstående uppmärksammar fler faktorer av betydelse än sjukdomsfenotyp, klinisk remission och endoskopisk inflammationsfrihet. Vårdens organisation och kvalitet, sjukdomsmanifestationer utanför tarmen och bristtillstånd är exempel på sådana faktorer. Ett vanligt symtom som försämrar hälsorelaterad livskvalitet vid IBD är sjukdomsrelaterad trötthet som inte går att vila bort, ofta benämnd »fatigue«. Orsaken är multifaktoriell och kan sökas i aktiv tarminflammation, mineral- och/eller vitaminbrist, biverkningar av läkemedel, störd sömn på grund av nattliga toalettbesök, långvarig smärta, annan samtidig sjukdom och psykisk ohälsa med stress, oro, ångest, nedstämdhet eller utmattningssyndrom [5, 6].
Faktorer av betydelse för god IBD-vård
Hälsorelaterad livskvalitet hos patienter med IBD förutsätter hög professionell standard, effektivt resursutnyttjande i vården, snabb vårdkontakt vid försämring samt kontinuitet i patientkontakten. Behandlingsmålen i det svenska vårdprogrammet sammanfattas i Fakta 1 [7]. Är patienten välinformerad om sin sjukdom, har lätthanterliga och snabba ingångar till vården, främst vid ökande symtom, samt känner sig delaktig i val av behandling och uppföljning uppnås en personcentrerad vård. Här har utvecklingen mot digitala kontaktvägar varit av stor betydelse, liksom möjligheten att överblicka individuella patientdata och populationsdata över tid i register. Ett nära samarbete mellan gastroenterologer och kolorektalkirurger, framför allt vid svårbehandlad och komplicerad sjukdom, är nödvändigt. Kontinuitet i vården uppnås genom att patienten kopplas till ansvarig specialistkompetent läkare och sjuksköterska så att antalet kontakter med akutsjukvården och vårdgivare utan personlig kännedom om patienten minimeras.
Trots detta upplever IBD-patienter sämre hälsorelaterad livskvalitet även om de är symtomfria. Under de senaste två decennierna har därför mätning av hälsorelaterad livskvalitet vid IBD blivit en integrerad del såväl i kliniska prövningar som i uppföljningen av patienter i rutinsjukvård. I det svenska kvalitetsregistret för IBD, Swibreg, ingår sedan snart tio år ett validerat sjukdomsspecifikt formulär för hälsorelaterad livskvalitet, Short health scale (SHS) [8], vilket också översatts och använts i ett flertal utländska studier. SHS består av fyra frågor som mäter var sin dimension av hälsorelaterad livskvalitet: symtom, social funktion, sjukdomsrelaterad oro och välbefinnande.
Fatigue – vanligt symtom vid IBD
Fatigue är ett komplext symtom med både fysiska och mentala komponenter [9]. Symtomet beskrivs ofta som en ihållande, överväldigande känsla av trötthet, svaghet eller utmattning, vilket resulterar i minskad kapacitet för fysiskt och/eller mentalt arbete och inte förbättras genom sömn eller vila. Fatigue är vanlig hos patienter med IBD, men förbises ofta trots sin påverkan på både livskvalitet, social funktion, arbetsförmåga, samlevnad och sexualitet. Orsaken till fatigue är i många fall oklar och är sannolikt multifaktoriell. Underliggande somatisk och/eller psykisk sjukdom eller bieffekter av medicinsk behandling kan bidra [10].
Sjukdomsaktivitet, järnbrist, upplevd stress, ångest/oro, sömnkvalitet, sjukdomsrelaterade faktorer och kvinnligt kön har associerats med fatigue vid aktiv IBD, men fatigue förekommer också vid inaktiv IBD [10], vilket delvis kan vara kopplat till medvetenheten om att leva med en långvarig sjukdom. Förekomsten av uttalad fatigue har rapporterats vara så hög som 68 procent vid aktiv sjukdom och 29–40 procent hos patienter med inaktiv sjukdom [11], vilket kan jämföras med 10–20 procent, beroende på varaktigheten av fatigue, i den allmänna globala populationen [12]. Studier har dock visat en varierande förekomst vid IBD, vilket kan bero på olika definitioner av fatigue.
Extraintestinala manifestationer vid IBD
IBD-manifestationer utanför tarmen brukar karakteriseras som beroende eller oberoende av sjukdomsaktivitet i tarmen [13] och sammanfattas i Fakta 2.
Vid aktivitetsrelaterade manifestationer inriktas behandlingen i första hand på att kontrollera tarminflammationen, med undantag för uveit, där akuta insatser från ögonläkare krävs för att undvika synförluster. Systemiska, icke-aktivitetsrelaterade manifestationer kan vara ett större problem än IBD-sjukdomen i sig och kräver uppmärksamhet. Det är viktigt att IBD-vården tar ansvar för att koordinera utredning och behandling, så att patienterna inte lämnas åt att själva söka hjälp. Grundprincipen är att de icke-aktivitetsrelaterade manifestationerna behandlas på samma sätt som hos patienter utan IBD, med särskild hänsyn till lämpligheten av olika behandlingsval, främst avseende läkemedel.
Järnbrist och järnbristanemi
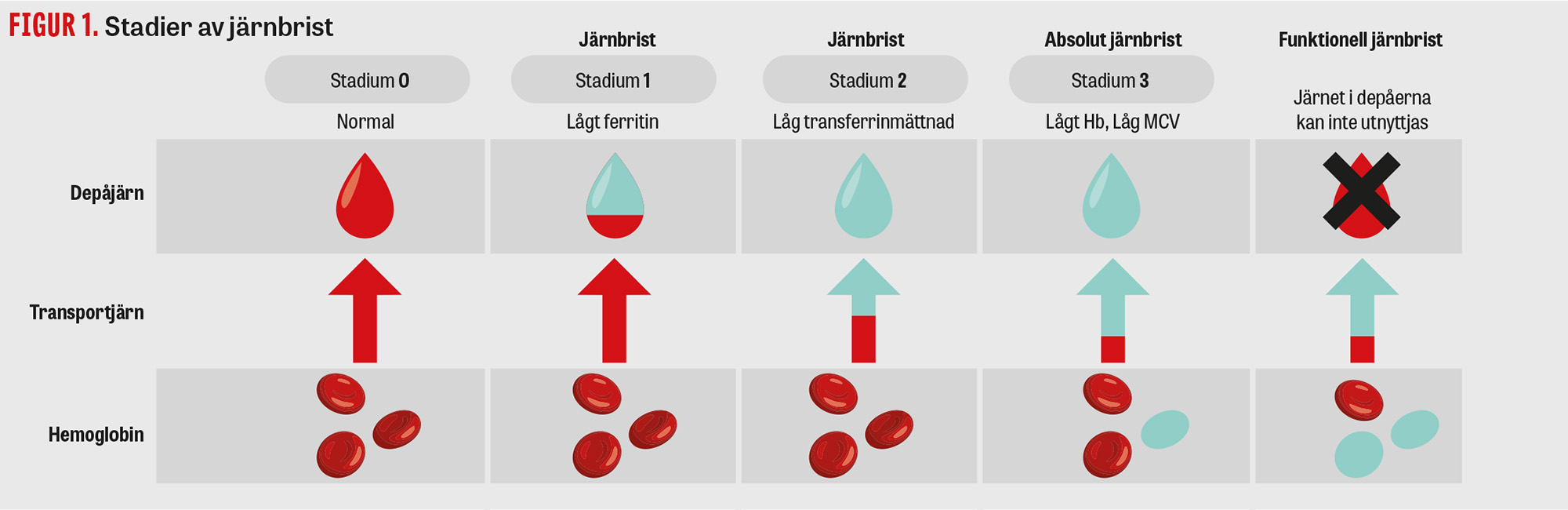
Järnbrist kan vara absolut, där förråden är tömda, eller funktionell med otillräckligt utnyttjande av järn [14, 15]. Vid en absolut järnbrist töms först de tillgängliga ferritindepåerna. Därefter minskar transferrinmättnaden och medelcellvolymen (MCV) parallellt med sjunkande hemoglobin, vilket kan ta 5–6 veckor (Figur 1).
Funktionell järnbrist kan ses vid alla inflammatoriska sjukdomar [15]. Ferroportin är centralt i styrningen av makrofagernas export av järn till transferrin i plasma för senare återanvändning i erytropoesen, samt för upptag av järn från tarmen [16]. Transferrinmättnaden är således ett mått på det järn som är funktionellt tillgängligt för erytropoesen. Vid inflammation uppreglerar proinflammatoriska cytokiner hepcidin, vilket leder till att ferroportin nedregleras.
Järnets roll och omsättning
Järn är det viktigaste spårämnet i organismen [17]. I sin oorganiska form kan järn växla mellan Fe2+ och Fe3+, vilket ger järnet unika egenskaper för viktiga redoxreaktioner som att binda syre i hemoglobin, aktivera metabola enzymsystem och driva energiproduktion i andningskedjan. Fritt Fe2+ kan aktivera bildning av fria radikaler med skador på lipidmembran, proteiner och DNA, varför mängden fritt Fe2+ måste hållas låg. Flera olika former av järnbindande proteiner reglerar effektivt järnomsättningen.
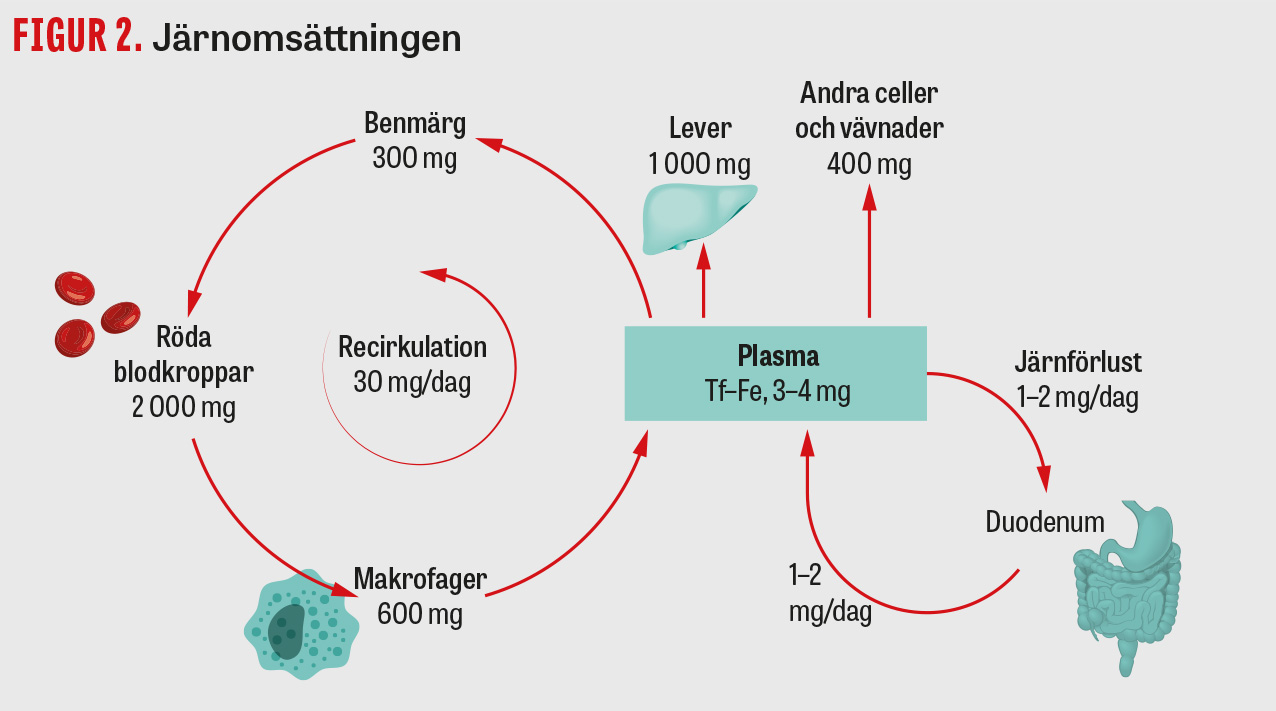
Det dagliga behovet av järn är 1–2 mg. Järnet distribueras till 60 procent bundet i hemoglobin, 25 procent lagras i ferritin och 15 procent är bundet i myoglobin, enzymer och transferrin (Figur 2). Elimineringen av järn sker framför allt genom nedbrytning av tarmens epitelceller, där järn är bundet till ferritin. Förlusterna ökar vid systemisk inflammation då större mängd järn upplagrats i enterocyterna [16]. Järn återanvänds efter destruktion av erytrocyter i kroppens makrofager och transporteras bundet till transferrin för funktioner i olika organsystem. Absorptionen av järn styrs av proteinet hepcidin, som uppfattar erytropoesens behov av järn.
Järnbrist vid IBD
Vid IBD är järnbrist och järnbristanemi den vanligaste extraintestinala manifestationen [14]. Förekomsten av järnbristanemi har rapporterats vara så hög som 25–50 procent, medan järnbrist utan samtidig anemi förkommer hos ytterligare 25 procent. Högst är förekomsten vid aktiv och utbredd sjukdom samt hos patienter med Crohns sjukdom. De vanligaste orsakerna är gastrointestinal blödning, resorptionsstörningar eller bristande intag samt inflammationsrelaterad järnbrist, där upptaget av järn från tarmen och frisättningen från depåerna blockerats av hepcidin. Ur patofysiologisk synpunkt är järnbrist och järnbristanemi vid IBD uttryck för samma bakomliggande processer; det är svårighetsgraden och tidsförloppet som avgör om anemi utvecklas.
Erytropoesen är prioriterad så länge det finns tillgång på järn [17]. Men redan innan hemoglobinnivån börjar sjunka har järnets roll i enzymatiska, metabola och oxidativa processer relaterade till energiproduktion nedreglerats. Järnbrist kan därför kopplas till en rad kliniska symtom med nedsättning av psykosociala och kognitiva funktioner, koncentrations- och arbetsförmåga samt muskelsvaghet, ledvärk, fatigue och depression.
Eftersom järnbrist är vanlig vid IBD och har betydande konsekvenser för livskvaliteten [18] är det viktigt att följa upp patienterna för att påvisa och behandla järnbrist. Analys av transferrinmättnad och ferritin är oftast tillräckligt, men vid samtidig inflammation måste man beakta att ferritinnivåer >100 µg/l kan vara förenliga med en reell järnbrist om transferrinmättnaden samtidigt är <20 procent [19]. Vid osäkerhet underlättar analys av löslig transferrinreceptor bedömningen, eftersom förhöjd nivå alltid indikerar absolut järnbrist, oavsett samtidig inflammation [20]. Behandlingen är i första hand intravenöst järn, eftersom patienterna på grund av sin tarmsjukdom sällan tolererar peroralt järn. Dessutom blockerar inflammationen järnupptaget från tarmen. Behandlingen bör inledas redan vid påvisad järnbrist utan att invänta en senare uppkomst av anemi [19]. Effekten av behandlingen ska följas upp efter 6–8 veckor, och i den fortsatta långsiktiga uppföljningen bör man sträva efter att bibehålla ferritinnivå över 100 µg/l vid aktiv sjukdom [19].
Benmetabolism
Benvävnaden optimeras genom att vitamin D, parathormon (PTH), kalcitonin och fibroblasttillväxtfaktor-23 (FGF23) reglerar balansen mellan de naturliga byggstenarna kalcium och fosfat [21]. Eftersom endast hälften av det fosfat som finns i födan absorberas sparar kroppen effektivt på fosfat; i njurtubuli finns system för återupptag av fosfat som filtrerats i glomeruli. Vitamin D bioaktiveras i lever och njure till 1,25-dihydroxivitamin-D (1,25(OH)2D), som är fundamentalt för upptaget av kalcium och fosfat.
Medan PTH från bisköldkörtlarna tillsammans med 1,25(OH)2D reglerar upptaget av kalcium, är det FGF23 från benvävnad som styr jämvikten av fosfat [20]. Den huvudsakliga effekten är att minska det renala återupptaget samt aktiveringen till 1,25(OH)2D.
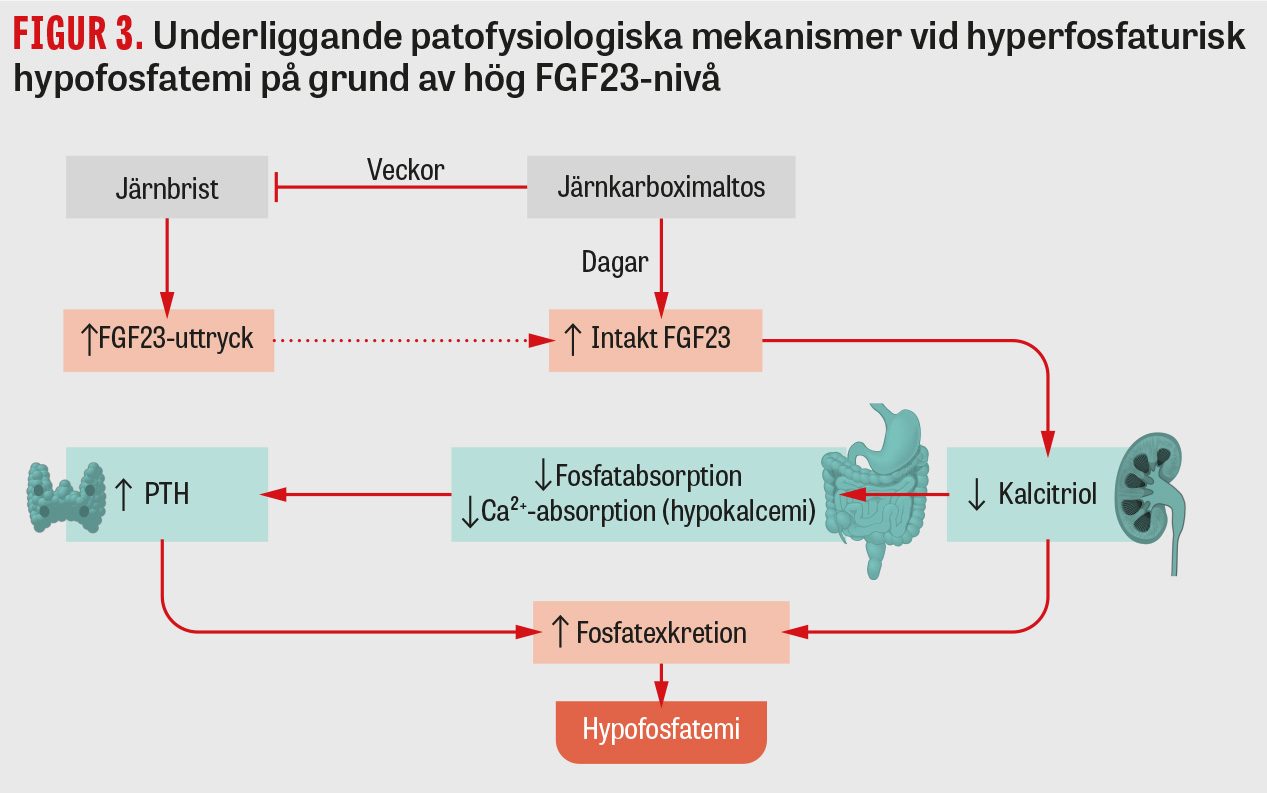
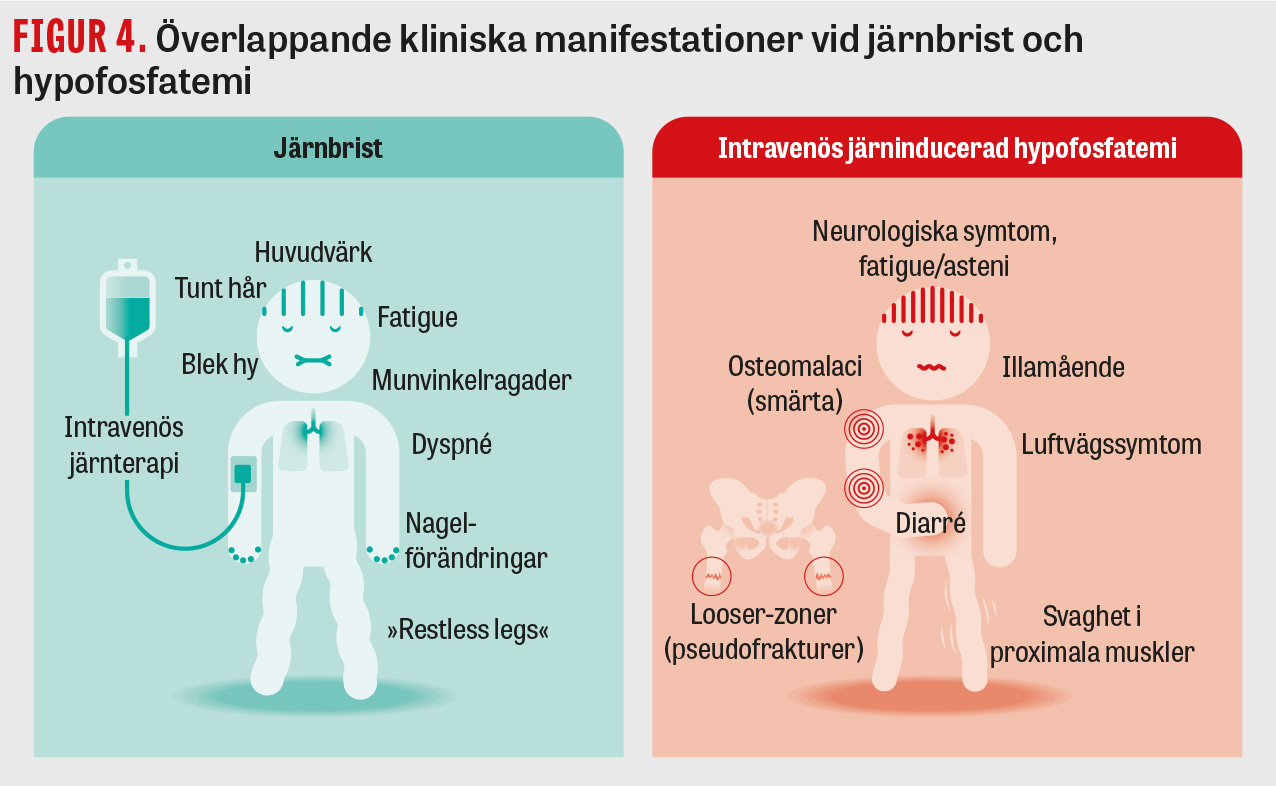
Järnbrist och inflammatoriska tillstånd stimulerar både syntes och nedbrytning av FGF23 i lika omfattning, vilket leder till oförändrade nivåer av bioaktivt FGF23. Vid behandling med järnkarboximaltos minskar den molekylära klyvningen och inaktiveringen, vilket leder till förhöjda nivåer av bioaktivt FGF23. Detta kan ge svår hypofosfatemi beroende på de fosfaturiska och vitamin D-hämmande effekterna av bioaktivt FGF23 [22] (Figur 3). Likheten mellan symtom vid järnbrist och fosfatbrist understryker behovet av fosfatanalyser (Figur 4).
Hypofosfatemi efter behandling med intravenöst järn
Hypofosfatemi (<0,65 mmol/l) är en vanlig biverkan vid intravenös järnbehandling, men har tidigare uppfattats som en lindrig och snabbt övergående konsekvens av ökad erytropoes. Det har dock visat sig att hypofosfatemi efter intravenös järnbehandling kan bli uttalad och kvarstå under månader. Svår fosfatbrist (<0,32 mmol/l) kan orsaka muskelsvaghet och hjärtpåverkan. Långdragen hypofosfatemi kan leda till osteomalaci och lågenergifrakturer [23]. Skelettundersökning med magnetkamera kan då påvisa pseudofrakturer genom viktbärande delar av skelettet.
Förekomsten av måttlig–svår hypofosfatemi efter järninfusion har studerats i två randomiserade kontrollerade kliniska »head-to-head«-prövningar av de två mest använda järnpreparaten i Sverige; järnkarboximaltos och järnderisomaltos. I Phospare-IDA-studien, där populationen var unga kvinnor, fick 74 procent av patienterna som behandlats med järnkarboximaltos hypofosfatemi, jämfört med 8 procent för järnderisomaltos [24]. I Phospare-IBD var motsvarande siffror 51 procent respektive 8 procent [25]. I Phospare-IDA redovisades även andelen med svår hypofosfatemi, vilket endast uppstod vid behandling med järnkarboximaltos (11 procent) jämfört med järnderisomaltos (0 procent). Störst sänkning av serumfosfat sågs 2 veckor efter järninfusion. Vid slutet av uppföljningen efter 5 veckor hade fosfatnivån normaliserats hos de flesta som behandlats med endera järnkarboximaltos eller järnderisomaltos. Benskademarkörer kvarstod dock under längre tid hos patienter med hypofosfatemi, med åtföljande ökad risk för frakturer [24, 26].
Riskfaktorer för uppkomst av hypofosfatemi kan delas in i fyra grupper [23, 27]:
- uttalad järnbrist, högre kumulativ järndos och täta upprepade järninfusioner på grund av ökningen av aktivt FGF23 under längre tid
- lågt upptag av fosfat från tarmen kopplat till malnutrition och malabsorption eller lågt vitamin D
- låg fosfatnivå redan före behandling med intravenöst järn, vilket minskar kroppens möjlighet att hantera konsekvenserna av ökat FGF23
- hypofosfatemin motverkas av minskad glomerulär filtration på grund av njursvikt.
Vi föreslår att man i de fall järnkarboximaltos ges med multipla doser, eller om upprepade järninfusioner med korta intervall (<6 månader) behövs, monitorerar serumfosfat inför varje infusion. Vid låg fosfatnivå bör man avvakta med ytterligare dos eller byta till annat järnpreparat med lägre risk för hypofosfatemi. I detta läge kan, utöver järnderisomaltos, även järnsackaros vara ett alternativ.
Rutinmässig monitorering av serumfosfat efter enstaka järninfusion rekommenderas ej, men man ska vara observant på symtom som ger misstanke om hypofosfatemi (fatigue, muskelsvaghet, muskelsmärta, skelettsmärta) och då monitorera frikostigt. För att förebygga risken för hypofosfatemi vid järnbehandling ska vitamin D-brist substitueras.
Lindrig–måttlig asymtomatisk hypofosfatemi (0,40–0,65 mmol/l) behandlas inte. Svår eller symtomgivande hypofosfatemi behandlas med fosfatsubstitution, och misstänkt osteomalaci utreds.
Vitamin D-brist
Vitamin D är viktigt för skelettet genom att stimulera absorption av kalcium och reglera osteoblastfunktionen [28]. Allvarlig brist kan leda till svår sjukdom med osteomalaci, men på senare år har en lång rad andra tillstånd visats ha en association till låga vitamin D-nivåer.
Låga nivåer av 25(OH)D är betydligt vanligare hos patienter med IBD än hos jämförbara friska individer, och prevalensen kan vara så hög som 70–80 procent [29, 30]. I en metaanalys av >3 000 patienter med ulcerös kolit och >5 000 patienter med Crohns sjukdom med brist på 25(OH)D (<10–35 nmol/l) kunde man se en association mellan låg vitamin D-nivå och aktiv sjukdom [31]. Orsaken till vitamin D-brist vid IBD är sannolikt multifaktoriell. I litteraturen diskuteras nedsatt biotillgänglighet, ökad nedbrytning och förluster men även andra aspekter som låg fysisk aktivitet och minskad exponering för solljus.
Genomgående har nydiagnostiserade IBD-patienter låga vitamin D-nivåer, vilka korrelerar till hög sjukdomsaktivitet och sämre behandlingssvar. Studier i Norge, som har hög prevalens av IBD, har visat att låga vitamin D-nivåer är betydligt vanligare hos IBD-patienter än hos friska i samma omgivning och med liknande förutsättningar för vitamin D-syntes i huden [30]. Eftersom vitamin D har visat sig ha immunologiska effekter har man i några mindre randomiserade interventionsstudier studerat effekter av vitamin D-substitution på sjukdomsaktiviteten vid IBD. I en metaanalys från 2020 noterades att behandling med vitamin D gav signifikant ökade nivåer av 25(OH)D och samtidigt visst stöd för minskad poäng på Harvey–Bradshaws index för symtomskattning vid IBD och sänkning av CRP [32], medan eventuell effekt avseende livskvalitet och patientrapporterade symtom har varit svårvärderad. Sammantaget ger dagens kunskapsläge stöd för att brist på 25(OH)D är vanlig hos patienter med IBD, särskilt vid aktiv sjukdom. Detta bör föranleda regelbunden monitorering av vitamin D och substituering efter påvisad brist för att minska risken för skelettkomplikationer kopplade till vitamin D-brist, hypofosfatemi och upprepad steroidbehandling.
Sammanfattningsvis förutsätter hälsorelaterad livskvalitet hos patienter med IBD mer än inflammationsfrihet. Graden av fatigue bör alltid värderas och extraintestinala manifestationer om möjligt behandlas. Fatigue saknar biokemisk surrogatmarkör men måste ändå ses som en viktig sjukdomsmanifestation. En samlad bild av olika komponenter som kan bidra till fatigue är viktig. Bland dessa kräver järnbrist, hypofosfatemi och låga vitamin D-nivåer särskild uppmärksamhet och monitorering för optimal behandling.
Potentiella bindningar eller jävsförhållanden: Stefan Lindgren har erhållit föreläsar- och konsultarvoden från Pharmacosmos och Vifor Pharma. Sven Almer har erhållit föreläsar- och konsultarvoden från Galapagos, Janssen, Pharmacosmos, Takeda och Tillotts. Daniel Bergemalm har erhållit föreläsar- och konsultarvoden från Bristol-Meyers Squibb, Janssen-Cilag, Pharmacosmos, Pfizer, Takeda och Sandoz. Olof Grip har erhållit föreläsar- och konsultarvoden från Abbvie, Bristol-Meyers Squibb, Ferring, Janssen-Cilag, Pharmacosmos, Pfizer, Tillotts och Takeda. Per M Hellström har erhållit konsultarvode från Pharmacosmos. Henrik Hjortswang har erhållit konsultarvoden från Pharmacosmos och Norgine. Hans Strid har erhållit konsultarvode från Pharmacosmos.
Fakta 1. Behandlingsmål enligt nationellt vårdprogram för vuxna med IBD
- Uppnå tarmslemhinneutläkning
- Uppnå kortikosteroidfri remission
- Uppnå god livskvalitet med bevarad funktionsförmåga
- Undvika komplikationer
- Minimera behov av omfattande eller upprepad tarmresektion
- Minimera behov av oförutsedda vårdkontakter
- Forskning, utveckling, utbildning
Fakta 2. Extraintestinala manifestationer vid IBD
Aktivitetsrelaterade
- Järnbrist/anemi
- Perifer spondylartropati typ 1
- Erythema nodosum
- Fatigue
- Tromboembolism
- Orala manifestationer (inflammation, tandlossning m fl)
- Uveit
Icke-aktivitetsrelaterade
- Fatigue
- Järnbrist/anemi
- Hyper-/hypotyreos
- Primär skleroserande kolangit
- Autoimmun hepatit
- Perifer spondylartropati typ 2
- Axial spondylartropati
- Sakroiliit
- Pyoderma gangraenosum
- Njursten
- Gallsten