Anemi är vanlig i befolkningen, också hos idrottare och framför allt hos kvinnor.
Anemi hos idrottare kan medföra begränsningar i prestationsförmågan. Således är det viktigt att screena och utreda framför allt kvinnliga idrottare för anemi med eller utan järnbrist och att behandla vid behov.
Anemi hos idrottare bör utredas och behandlas på samma sätt som hos icke-idrottare.
Det träningsutlösta inflammatoriska påslaget i sig leder till en ökning av hepcidin som kan utlösa eller förvärra en järnbrist.
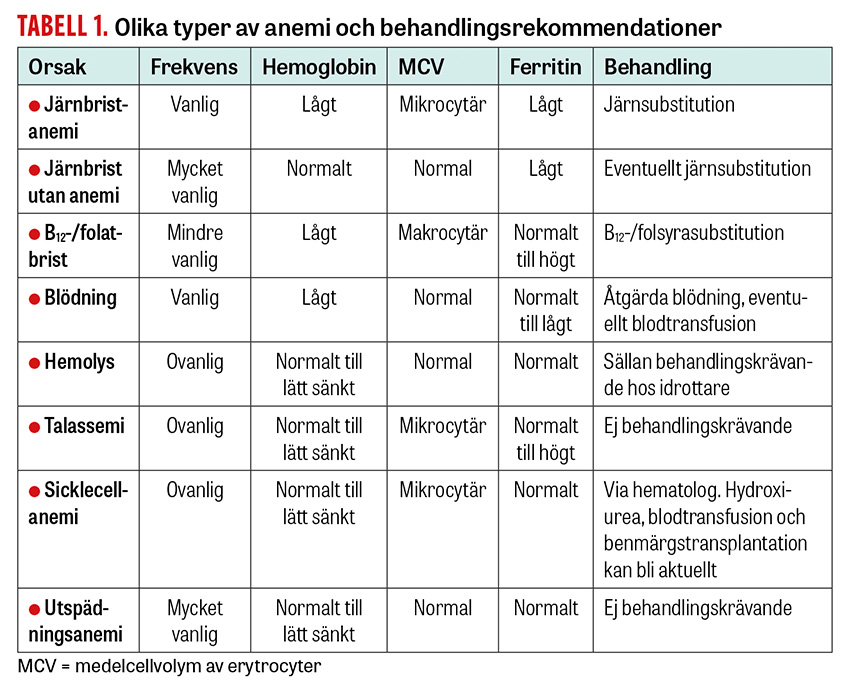
Världshälsoorganisationen (WHO) definierar anemi som ett hemoglobinvärde (Hb) under 120 g/liter hos icke-gravida kvinnor och under 130 g/liter hos män. I västvärlden har 2–5 procent av befolkningen anemi, och 10–30 procent av den kvinnliga befolkningen uppskattas ha järnbrist medan prevalensen är klart lägre bland män. Hb hos friska vuxna personer är ganska konstant genom livet; dock sjunker medel-Hb något hos män över 70 års ålder. Prevalensen av individuell anemi, det vill säga ett Hb lägre än patientens eget friska värde, är svår att beräkna men kan ha betydelse för individuell behandling och utredning. En person med järnbrist och ett till synes normalt Hb (inom referensvärdet) kan faktiskt ha anemi, vilket kan bekräftas via en ökning av Hb-värdet > 10 enheter efter järnsubstitution.
Precis som hos icke-idrottare är den absolut vanligaste orsaken till anemi järnbrist, orsakad av en obalans mellan intag och förluster av järn (framför allt menstruationer). Utöver detta kan idrottare drabbas av anemi till följd av träningsutlösta inflammatoriska reaktioner [1], ökat järnbehov vid exempelvis höghöjdsträning [2], kostrestriktioner och användning av antiinflammatoriska läkemedel (NSAID) [3].
Andra orsaker till anemi är mag–tarmblödning, inflammatoriska sjukdomar, njursjukdom, Helicobacter pylori-infektion, celiaki eller brist på B12 eller folsyra. Bärarskap av ärftliga hemoglobinopatier som talassemi kan också leda till måttlig anemi. Mekanisk hemolys och ökad utsöndring av järn via svett, urin och mag–tarmkanalen är ovanliga orsaker till anemi. Handläggningen syftar till att behandla den bakomliggande orsaken samt återställa blodvärdet, och vid järnbristanemi även järnnivåer och -depåer. Även idrottare kan drabbas av icke-idrottsrelaterad anemi med potentiellt allvarlig bakomliggande orsak, som då behöver utredas på sedvanligt sätt.
För idrottare kan anemi med eller utan järnbrist ha stor betydelse för den aeroba prestationsförmågan, som är närmast linjärt associerad med hemoglobinnivåerna [4]. Förutom att järnet är centralt i hemoglobinets syrebindande förmåga har det också en viktig roll i mitokondriernas energiproduktion, ATP-produktion, elektrontransportkedjan och DNA-syntesen. Dessa funktioner är essentiella för den fysiska prestationsförmågan.
Orsaker till anemi bland idrottare
Järnbrist
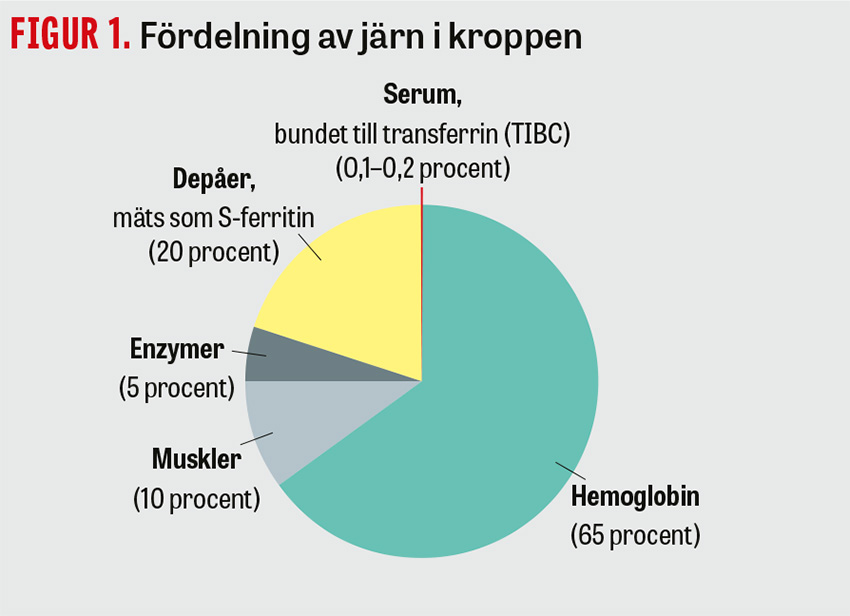
Den totala mängden järn i kroppen är cirka 3 gram hos kvinnor och 4 gram hos män. Fördelningen av järnet i kroppen framgår av Figur 1 [1]. Järnbrist utvecklas när järnbehovet överstiger tillgången på järn. Trots den potentiellt stora betydelsen av anemi för idrottare tycks dessa inte ha mindre järnbrist än befolkningen i stort. I en studie som undersökte 28 svenska kvinnliga elitfotbollsspelare uppvisade mer än hälften en järnbrist, och en tredjedel uppfyllde kriterier för anemi [5]. Bland unga mönstrande värnpliktiga uppvisade 23 procent av alla menstruerande kvinnor järnbrist och 2 procent hade samtidigt en järnbristanemi. För män var motsvarande siffror 7,2 respektive 0,1 procent [1]. Bland idrottare, och i synnerhet konditionsidrotter och i idrottsgrenar där ätstörningar är vanligt förekommande, är siffrorna ännu högre [1]. Bland elitlöpare har järnbristprevalensen rapporterats vara upp till 82 och 41 procent hos kvinnliga respektive manliga löpare.
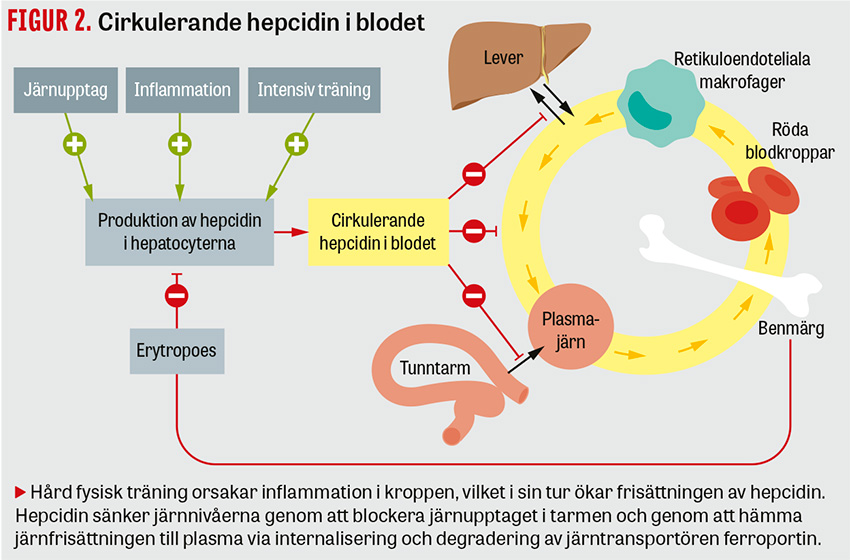
Järnbrist till följd av träningsutlöst inflammation och hämning via hepcidin. I en studie där forskare jämfört elitidrottande med icke elitidrottande unga kvinnor på ett idrottsgymnasium konstaterades att järnnivåerna var likvärdiga i de två grupperna [6]. Fyndet var anmärkningsvärt eftersom elitidrottarna både hade en bättre kosthållning och menstruerade mindre mätt i antal blödningsdagar och blodvolym – två faktorer som normalt skulle bidra till en bättre järnnivå. En förklaring till detta är att idrottarna uppvisade en högre nivå av det järnreglerande hormonet hepcidin i serum, vilket gör att järnupptaget i tarmen hämmas till följd av en inflammatorisk reaktion i kroppen orsakad av intensiv fysisk träning. Hepcidin är ett järnreglerande hormon som frisätts från levercellerna vid hög järnmättnad, ökad produktion av röda blodkroppar, inflammation och syrebrist (Figur 2). Hepcidin minskar tillgängligheten av järn genom att blockera järnupptaget i tarmen och genom att hämma järnfrisättningen till plasma via internalisering och degradering av järntransportören ferroportin. Studier har visat förhöjda nivåer av inflammationsmarkörerna IL-6 och CRP efter träningspass [7]. Hämningen sker både vid konditions- och styrketräning. Ett resultat av det träningsutlösta inflammatoriska påslaget är en ökning av serumnivåerna av hepcidin, en effekt som håller i sig ungefär 3–6 timmar efter ett träningspass med en intensitet omkring 60–90 procent av den maximala syreupptagningsförmågan.
Järnbrist till följd av kostrestriktioner. Idrottare som är vegetarianer har en ökad risk för järnbrist, då växtbaserade livsmedel innehåller mindre järn än kött och är rika på ämnen som hämmar järnupptaget, däribland polyfenoler och fytater. Detta är relevant att nämna då allt fler idrottare äter vegetarisk kost och då de nordiska näringsrekommendationerna från 2023 tillråder mer vegetabilisk föda och mindre animaliska livsmedel. Det är fullt möjligt att vara vegetarian och samtidigt idrottare på elitnivå, men då är det viktigt att kontrollera järnnivåer och järnsubstituera vid behov. Kött, fisk, broccoli, flingor och bröd är livsmedel rika på järn. Järn som vi äter har en absorptionsgrad på endast 5–15 procent. C-vitamin främjar järnupptaget. Kaffe, te samt kalciumrika produkter som ost och mjölk hämmar upptaget. Kvinnor äter i regel mindre än män och har därför, i kombination med ökade förluster i samband med menstruation, extra hög risk att få i sig för lite järn via kosten. Även de som äter glutenfri kost riskerar järnbrist. Idrottande veganer löper också en ökad risk för järnbrist, men även B12-brist, som också kan orsaka anemi samt skador på slemhinnor och nervsystem.
Järnbrist till följd av ökade järnförluster. De största järnförlusterna har kvinnor med rikliga menstruationer. Utsöndringen av järn via svett är betydligt högre vid ansträngning än i vila. Vid träning förekommer också en fysiologisk ischemi av tarmarna, som i sin tur bidrar till ett försämrat järnupptag via mag–tarmkanalen samt mikroblödningar i både mag–tarmkanal och urinvägar. En studie visar att 1 av 7 idrottare använder NSAID på daglig basis i förebyggande syfte [3]. En biverkan av NSAID, framför allt vid långtidsanvändning, är ökad blödningsbenägenhet, som skulle kunna ha betydelse för utveckling av anemi, i synnerhet inom kontaktidrott. Elitidrottare kan vara blodgivare, men rekommenderas då att donera blod under viloperioder.
Järnbrist till följd av ett ökat järnbehov. Vid exempelvis höghöjdsträning har idrottaren ett högre järnbehov än normalbefolkningen. I syrefattig luft ökar produktionen av erytropoetin (EPO) från njurarna, vilket i sin tur stimulerar erytropoesen. För att fler blodkroppar ska kunna bildas krävs adekvat tillgång till järn. Vuxna elitidrottare kan inför träningsläger på hög höjd behöva nå ferritinvärden på 50 μg/l för att kunna tillgodogöra sig träningen och det ökade järnbehovet [2].
Hemolys
Vid långdistanslöpning och långa marscher kan hemolys uppstå när blodkropparna slås sönder i fotsulorna till följd av den långvarigt upprepade isättningen av fötterna [8]. I engelska termer beskrivs fenomenet ofta som »footstrike anemia« eller »runner’s anemia«. Detta har beskrivits även hos simmare, tyngdlyftare och roddare som inte har någon upprepad isättning av fötterna. Betydelsen av sådan mekanisk hemolys som orsak till anemi är mycket liten i praktiken.
Hemoglobinopatier
Hemoglobinopatier är en sammanfattande term för ärftliga tillstånd som leder till att hemoglobinet bildas på ett felaktigt sätt. Dessa sjukdomar är ofta förknippade med anemi och kan påverka prestationsförmågan och därmed deltagande i idrott. Hemoglobinopatier diagnostiseras med fraktionerade hemoglobiner (Hb-elfores) och vid behov med genanalys. Hematolog bör konsulteras, och det kan bli aktuellt med genetisk rådgivning. Screening för hemoglobinopatier saknas i Sverige.
Talassemi. Talassemierna delas in i alfa- och betatalassemi, beroende på vilken del av hemoglobinet som är felaktig. I västvärlden blir talassemisjukdomarna vanligare i takt med ökad invandring från Mellanöstern, medelhavsländerna och Afrika. I malariadrabbade områden är talassemierna vanliga eftersom tillståndet har en skyddande effekt mot denna infektion. Det finns olika kliniska former av både alfa- och betatalassemi, från bärarskap (minor, minima), med måttlig anemi utan symtom, till homozygot (major) med tidig svår transfusionskrävande anemi. Symtomen varierar från knappt några till svåra symtom i form av anemi, ökad infektionskänslighet, benskörhet, hjärtsvikt, försämrad tillväxt samt förstorad mjälte och lever. Lindriga former brukar inte kräva behandling, men svårare former kan kräva blodtransfusioner och benmärgstransplantation. Då talassemin leder till benskörhet ökar risken för fraktur och förstorad mjälte till mjältruptur vid exempelvis kontaktidrott. Hematolog bör vara involverad i bedömning av fysisk aktivitetsnivå för idrottare med talassemi.
Sicklecellanemi. Vid sicklecellsjukdom produceras ett defekt hemoglobin, som vid olika påfrestningar (hypoxi, infektion, dehydrering), men även utan tydlig orsak, kan utlösa så kallad »sickling« av de röda blodkropparna. Detta är associerat med trombotisering av mikrocirkulationen, vävnadshypoxi och cellnekros. Akuta komplikationer som vaso-ocklusiv kris med svåra smärtor, akut koronart syndrom, stroke och akut anemi förekommer, och även kroniska komplikationer kan leda till förkortad överlevnad. I vila utan symtom har patienten oftast en låggradig hemolys. Anlagsbärare är normalt symtomfria och har inte anemi, men kan under extrema betingelser avlida akut, vilket kan förklaras av akut sickling [9]. I den europeiska fotbollsfederationen UEFA:s medicinska bestämmelser från 2023 beskrivs att anlagstest för sicklecellsjukdom ska göras minst en gång på alla fotbollsspelare som har en ärftlighet för hemoglobinopatier och vid avvikande anemiprov. Positivt screeningresultat kan i sällsynta fall leda till diskvalificering eller att man avråds från viss typ av idrottsutövning.
Utspädningsanemi
Utspädningsanemi är den vanligaste orsaken till lågt hemoglobinvärde bland idrottare. Fenomenet beror på en träningsutlöst expansion av plasmavolymen, vilken ger ett falskt lågt hematokritvärde, hemoglobinvärde och andel röda blodkroppar, och inträffar i regel efter några dagars intensivare träning. Det sker alltså en utspädningseffekt och blodvärdet blir relativt sett lägre, men det absoluta antalet blodkroppar och mängden hemoglobin förblir oförändrade, varför detta inte är att betrakta som någon egentlig behandlingskrävande anemi.
Symtom
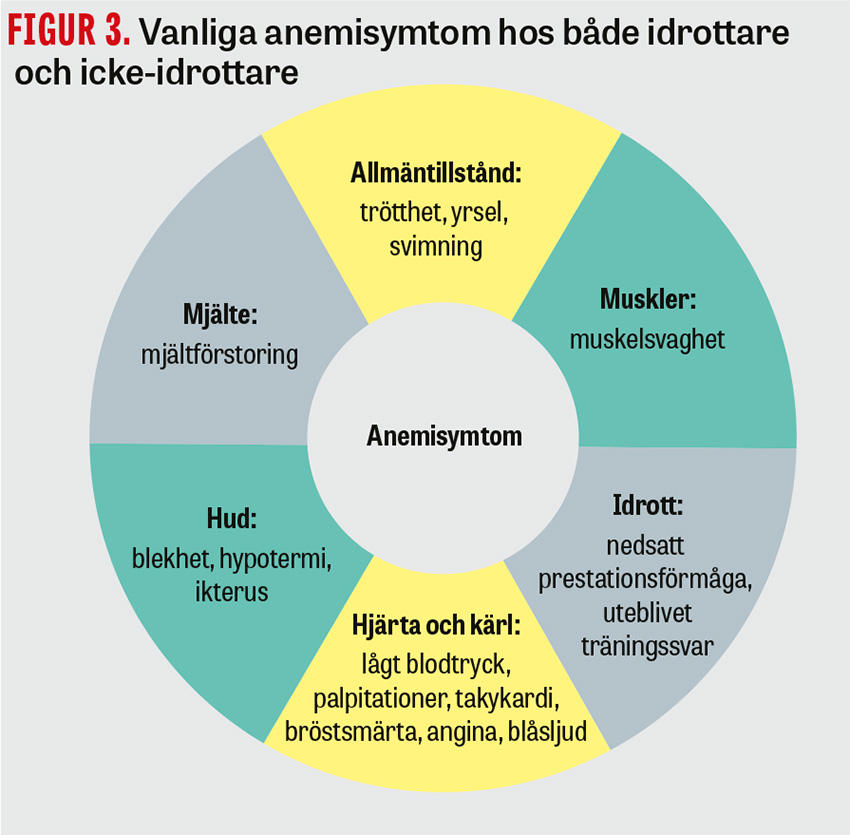
Typiska anemisymtom är trötthet, muskelsvaghet, illamående, yrsel, hjärtklappning, huvudvärk, svimning, andfåddhet och kärlkramp i olika frekvens (Figur 3). Idrottare kan utöver detta uppleva utebliven träningseffekt och sämre prestationsförmåga.
Utredning
Vid misstanke om anemi tas en riktad anamnes där idrottaren tillfrågas om blödningar, menstruationscykel, kroppsvikt, kostvanor, läkemedel, tidigare anemier, kroniska sjukdomar som celiaki, genomgången mag–tarmkirurgi, ärftlighet för eventuella hemoglobinopatier och B12-brist.
Vid misstanke om anemi med eller utan järnbrist tas prov: Hb, erytrocytmåtten MCV, MCH och MCHC, retikulocyter, S-Fe, S-ferritin och S-transferrin (S-TIBC), och transferrinmättnaden (T-sat = S-Fe/S-TIBC × 100 [procent]) beräknas. Vid misstanke om anemi bör man även ta blodstatus inklusive leukocyter, B-diff och trombocyter. För att minska risken för träningspåverkan av provsvaren bör idrottaren ha vilat på provtagningsdagen och dagen före samt inte ha några tecken till pågående infektion.
Vid misstanke om annan orsak än idrottsrelaterad anemi bör idrottare liksom andra patienter utredas med ledning av anemityp för den eventuella bakomliggande sjukdomen. Vid järnbrist görs exempelvis gastroskopi, koloskopi, rektoskopi (med eller utan biopsi) och gynekologisk undersökning. Vid säkerställd B12– eller folatbrist rekommenderas riktad malabsorptionsutredning. Vid misstanke om hemolys kontrolleras urinsticka, okonjugerat bilirubin, haptoglobin och S-elfores.
Behandling
Behandlingen syftar till att återställa individens normala Hb-nivå, och svaret på behandlingen kan bekräfta anemimekanismen. Hos kvinnliga idrottare med anemi bör man överväga att rekommendera blödningsfrihet.
Järnbristanemi
Järnbristameni behandlas med järnsubstitution, ofta i form av peroral behandling 100 mg × 2 dagligen. Om denna dosering inte tolereras på grund av biverkningar kan man nå lika bra effekt med varannandagsdosering. Efter 6–8 veckor bör idrottaren genomgå ny kontroll av järn- och blodstatus för att verifiera behandlingsrespons. Vid isolerad järnbrist utan säker anemi kan man prova järnsubstitution under 6–8 veckor. Om Hb ökar med 10 g/liter eller mer bekräftas en så kallad relativ anemi. Det betyder att individen har ett högre normalt Hb än WHO:s nedre gräns och då faktiskt varit anemisk relativt sig själv och svarat på behandlingen. Det är viktigt att följa upp behandlingen med ny provtagning. Förstoppning orsakad av järnsubstitution kan behandlas med receptfria laxermedel. Järnrika naturläkemedel rekommenderas ej, då de ofta innehåller bråkdelen av järnbehovet som behövs och då sådana okontrollerade preparat kan vara riskfyllda på andra sätt, inte minst från dopingssynpunkt. Vid järnbrist till följd av kostrestriktioner kan det bli aktuellt att koppla in dietist och behandla en eventuell underliggande ätstörning.
Hemolys
Lindrig intermittent hemolys hos i övrigt friska långdistanslöpare kräver normalt ingen behandling. Möjligen kan mjuka skoinlägg minska hemolysen. Vid annan hemolys konsulteras hematolog. Stillsam kronisk hemolys förekommer bland annat vid bärarskap för hemoglobinopati och kan leda till folatbrist som kan behöva behandlas.
Järnbrist utan anemi
Huruvida behandling av isolerad järnbrist utan anemi hos idrottare leder till bättre fysisk prestationsförmåga är omdiskuterat. Isolerad järnbrist hos idrottare har visats vara associerad med ökad uttröttning, sämre adaptation till träning, nedsatt immunförsvar, sämre förmåga att tåla värme och försämrad förmåga att tolerera stress och höghöjdsträning. Järnbrist utan anemi kan även hos icke-idrottare vara kopplat till fatigue.
I en studie av 165 kvinnliga roddare fann man att 27 procent uppfyllde kriterier för järnbrist utan anemi, och vid behandling av järnbristen förbättrades prestationsförmågan [10]. I andra studier där man undersökt idrottare med järnbrist, och i fall där man aktivt inducerat en järnbrist och sedan undersökt den aeroba kapaciteten, har man inte funnit någon koppling mellan järnbrist utan anemi och påverkad prestationsförmåga. Således finns inget entydigt svar.
Då kvinnliga idrottare med lätt obalans i järnintag kontra järnförluster med tiden kan utveckla först järnbrist och därefter anemi, om inte järnintag eller förluster kan påverkas signifikant, kan det anses kliniskt indicerat att substituera en sådan järnbrist, om inte annat för att förebygga en anemi.
Överbehandling med järntillskott
Det är viktigt att poängtera att överdosering av järn inte leder till några hälso- eller prestationsfördelar, utan till och med kan vara skadlig. Hemoglobinvärdet kan ej ökas till nivåer utöver individens optimala hemoglobinvärde med hjälp av järn, till skillnad från med bloddoping eller EPO-doping, där man kan se »supranormala« Hb-värden. En långvarig regelbunden användning av järntillskott när ferritinnivåerna är normala eller till och med höga (hyperferritinemi) kan ge upphov till allvarliga leverkomplikationer som hemokromatos och levercancer. Läkemedelsinteraktioner förekommer. Exempelvis hämmas järnabsorptionen av ciprofloxacin med 50 procent. Järntillskott bör heller inte kombineras med intag av alendronat, levodopa eller antacida.
Återgång till sport
Det finns inget som hindrar idrottare från att fortsätta idrotta vid anemi, men ökad trötthet, utebliven träningsrespons och försämrad kondition kan leda till att man slutar med träning och tävling. Idrottare med anemi till följd av talassemi eller annan hematologisk sjukdom bör först rådgöra med hematolog. Det är viktigt att behandla grundorsaken, substituera vid behov, följa upp idrottaren noggrant och överväga avrådan från träning och tävling om hälsotillståndet bedöms kunna skada idrottaren på kort eller lång sikt.
Förebyggande arbete inom idrotten
Kvinnliga elitidrottare bör screenas årligen avseende blod- och järnstatus, minst innefattande Hb, S-Fe, TIBC, T-sat och S-ferritin. Även manliga idrottare bör kontrollera hemoglobinvärdet regelbundet, men med glesare intervall än kvinnor. I den allmänna hälsokontrollen av idrottare bör också en riktad anamnes avseende menstruationscykel och menstruationsvolymer ingå. Läkaren kan välja att behandla profylaktiskt med järntillskott under menstruationsperioder eller regelbundet under hela menstruationscykeln. För dessa kvinnor kan det krävas diskussion med gynekolog om behandling med tranexamsyra, alternativt hormoner, för att minska blödningen eller uppnå blödningsfrihet.
Vissa idrotter, exempelvis elitfotbollen, har krav på medicinsk undersökning av spelaren innan hen godkäns för spel, där bland annat screening för anemi ingår. Sådan screening av idrottare är i första hand en angelägenhet för klubbar och idrottsförbund på elitnivå.
Läs även författarintervjun med Amanda Lahti.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.