För nästan 100 år sedan beskrev den franske läkaren Pierre Mauriac ett syndrom som fått bära hans namn, med tillväxthämning, försenad pubertet, cushingoida drag och hepatomegali vid dåligt kontrollerad typ 1-diabetes.
Med dagens aktiva diabetesvård är syndromet mycket sällsynt, men ändock förekommande. Men trots att tillståndet har viktiga kliniska implikationer, och är lätt behandlingsbart, är denna diabeteskomplikation väsentligen okänd.
Här presenteras en ung patient med dåligt inställd typ 1-diabetes som utvecklade hepatomegali, hyperlaktatemi och histopatologiska förändringar i levern förenliga med glykogenos, ett tillstånd som snabbt reverserades genom normaliserad glukoskontroll.
För snart 100 år sedan beskrev den franske läkaren Pierre Mauriac ett syndrom hos patienter med dåligt kontrollerad diabetes, nämligen leverförstoring, tillväxthämning och försenad pubertet [1]. Senare studier har visat att syndromet också åtföljs av hepatisk glykogenos, som orsakar hepatomegali och förhöjda levervärden, och numera i normalfallet inte omfattar tillväxthämning och försenad pubertet [2-5].
Nedan beskrivs ett autentiskt patientfall hos en ung man med typ 1-diabetes. Patienten har lämnat muntligt och skriftligt medgivande till denna rapport.
Fallbeskrivning
En 18-årig yngling med en glykemiskt relativt dåligt reglerad typ 1-diabetes sedan 4 år tillbaka uppsökte akutmottagningen på grund av diabetisk ketoacidos. Han stod på gängse 4-dos basal bolusbehandling med insulin degludek och insulin aspart (1,2 E/kg/dag), men med varierande följsamhet. Dygnet före ankomst hade han haft långdragen hyperglykemi och kräkningar, men hade slut på måltidsinsulin.
På akutmottagningen var patienten takykard, men i övrigt opåverkad. Hans P-glukos var 40 mmol/l, och en arteriell blodgasanalys visade pH 7,02, bikarbonat 9 mmol/l, basöverskott –24 mmol/l, P-kalium 5,1 mmol/l, P-laktat 5,5 mmol/l och B-ketoner 3,9 mmol/l.
Patienten överfördes till Iva för sedvanlig behandling av ketoacidosen med intravenös insulininfusion (initialt 3,6 E/h) och vätskor, bland annat 10 procent glukos. Patienten vårdades 4 dygn på Iva med snabb normalisering av hyperglykemin (P-glukos från 37 mmol/l till 12 mmol/l på <5 h) och ketos. Vårdtiden förlängdes av en oväntad, tidig och långdragen stegring av P-laktat (som mest 6,8 mmol/l) och kraftigt förhöjda levervärden (som mest P-ALAT 16,2 μkat/l [referensvärde <1,1], P-ASAT 5.0 μkat/l [<0,75], P-ALP 3,2 μkat/l [0,7-1,9], P-GT 1,6 μkat/l [0,15-1,0], P-LD 21,8 μkat/l [1,8-3,4], P-PK 1,8 [0,9-1,2]) och P-albumin 28 g/l [36-48]. Patienten hade normala levervärden vid ankomsten och negerade alkohol, paracetamol, andra mediciner än insulin samt naturläkemedel och dylikt. P-paracetamol kunde inte påvisas. B-HbA1c var 69 mmol/mol. Kompletterande provtagning var negativ för virushepatitblock, CMV, EBV, HSV, VZV, ANA, ANCA och antikroppar mot glatt muskulatur.
Laktatstegringen väckte misstanke om sepsis, varför patienten rundodlades och insattes på intravenöst cefotaxim; samtliga odlingar utföll dock negativa.
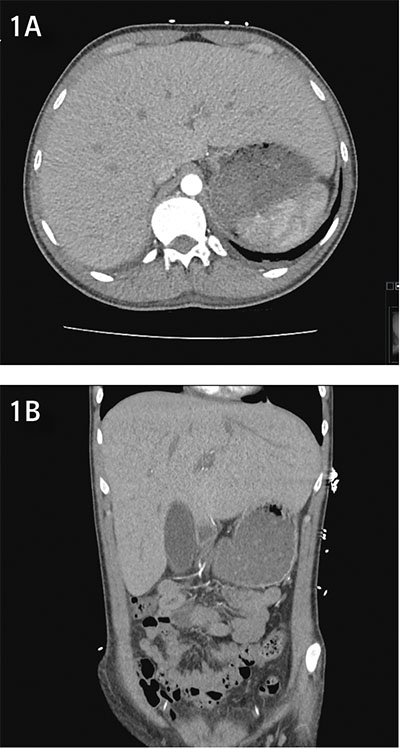
För att utesluta avflödeshinder i levervener och portakretslopp gjordes DT buk som inte kunde påvisa något sådant; däremot en uttalad hepatomegali (Figur 1), men inga tecken till steatos eller andra parenkymförändringar.
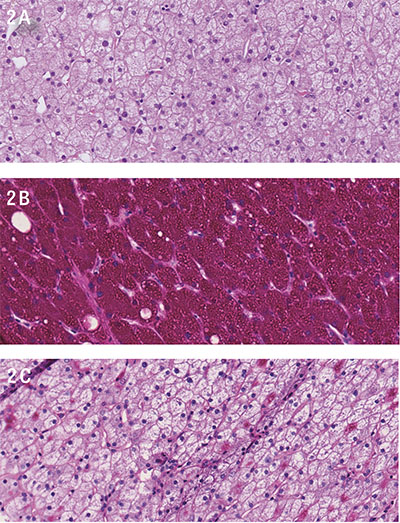
På misstanke om hepatisk glykogenos sekundär till hyperglykemi, och i viss mån på grund av den snabba snabba sänkningen av P-glukos med intravenös insulininfusion i kombination med 10 procent glukos, utfördes leverbiopsi. Denna visade lobulär påverkan med utbredd ballonering av hepatocyter och riklig förekomst av glykogen (Figur 2). Inga belägg för inlagring av fett, järn eller PAS–diastasresistent material noterades. Fynden bedömdes av den erfarne patologen bäst överensstämma med en glykogen hepatopati.
Patienten vårdades därefter på medicinsk akutvårdsavdelning i två dygn med vanliga subkutana underhållsdoser av insulin och med god och stabil glukosprofil. Han skrevs ut till hemmet i habitualtillståndet, och uppföljande blodprovstagning några veckor senare påvisade en normaliserad leverprofil.
Diskussion
Vi beskriver här ett fall av uttalad men reversibel hepatisk glykogenos och hyperlaktatemi hos en ung man med typ 1-diabetes.
Moderna publikationer fokuserar på hepatomegalin och glykogeninlagringen i levern som de numera dominerande kriterierna för Mauriacs syndrom [2-9]. Att tillväxtrubbningar och försenad pubertet numera ytterst sällan ses vid detta syndrom torde kunna tillskrivas att nutida diabetologi med mer fysiologisk behandling i form av flerdosinsulin i pennor eller pumpar i kombination med icke-invasiv kontinuerlig glukosmonitorering resulterat i avsevärt bättre och stabilare glykemisk kontroll än på Mauriacs tid – knappt 10 år efter upptäckten av insulin – med de begränsade och primitiva behandlings- och monitoreringsmöjligheter som då stod till buds.
I fattiga länder med begränsad eller ingen tillgång till modern diabetesbehandling förekommer dock fortfarande tillväxtrubbningar och försenad pubertet, sorgligt nog ibland då patienter inte har haft råd med insulin.
Differentialdiagnostiska överväganden vid en klinisk bild som hos vår aktuella patient bör, förutom basal leverutredning, inkludera en genetiskt betingad och kongenital hepatisk glykogenos, till exempel glykogeninlagringssjukdom [10]. Vår patient hade dock bevisligen tidigare normala leverprov, och de förhöjda värdena gick dessutom prompt tillbaka, vilket utesluter genetisk glykogeninlagringssjukdom.
Relativt nyligen uppmärksammades att också hyperlaktatemi kan vara ett delfenomen i Mauriacs syndrom [11-14], precis som hos vår patient. Laktatstegringen i sig väcker ofta misstanke om septikemi, och i kombination med glykogenos i levern leds tankarna till glykogeninlagringssjukdom eller annan kongenital metabol rubbning. Även om laktatstegringens relation till glykemi och glykogeninlagringen i levern förblir ofullständigt känd är det värt att erinra om Cori-cykeln och leverns roll i laktatomsättningen [15, 16].
Det förhållandet att såväl laktatstegringen som
de förhöjda levervärdena snabbt normaliserades då patientens glukoskontroll optimerats talar för att avvikelserna var orsakade av patologisk glukosmetabolism. Mekanistiskt resulterar den minskade nedbrytningen av glykogen i hämmad glukoneogenes, vilket minskar omvandlingen av pyruvat till glukos så att pyruvat i stället metaboliseras till laktat.
Dålig glykemisk kontroll och bristande följsamhet till insulinordinationer är inte ovanligt vid typ 1-diabetes, speciellt hos yngre individer. Detta leder dock, åtminstone såvitt känt, sällan till symtomgivande glykogeninlagring, leverförstoring, kraftigt förhöjda levervärden eller laktatstegring. Även om detta sannolikt ändå sker i vissa fall, men inte upptäcks före normalisering, så inställer sig ändå frågan om en genetisk orsak till syndromet som gör drabbade individer mer känsliga för massiv glykogenos vid hyperglykemi. I litteraturen återfinns endast ett fall av en dokumenterad genetisk orsak till Mauriacs syndrom, hos en patient med en inaktiverande mutation i den katalytiska subenheten för glykogenfosforylaskinas, ett enzym som reglerar nedbrytningen av glykogen i levern [17]. Mutationen skulle därmed bidra till att glykogen inlagras och ackumuleras i levern i stället för att brytas ned till glukos. För att undersöka denna möjlighet hos vår patient, utan känd hereditet för liknande metabola rubbningar, analyserades genomiskt DNA med helexomsekvensering riktad mot en panel av kända sjukdomsgener med monogen koppling till leverglykogenoser. Denna analys kunde emellertid inte påvisa någon känd mutation hos vår patient.
Det är även möjligt att behandlingen av patienten med höga doser intravenöst insulin och 10 procent glukosdropp med snabb normalisering av glukoskontrollen kan ha bidragit till symtomutvecklingen. Även om detta är spekulativt bör man ha i åtanke att insulin är ett anabolt hormon som bland annat favoriserar produktionen av glykogen i levern genom aktivering av enzymet glykogensyntas. I situationer med både god tillgång på kalorigena kolhydrater (10 procent glukosdropp) och överskott av insulin skulle en snabb normalisering av glykemin (som i detta fall) förväntas medföra en snabb och uttalad glykogenproduktion.
Sammanfattningsvis illustrerar denna fallbeskrivning en i vårt land ovanlig och väsentligen okänd, men benign och reversibel, komplikation vid diabetes. Förståelsen av de underliggande metabola förutsättningarna för uppkomsten av Mauriacs syndrom, och behandlingen av detsamma, underlättas av kunskap om grundläggande fysiologiska vägar i kroppens omsättning av glukos. Huvudbudskapet i artikeln är dock att sprida kunskap om att tillståndet överhuvudtaget finns och att god glukoskontroll är botemedlet.
En kortare och omarbetad engelsk text har nyligen publicerats på temat »Image in clinical medicine«: Sjöholm Å, Mahma H. Glycogenic hepatopathy. N Engl J Med. Epub 19 okt 2024. doi: 10.1056/NEJMicm2403484.
Potentiella bindningar eller jävsförhållanden: Åke Sjöholm har uppburit föreläsnings- och konsultarvoden från Boehringer Ingelheim, Novo Nordisk, Novartis, Amarin, MSD, Astra Zeneca, Amgen, Abbott Diabetes Care, Grünenthal Nordic, Bayer, Lilly, Sanofi och Pfizer.