Genredigering baserad på gensaxen är en helt ny form av genterapi där det är möjligt att med precision förändra arvsmassan.
Utvecklingen har gått mycket snabbt. Ett flertal kliniska studier pågår, och det första preparatet har nyligen godkänts i USA och EU.
Av tekniska skäl är det främst blod- och leversjukdomar som studeras.
Genredigering kan genomföras på olika sätt, och framtiden får utvisa vilka metoder som är effektivast och samtidigt uppvisar lägst antal, och minst allvarliga, biverkningar.
Genredigering (gene editing) innebär att arvsmassan ändras på ett förutbestämt sätt. Det är en form av precisionsterapi som gör det möjligt att förändra gener i människans somatiska celler. Att omvandla arvsmassan i könsceller är för närvarande inte aktuellt, och därtill är behovet mycket litet, eftersom preimplantatorisk genetisk diagnostik i nästan samtliga fall möjliggör selektion av friska foster. Den numera mest använda teknologin för genredigering bygger på den år 2020 Nobelprisbelönade upptäckten av »gensaxen«. Det har skett en närmast explosionsartad utveckling under de senaste åren, och det finns inget som tyder på att takten kommer att avta. Särskilt i USA har ett flertal läkemedels- och teknologiföretag bildats med inriktning på genredigering. Ett stort antal kliniska studier pågår, och redan i dag finns godkända behandlingar för blodsjukdomar.
Genredigering är en metodintensiv teknologi, och här beskriver vi olika aspekter av de tekniker som i dag finns tillgängliga och gör även ett försök att blicka in i vad som skulle kunna bli möjligt i framtiden.
De första teknikerna för genredigering
Redan år 2005 kunde forskare i samarbete med det amerikanska företaget Sangamo Therapeutics visa att det var fullt möjligt att reparera ett skadat arvsanlag som orsakar svår kombinerad immunbrist [1]. Försöket gjordes på en gen med en mutation som hindrar funktionen hos ett signalprotein och därmed orsakar en mycket ovanlig och svår kombinerad immunbrist. Metoden som då användes var baserad på ett modulärt system av genteknologiskt förändrade proteiner där specifika aminosyrasekvenser bildar fingerliknande strukturer, så kallade zinkfingrar, genom att koordinera en zinkatom. Zinkfingrar binder till dubbelsträngat DNA, och tekniken har studerats vid ett flertal andra sjukdomar, men är komplicerad och arbetskrävande och har ännu inte lett till något godkänt läkemedel.
En annan metod för genredigering är den som förkortas TALEN (transcription activator-like effector nucleases). Den har sitt ursprung i bakterier som infekterar växtceller och har den fördelen att teknologin är enklare att använda än zinkfingrar [2]. Strax efter att TALEN började studeras för genredigering publicerades upptäckten av gensaxen [3]. Eftersom gensaxen är betydligt enklare att använda, kom forskningen att närmast helt koncentreras kring den teknologin, och TALEN fick aldrig det uppsving som många hade väntat sig. Det pågår fortfarande utveckling av både zinkfingrar och TALEN, men i blygsam omfattning, och teknikerna kommer därför inte att beskrivas vidare här.
Gensaxens genombrott
Gensaxen, som vi och andra tidigare har beskrivit i Läkartidningen [4-6], har även den sitt ursprung hos bakterier. För en mer omfattande översikt av utvecklingen av precisionstekniker för att förändra arvsmassan, inklusive den Nobelprisbelönade teknologin för att specifikt inaktivera gener, och med fokus på genredigering, hänvisas till [7]. Bakteriernas värsta fiende är de virus som kallas bakteriofager, vilka tillsammans också utgör den mest frekvent förekommande organismen på vår planet. Bakterier har utvecklat flera olika sätt att försvara sig mot olika typer av bakteriofager varav gensaxen, det vill säga Crispr/Cas (clustered regulatory interspaced short palindromic repeats/Crispr-associated system) utgör ett. Cas är det enzym som klyver båda strängarna i DNA. I bakteriernas redigeringskomplex ingår även RNA som sekvensspecifikt söker upp motsvarande områden i arvsmassan. Vid klinisk genredigering har RNA ersatts med syntetisk arvsmassa i form av guide-RNA (gRNA).
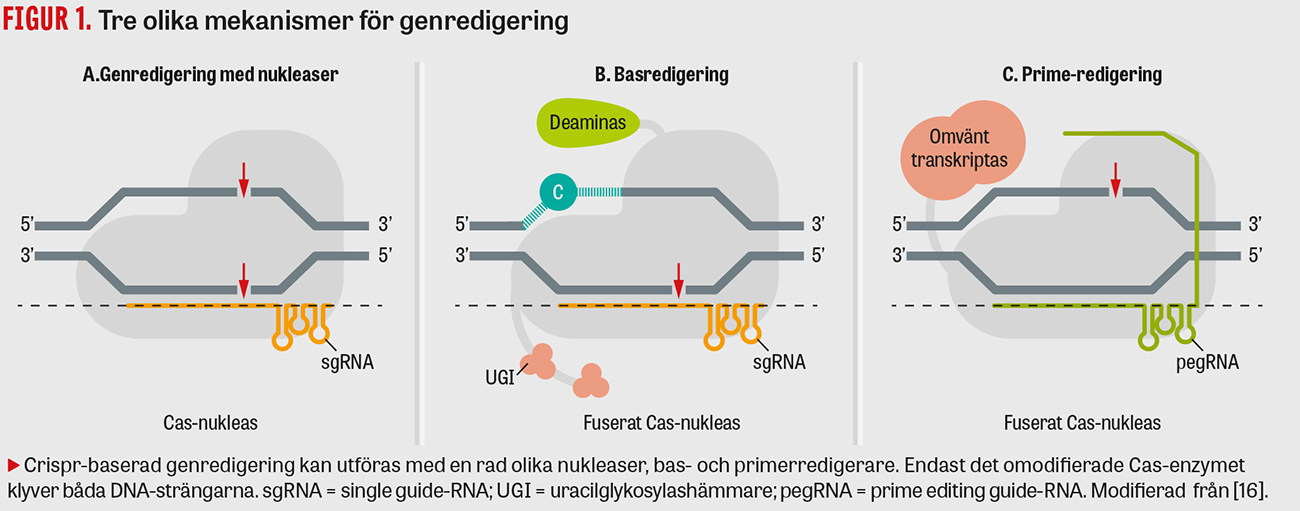
Tre nya teknologier för genredigering baserade på gensaxen har utvecklats under de senaste åren och beskrivs schematiskt i Figur 1. Den första metoden (Figur 1A) liknar den som bakterierna använder sig av i sitt försvar mot bakteriofager och bygger på klyvning av båda DNA-strängarna i en kromosom med hjälp av enzymet »gensaxen«. När ett sådant kromosombrott ska repareras av cellens egna enzymer uppstår ofta genetiska förändringar, vilket kan vara önskvärt om man vill inaktivera ett arvsanlag. Intellia Therapeutics nyligen utvecklade gensaxteknologi har redan använts som terapi för »Skelleftesjukan« (transtyretinamyloidos), och även svenska patienter har behandlats, något som nyligen beskrivits i Läkartidningen [8]. Om man i stället önskar reparera ett skadat arvsanlag så att det återställs kan man tillföra ett externt DNA-fragment som fungerar som ett slags mall (templat).
Nästa metod som utvecklades benämns basredigering (base editing) (Figur 1B). Här eftersträvar man att klyva endast den ena DNA-strängen för att åstadkomma vad som brukar benämnas en »nick«, medan den andra strängen förblir intakt. Det sker genom användning av en fusion av ett katalytiskt inaktiverat Cas och enzymet deaminas. Cytosindeaminas förändrar basen cytosin till uracil, som därefter omvandlas till tymidin i det kromosomala DNA:t, det vill säga C→T. Adenosindeaminas omvandlar i stället adenosin genom att substituera dess aminogrupp med en ketogrupp till inosin som vid replikation känns igen som guanin, det vill säga A→G. Med de nuvarande teknologierna finns därför begränsningar kring vilka förändringar man kan åstadkomma med basredigering. Intensiv forskning pågår i syfte att göra det möjligt att utföra även andra utbyten av nukleotider.
Den senast tillkomna redigeringsteknologin kallas primerredigering (prime editing) (Figur 1C). Liksom vid basredigering krävs inte något dubbelsträngsbrott, utan det räcker med att klyva endast den ena DNA-strängen. Samtidigt blir metoden mycket effektivare om man även klyver den andra strängen. Genom att kombinera en primer som binder till den ena DNA-strängen med enzymet omvänt transkriptas blir det i teorin möjligt att åstadkomma nästan vilka sekvensförändringar som helst. Begränsningen består främst av hur långa sträckor av nytt DNA som kan syntetiseras av enzymet, och för närvarande uppgår det till ca 50 nukleotider. Primerredigering befinner sig ännu i sin linda, och framtiden får utvisa hur effektiv den är i ett kliniskt sammanhang.
Ytterligare en möjlighet är att korrigera sjukdomsrelaterade cellulära processer genom att introducera epigenetiska förändringar, så kallad epigenomredigering. Detta sker med hjälp av modifierade gensaxar helt utan att klyva DNA eller förändra sammansättningen av nukleotiderna. Epigenetik spelar en central roll i reglering av genuttrycket. Därför kan genredigering som riktar in sig på att förändra de kemiska modifieringarna av kromatinet tillämpas för att påverka celler. Endogena epigenetiska förändringar kan bevaras även efter celldelning. Det saknas däremot ännu grundläggande kunskap om vad som händer när dessa förändringar introduceras genom epigenomredigering. I vilken utsträckning kommer de att bevaras?
Utöver att genredigering utgör en behandling i sig, används metoden även för att förbättra och utveckla befintliga behandlingar. Chimärisk antigenreceptor (CAR)-T-celler används i dag som behandling av B-cellsmaligniteter, inklusive myelom. Med hjälp av genredigering kan man framställa CAR-T-celler med förbättrade egenskaper genom att introducera den chimäriska receptorn med högre precision till rätt ställe i arvsmassan. En intressant ny utveckling är genredigerade allogena CAR-T-celler. Detta koncept innebär att patientens egna T-celler inte behöver användas. När den teknologin är fullt utvecklad går det mycket snabbare att komma till behandling, och rimligen borde dessutom kostnaden sjunka.
Kliniska studier
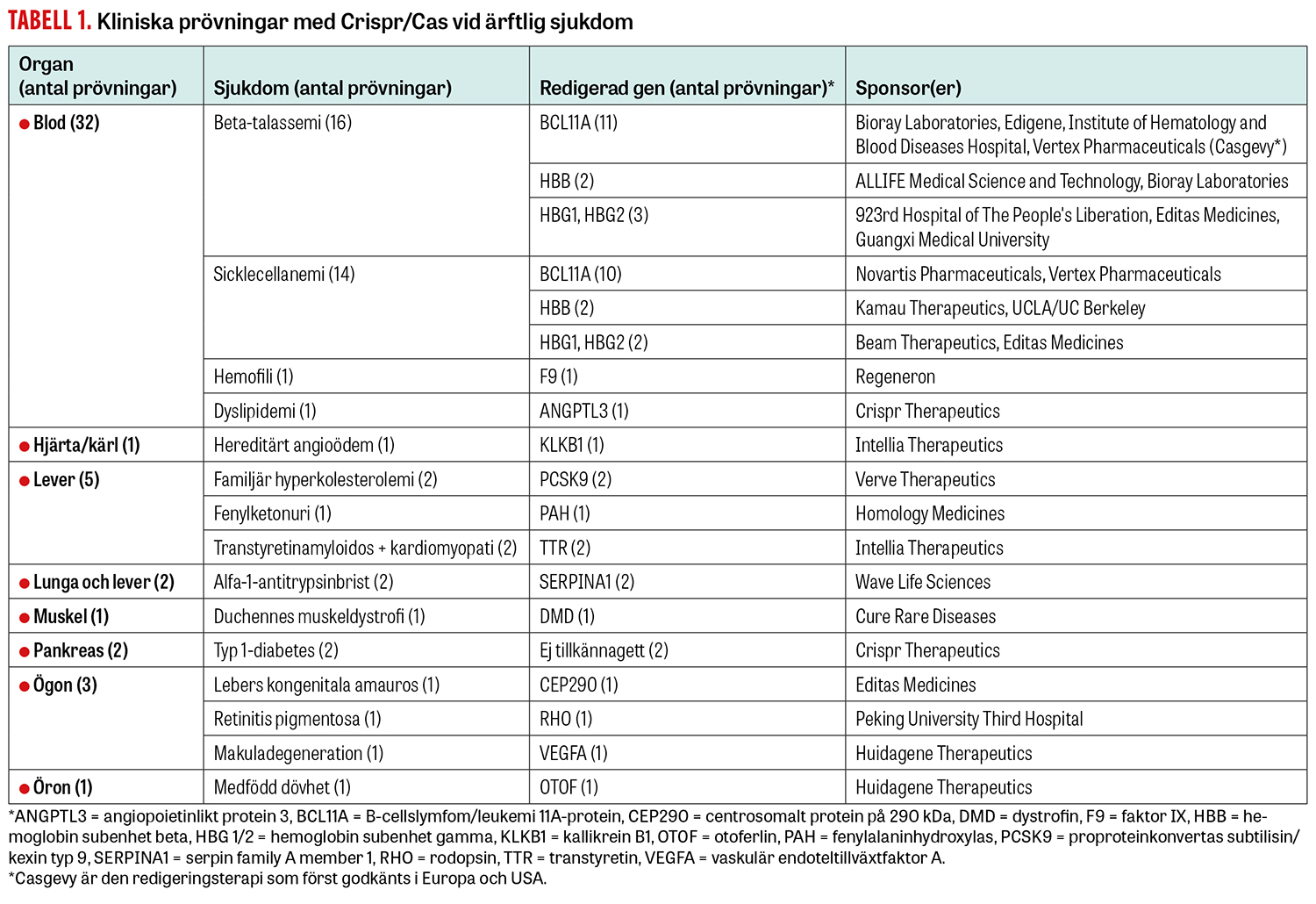
Som vi tidigare rapporterat [6] publicerades den första kliniska studien med genredigering av ärftlig sjukdom i New England Journal of Medicine i januari 2021 och omfattade patienter med sicklecellanemi samt talassemi [9]. Vertex Pharmaceuticals tillsammans med Crispr Therapeutics blev först med att få ett preparat baserat på genredigering godkänt. Det skedde den 16 november 2023 i Storbritannien, där preparatet godkändes av Medicines and Healthcare products Regulatory Agency (MHRA) för behandling av just sicklecellanemi och talassemi [10]. I december 2023 godkändes behandlingen i USA, och i februari 2024 i EU. Preparatet Casgevy (exagamglogen-autotemcel) bygger på inaktivering av patientens egen gen, BCL11A, i hematopoetiska stamceller. Motsvarande protein stänger efter födseln av syntesen av fetalt gamma-globin, vilket leder till produktion av beta-globin, som hos patienter med sicklecellanemi eller talassemi är förändrat och orsakar sjukdom. Inaktivering av BCL11A leder till att fetalt gamma-globin fortsätter att bildas och därigenom att sjukdom förhindras. Tabell 1 sammanfattar de olika kliniska prövningar som är under genomförande.
Nyligen har klinisk basredigering in vivo för första gången rapporterats. Bostonbaserade Verve Therapeutics har behandlat 10 patienter med en heterozygot form av familjär hyperkolesterolemi. Det tekniska resultatet blev det man eftersträvade, med en sänkning av LDL med upp till 55 procent under minst 6 månader genom basredigering av genen PCSK9. 2 patienter drabbades av allvarliga biverkningar, varav 1 dödsfall, men dessa har tillskrivits grundsjukdomen och tros inte vara orsakade av behandlingen. En fas 2-studie är planerad till 2025 [11].
Genredigering i Sverige
Vad sker då i Sverige? Svenska patienter med Skelleftesjukan har redan behandlats vid Norrlands universitetssjukhus med läkemedel producerat av det amerikanska företaget Intellia Therapeutics [8]. Här tillförs genredigeringskomplexet, som framställts som nanopartiklar, direkt i blodet varefter partiklarna tas upp i leverceller där redigeringen sker. I mars 2024 behandlades den första patienten i en fas 3-studie av patienter med transtyretinamyloidos och kardiomyopati. Forskningsmässigt pågår aktiviteter kring genredigering vid flera universitet och sjukhus. Vid Karolinska institutet och Karolinska universitetssjukhuset Huddinge pågår i samband med etableringen av ett ATMP-centrum en satsning på att ta fram genredigeringsbehandlingar för ärftliga immunbristsjukdomar samt att möjliggöra produktion enligt god tillverkningssed (GMP) av redigeringskomponenter för en ny form av behandling av sicklecellanemi till en väsentligt reducerad kostnad. Tillgången till GMP-faciliteten Vecura innebär att viktig infrastruktur redan finns på plats.
Risker
Trots att det är mycket angeläget är teknikerna för genredigering ännu så pass nya att det inte går att göra en adekvat klinisk riskbedömning. Även om antalet behandlade patienter ökat kraftigt är observationstiderna ännu korta. Det går dock att konstatera att akut toxicitet hittills inte har noterats. En uppenbar risk är att det skulle kunna inträffa redigeringar på fel ställe i arvsmassan. Med storskalig DNA-sekvensering/helgenomsekvensering är det möjligt att i förväg studera förutsättningarna för den risken, även om det inte alltid går att generalisera, eftersom människor med olika genetisk bakgrund kan uppvisa sekvensskillnader. Som nämnts kan ett dubbelsträngsbrott repareras felaktigt, vilket även kan utgöra själva behandlingsstrategin, som vid önskad inaktivering av ett arvsanlag. Samtidigt kan också andra arvsanlag råka skadas, särskilt de med sekvenslikheter. Mer allvarligt är det om fler än ett dubbelsträngsbrott samtidigt uppstår i en cell, eftersom det kan leda till translokationer. De flesta av dessa kan förväntas minska cellens överlevnadsförmåga, men vissa translokationer kan orsaka uppkomst av tumörer. Det innebär att tekniker såsom basredigering och primerredigering borde vara mindre riskabla, eftersom de normalt inte leder till ett dubbelsträngsbrott. Här behövs mer forskning och uppföljande studier för att studera säkerheten hos olika genredigeringsmetoder. Säkerhetsaspekterna behöver samtidigt vägas mot risken för fördröjning av ibland botande behandlingar vid allvarlig sjukdom. Den europeiska läkemedelsmyndigheten EMA (European Medicines Agency) har nyligen publicerat en sammanställning av genredigerande medicinprodukter (GEMP), och i den översikten belyses utmaningar gällande såväl kvalitet som kliniska tillämpningar [12].
Som tidigare uppmärksammats i Läkartidningen [6, 13] kan nya tekniker också missbrukas. Det skedde när en senare fängelsedömd kinesisk forskare genomförde genredigering på mänskliga embryon. Genredigering kan alltså missbrukas, och det är svårt att förebygga.
Annan genterapi i jämförelse med genredigering
Som vi tidigare rapporterat har ett flertal genombrott skett inom genterapifältet [4, 6]. Det finns redan ett antal behandlingar som godkänts av den amerikanska läkemedelsmyndigheen FDA (Food and Drug Administration) och EMA. När hela arvsanlag överförs till celler kan de integreras i en kromosom eller hamna utanför som episomer. De retrovirusbaserade teknologier som användes runt millennieskiftet innehöll kraftfulla genaktiverande sekvenser som visade sig innebära risker för tumörutveckling efter kromosomal integration. Allvarliga biverkningar har väsentligen eliminerats genom användning av så kallade självinaktiverande (SIN) vektorer samt bruk av endogena sekvenser för att kontrollera genuttrycket [14]. En integration i arvsmassan innebär ändå alltid en viss risk, eftersom den kan leda till att ett endogent arvsanlag påverkas. Det medför att genredigering sannolikt kan vara att föredra, samtidigt som kostnadsaspekter blir viktiga att ta hänsyn till.
En fördel med genredigering är att effekten i de flesta fall kan bli permanent. Vid vissa former av virusmedierad överföring av terapigener är långtidseffekterna mer osäkra. Kommer till exempel effekten av genterapi vid blödarsjuka med hjälp av adeno-associerat virus (AAV), som till skillnad från retrovirus inte integreras i arvsmassan, att bli beständig? Det mesta talar för att effekten kan komma att avta så mycket att behandlingen behöver upprepas. I USA har företaget CSL Behring satt priset för en engångsbehandling med den AAV-baserade genterapin, Hemgenix (etranakogen-dezaparvovek), för hemofili orsakad av brist på faktor IX till ca 29 miljoner kronor. Därtill kommer en administrationskostnad och kostnader för uppföljning, vilket sammantaget motsvarar många års behandling med faktorpreparat. Nyligen har Tandvårds- och läkemedelsförmånsverket (TLV) bedömt preparatets förutsättningar. TLV:s hälsoekonomiska analys visar att behandling med Hemgenix både kan ge bättre effekt och bli billigare än förebyggande behandling med faktor IX-koncentrat. Det förutsätter dock att effekten av behandling med Hemgenix är långvarig, vilket ännu är osäkert.
Även om AAV-baserad terapi kan fungera under lång tid är det mer troligt att genredigering skulle kunna medföra en livslång behandlingseffekt. Till skillnad från sicklecellanemi, där patienterna bär på samma genetiska förändring, finns det ett mycket stort antal olika mutationer vid hemofili B. Det gör ingen skillnad för AAV-baserad terapi, men innebär att genredigering blir mer tekniskt utmanande. Man kan välja mellan att skräddarsy behandlingar mot alla de olika varianterna eller att med precision tillföra arvsanlaget i form av ett mRNA som omvandlats till DNA (komplementärt DNA, cDNA) och som integreras i den muterade F9-genen. Genom att införa cDNA i själva F9-genen finns förutsättningar att bibehålla en normalt reglerad syntes av F9-mRNA. Det beror på att de DNA-sekvenser som kontrollerar genuttrycket är belägna inom samma kromosomala område. För en sådan redigering krävs att gensaxen skapar ett dubbelsträngsbrott samtidigt som tillförsel sker av ett templat för cDNA. Hälsoekonomiska kalkyler kommer att vara avgörande för att dessa nya metoder ska kunna införas i vården.
Även om mycket ännu är osäkert kring genredigering är det vår övertygelse att teknologin kommer att bli mycket användbar, och för flera indikationer kan den komma att komplettera eller helt ersätta existerande behandlingsformer. Utvecklingen går fort framåt, så vi förväntar oss att det redan inom några år kommer att finnas ett flertal godkända preparat.
Längst har man kommit med redigering av ärftliga sjukdomar som drabbar blodet och levern. Vid blodsjukdomarna har redigeringen hittills skett utanför kroppen, medan leversjukdomar kan behandlas in vivo, eftersom intravenöst tillförda redigeringskomplex har en förmåga att tas upp av hepatocyter. Lovande resultat finns även från experimentella studier av neurodegenerativa sjukdomar hos möss, och försök pågår att korrigera defekten vid till exempel cystisk fibros, även detta i möss.
Skulle andra sjukdomar än genetiska också kunna bli föremål för genredigering? Baserat på de erfarenheter som finns från genterapifältet i stort kan man definitivt förvänta sig det. Det gäller dels vid till exempel hiv, där det vore möjligt att i hematopoetiska stamceller redigera de gener som kodar för receptorerna som viruset använder vid infektion av olika immunceller [15]. Vid metabola lipidsjukdomar har man uppnått goda resultat med hjälp av terapeutiska oligonukleotider som tagits upp av hepatocyter, såsom siRNA och gapmerer, vilka båda bryter ned mRNA och därmed reducerar mängden av de proteiner som orsakar höga halter av blodfetter. Eftersom leverceller är mottagliga för genredigering kan man, som vi nämnt, förvänta sig att sådana behandlingar snart kommer att bli verklighet [11]. Det finns då goda förutsättningar för att en engångsterapi kan vara tillräcklig, vilket skulle göra metoden både patientvänlig och på längre sikt även kostnadseffektiv.
Vår bedömning är således att genredigering har en enorm potential. Teknologin har unika förutsättningar att åstadkomma permanenta genetiska förändringar och kommer med stor säkerhet att bli en viktig komponent i framtidens terapiarsenal. Det gäller inte enbart sällsynta ärftliga sjukdomar utan även till exempel metabola lipidsjukdomar som predisponerar för kardiovaskulär sjukdom. Det är dock ytterst viktigt att analysen av eventuella risker genomförs parallellt med den mycket snabba utvecklingen av teknologier för genredigering.
Peter Bergman, Karolinska institutet, har bidragit med värdefulla kommentarer.
Potentiella bindningar eller jävsförhållanden: C I Edvard Smith har ekonomiska intressen i Evox Therapeutics.
(uppdaterad 2025-02-26)