Läkemedelsverket påminner om risker för människor och djur som utsätts för sekundär exponering för transdermala läkemedel.
Förekomst av transdermal hormonbehandling hos personer i patientens närhet bör beaktas vid utredning av symtom med oklar etiologi.
Information om säker läkemedelshantering vid förskrivning av transdermala hormonläkemedel är viktig för att minska risken för sekundär exponering.
Överväg annan behandlingsregim eller beredningsform om följsamheten till riskminimerande åtgärder, som handtvätt och täckande kläder, kan förutsättas vara låg.
Rapportera misstänkta biverkningar för alla typer av läkemedel, även vid potentiell sekundär exponering, till Läkemedelsverket.
Hormoninnehållande läkemedel (hormonläkemedel) används för att behandla ett flertal medicinska tillstånd [1, 2]. Transdermala beredningsformer såsom plåster, gel, kräm och sprej har blivit vanligare det senaste årtiondet, bland annat då dessa visats ge färre komplikationer än orala beredningar [3-5]. Sekundär exponering för transdermala hormonläkemedel kan utgöra en risk för både människor och djur [6-8]. Under de senaste åren har Läkemedelsverket mottagit rapporter om misstänkta biverkningar hos barn, vuxna och sällskapsdjur, som hund och katt, som har blivit sekundärt exponerade för transdermala hormonläkemedel. De svenska rapporterna om misstänkta biverkningar, tillsammans med ett urval av internationella fall, har granskats och sammanställts i en publikation som ligger till grund för den här rapporten [9].
Beskrivning av misstänkta biverkningar
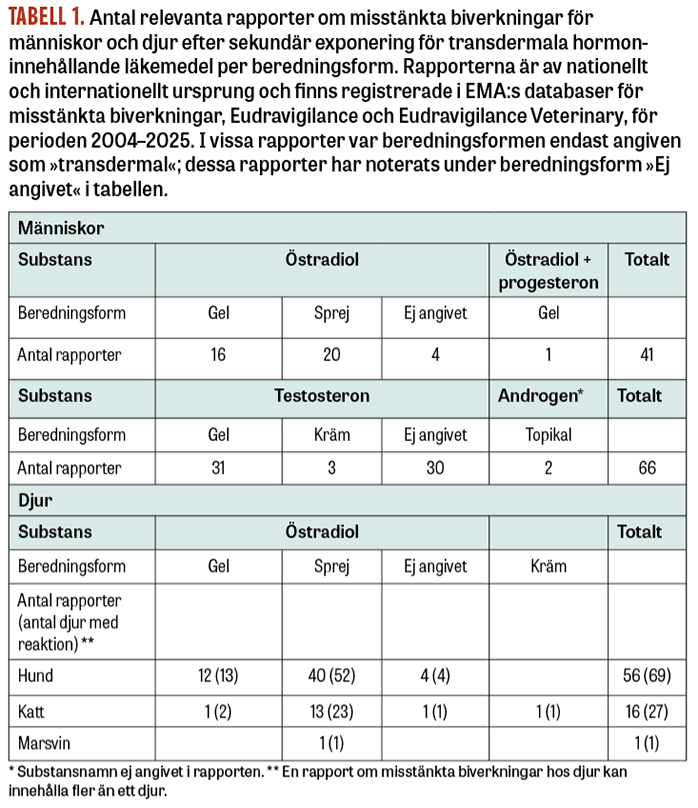
Läkemedelsverket har mottagit 14 rapporter (8 om östrogen och 6 om testosteron) gällande människor, varav 3 beskrivs nedan.
Rapport 1: flicka, 14 månader (2019). Rapporten inkom från sjukvården. En 14 månader gammal flicka undersöktes av läkare efter att ha utvecklat virilisering med klitorishypertrofi, akne och ökad kropps- och genitalbehåring. Efter utredning framkom att barnets far använde testosteroninnehållande gel. Fadern upplevde sig inte ha blivit informerad om risken för överföring av hormonläkemedlet via huden till andra personer. Han använde täckande kläder men hade inte alltid varit noggrann med handtvätt efter applicering av gelen. Flickans symtom gick inte tillbaka efter att exponeringen avslutats.
Rapport 2: flicka, 6 år (2022). Rapporten inkom från sjukvården. En 6 år gammal flicka undersöktes med anledning av att hon fått ökad kroppsbehåring. Flickans far behandlades med testosteroninnehållande gel. Blodanalys påvisade att flickans testosteronnivåer var förhöjda. Några månader senare var de fortfarande förhöjda, men nivån var sjunkande. Fadern misstänkte att exponeringen skett när dottern sovit nära honom eller när han burit henne. Han hade blivit informerad om nödvändiga försiktighetsåtgärder. Rapporten saknar information om huruvida symtomen gått tillbaka helt efter avslutad exponering.
Rapport 3: flicka, 6 år (2022). Rapporten inkom från sjukvården. En 6 år gammal flicka undersöktes med anledning av att hon hade utvecklat bröst, bröstvårtor, areola och tunn behåring av pubisområdet. Flickans mor stod på behandling med östrogeninnehållande sprej och applicerade den på underarmarna. Dottern hade vid upprepade tillfällen varit i direkt hudkontakt med moderns underarmar. Rapporten saknar information om huruvida symtomen gått tillbaka efter avslutad exponering.
Rapporter från övriga Europa och världen
Från övriga Europa och världen har relevanta rapporter om misstänkt sekundär exponering för hormoninnehållande läkemedel (41 rapporter om östrogeninnehållande läkemedel under perioden 2018–2025 och 66 rapporter om testosteroninnehållande läkemedel under perioden 2004–2025) påvisats i den europeiska läkemedelsmyndigheten EMA:s databas för misstänkta biverkningar, Eudravigilance (Tabell 1). Rapporter gällande östrogenläkemedel omfattade flickor och pojkar i åldrarna 0–14 år och en man av okänd ålder. Exponering för läkemedlet misstänktes ha skett via hudkontakt med en nära familjemedlem under behandling med östrogen i form av sprej, kräm eller gel. Barnen uppvisade bland annat för tidig pubertet, ökad tillväxttakt och skelettmognad, sen mental utveckling och gynekomasti. Rapporter gällande testosteronläkemedel omfattade flickor och pojkar i åldrarna 6 månader – 8 år och vuxna kvinnor. I dessa rapporter misstänktes i de flesta fall exponering via hudkontakt av en nära familjemedlem under behandling med testosteron i gelform, men det fanns även misstanke om exponering via textilier efter användning av gemensam handduk och hantering av tvätt från familjemedlem som behandlades med testosteronläkemedel. Hos barnen sågs symtom som virilisering, klitorishypertrofi, penisförstoring, ökad tillväxttakt och skelettmognad, aggressivitet och onormal längdtillväxt. I en av rapporterna beskrevs att barnets klitorishypertrofi behövde åtgärdas kirurgiskt. Hos vuxna kvinnor förekom virilisering, håravfall, ökad kroppsbehåring och olika typer av smärttillstånd. Hos kvinnor sågs även andra typer av allvarliga misstänkta biverkningar som infertilitet, missfall, amenorré, bröstcancer samt fall av urogenitala neoplasier.
Beskrivning av misstänkta biverkningar hos djur
Läkemedelsverket har mottagit 35 rapporter om misstänkta biverkningar efter sekundär exponering för hormonläkemedel (gel, sprej och kräm) hos totalt 49 hundar, katter och marsvin sedan 2019 (Tabell 1). De misstänkta biverkningarna var relaterade till exponering via hudkontakt med djurägare som var under behandling med östrogen i sprejform. Uppvisade symtom var bland annat extrema löpbeteenden trots kastration (ovariehysterektomi), nedsatt tillväxt, missbildningar och dödfödsel hos kattungar, alopeci, ledsmärta, trombocytopeni, leukopeni, nedsatt allmäntillstånd, utvecklade och inflammerade juver hos hanungar och underutveckling eller avsaknad av testiklar. Ytterligare 38 relevanta rapporter för totalt 48 hundar och katter påvisades i EMA:s databas (Tabell 1).
Diskussion
Sekundär exponering för hormonläkemedel misstänks kunna ge allvarliga biverkningar hos både barn, vuxna och djur. De beskrivna fallen ger exempel på hur olika den kliniska presentationen kan se ut och belyser vikten av relevanta frågor i anamnesupptagningen för att tidigt kunna inkludera sekundär hormonpåverkan som möjlig etiologi hos patienter med svårförklarliga symtom.
Sekundär exponering för hormonläkemedel kan lätt förbises hos både människor och djur [8-11]. Även det omvända förekommer: misstanken om sekundär exponering för hormonläkemedel kan fördröja diagnostisering av andra allvarliga sjukdomar. Detta finns beskrivet i en artikel där en 8 månader gammal flickas symtom först associerades med exponering för faderns testosteronläkemedel, men trots att symtomen inte klingade av efter avslutad exponering dröjde det 5 månader innan hon diagnostiserades med metastaserande adrenokortikalt karcinom [12].
Läkemedlets produktresumé är en viktig källa till säkerhetsinformation, och risken för sekundär exponering bör vara låg om det är säkerställt vid förskrivning att patienten tagit till sig nödvändig information och kan hantera läkemedlet på rätt sätt. Riskminimering kan behöva övervägas vid misstanke om låg följsamhet, till exempel användning av mindre exponerade applikationsställen som ljumsken eller nedre delen av magen, under förutsättning att det följer gällande behandlingsriktlinjer. Eventuellt kan förskrivning av andra beredningsformer vara lämplig till patienter med barn eller djur i sin närhet för att minska risken för sekundär exponering.
Försäljningen av transdermala hormonläkemedel i Sverige har ökat kraftigt: 21 procent för testosteronläkemedel och 53 procent för östrogenläkemedel de senaste 6 åren enligt E-hälsomyndigheten. Läkemedelsverket vill uppmana förskrivare att noggrant informera patienter om hur dessa läkemedel ska användas på ett säkert sätt. Läkemedelsverket vill också skapa en medvetenhet om att sekundär exponering för hormonläkemedel misstänks orsaka allvarliga biverkningar hos människor och djur samt betona vikten av att rapportera alla misstänkta biverkningar för alla läkemedel, även efter sekundär exponering, till Läkemedelsverket.
Läs även:
Författarintervju: 5 frågor till Karin Sjöström
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.