Samtidig administration av två eller flera intravenösa läkemedel i samma infart kan leda till utfällning, som kan ge kateterocklusion, terapisvikt och embolier.
Införande av filter som hindrar partiklar från bl a inkompatibilitetsreaktioner kan förkorta intensivvårdstiden för pediatriska intensivvårdspatienter.
För att ta reda på vilka läkemedel som är säkra att samadministrera finns ett flertal källor att söka bland.
När information om kompatibilitet hämtas från litteraturen är det viktigt att en farmaceutisk bedömning görs av informationens applicerbarhet på den enhet den rör; läkemedlets egenskaper såväl som avsedd koncentration och val av spädningsvätska måste beaktas.
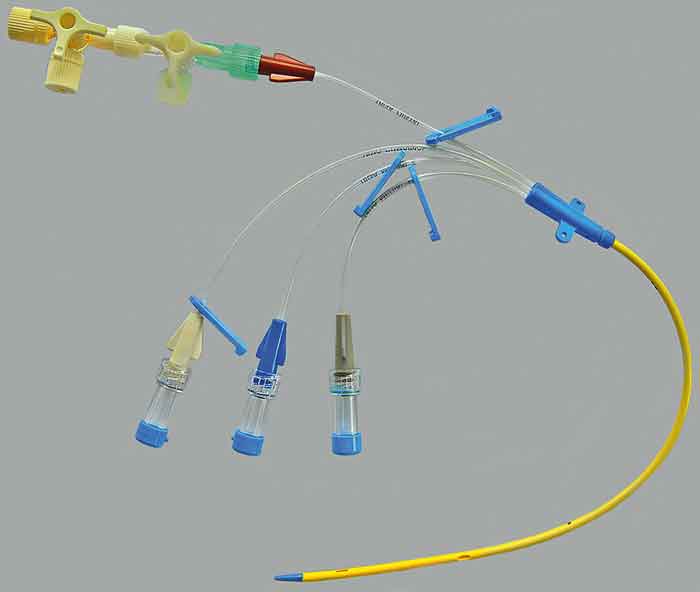
Inom sjukvården är intravenösa läkemedel vardag, och ofta behöver flera läkemedel ges samtidigt till samma patient. På vissa enheter är det normalt att patienter har en central venkateter med två till fyra separata lumen (Figur 1). På andra enheter kan perifer venkateter vara vanligare. I de fall antalet läkemedel överstiger antalet tillgängliga infarter ställs man inför en fråga: Får dessa läkemedel ges i samma infart?
Parenterala läkemedel måste vara lösta i en vätska eller emulsion. Läkemedel som administreras samtidigt eller direkt efter varandra i samma infart kan påverka varandras löslighet och stabilitet. Detta kan leda till utfällning eller nedbrytning som ökar risken för kateterocklusion, terapisvikt och embolier och därmed påverkar preparatets effekt och säkerhet [1].
Problem med osäkerheten kring kompatibilitet mellan läkemedel uppmärksammas sällan i rutiner, fackpress eller ordinationer. Vi vill härmed lyfta frågan om blandbarhet och belysa vad som kan göras för att minska riskerna vid samadministration. Vi ger också några exempel på läkemedel med extra stor risk att orsaka problem (Tabell I).
Utfällning, kemisk nedbrytning och emulsionsrubbning
Inkompatibilitet mellan läkemedelslösningar kan grovt delas in i tre typer: utfällning, kemisk nedbrytning och emulsionsrubbning. Utfällningar och emulsionsrubbningar kan leda till kateterocklusion, minskad effekt eller embolier [1]. Kemisk nedbrytning kan leda till minskad eller förändrad effekt.
Utfällning innebär att partiklar bildas. Ibland kan den ses som en grumlighet i lösningen (Figur 2). Många läkemedelssubstanser är svaga syror eller baser, och som sådana är de joniserade, alltså laddade, vid vissa pH-värden (sur miljö för baser respektive basisk miljö för syror). I sin joniserade form är substanser vattenlösliga, medan lösligheten av många läkemedel drastiskt minskar för den oladdade formen. Om pH i en lösning ändras så att mindre av substansen är i sin laddade form kan utfällning ske. Ett välkänt exempel är furosemid, som inte är kompatibelt med sura läkemedelslösningar, t ex midazolam [2].
Utspädning kan också ge utfällning. Om ett svårlösligt läkemedel som innehåller hjälpämnen för att förbättra lösligheten späds ut så att koncentrationen av ett hjälpämne blir för låg, kan substansen fälla ut. Ett exempel är Nimotop (nimodipin) vars lösning innehåller etanol, som enligt preparatets produktresumé gör att nimodipin fäller ut om det späds för mycket.
En annan mekanism som kan orsaka utfällning är komplexbildning. Detta kan ske mellan två läkemedel eller mellan läkemedel och tvåvärda joner såsom kalcium och magnesium [3]. Ett exempel som uppmärksammades stort är nio dödsfall av nyfödda som fått både intravenöst ceftriaxon och kalcium, vilket fällde ut som ett svårlösligt kalciumsalt och deponerades i de nyföddas lungkapillärer [4]. Detta fick amerikanska läkemedelsmyndigheten FDA att utfärda en varning för kombinationen och kräva ytterligare studier av företaget [5].
Vissa läkemedel (t ex diazepam och propofol samt parenteral nutrition som innehåller fett) administreras som emulsioner, dvs en heterogen blandning som innehåller små fettdroppar dispergerade i en yttre fas av vattenlösning, som hålls stabil genom tillsats av emulgeringsmedel. Om en utfällning av ett läkemedel inträffar i en emulsion, är det svårt att se partiklarna eftersom emulsionen är ogenomskinlig. Det finns också en risk att emulsionens stabilitet bryts och fettdropparna börjar slås ihop till större enheter (emulsionen »skär sig«) vid felaktiga tillsatser (t ex för stora tillsatser av fosfat) och infunderas i patienten som större fettdroppar [6].
Kemisk inaktivering syns inte med blotta ögat men kan göra att läkemedelseffekten förändras. Ett exempel är hydrokortison (Solu-Cortef) som bryts ner vid pH >8, enligt preparatets produktresumé. Därför kan effekten av hydrokortison försämras om det ges tillsammans med exempelvis bikarbonatinfusion.
Praktisk betydelse och prevalens
Samtidig administration av inkompatibla intravenösa läkemedel har konstaterats vid 3–25 procent av administrationstillfällena enligt olika studier [7-10]. Frekvensen varierar troligen beroende på att olika typer av verksamheter studerats, att olika mätmetoder använts och att kunskap och rutiner för att förebygga inkompatibilitet varierar mellan olika länder, sjukhus och verksamheter.
I två studier har samma forskare studerat iordningställande och administration av intravenösa läkemedel på två olika sjukhus (ett tyskt och ett brittiskt) och noterat vilka felaktigheter som kunde identifieras. Bland 122 observationer på det tyska sjukhuset noterades 65 felaktigheter, varav 31 rörde inkompatibla läkemedel som administrerades tillsammans. I studien på det brittiska sjukhuset genomfördes 430 observationer, och 249 felaktigheter noterades, varav 12 rörde inkompatibilitet. Dessa misstag bedömdes ha medfört en medelstor till stor patientrisk, enligt en validerad metod för bedömning av allvarlighetsgrad av läkemedelsfel. Det brittiska sjukhuset hade stöd av kliniska farmaceuter som kunde ge råd om inkompatibiliteter, och detta ansågs delvis ligga bakom den lägre andelen sådana fel där [7, 8].
En kanadensisk studie undersökte läkemedelsadministration av kontinuerliga infusioner på intensivvårdsavdelningar hos 434 patienter. Av dessa hade 198 patienter minst två kontinuerliga infusioner, varav man hos 37 patienter såg läkemedel som inte var dokumenterat kompatibla administreras tillsammans. Hos majoriteten av patienterna kunde en omfördelning av infusionerna mellan befintliga infarter ha löst problemet [11].
Utfällningar i infusionslösningar kan leda till igentäppta katetrar och försämrad effekt på grund av lägre upptag samt embolier [1]. Området är inte utförligt undersökt i kliniska studier, utan kunskapen om riskerna bygger främst på teoretiska överväganden, djurstudier och fallrapporter. Att för mycket partiklar i infusionslösningar inte är patientsäkert är dock allmänt accepterat [12].
De flesta kända fall av allvarliga komplikationer till inkompatibilitet rör total parenteral nutrition, och det finns ett antal fall beskrivna i litteraturen. Ett exempel är en beskrivning av en kvinnlig patient med total parenteral nutrition i hemmet på grund av Crohns sjukdom. Hon uppvisade feber, dyspné och torrhosta. Lungbiopsi visade på utfällningar från infusionen innehållande kalcium, kalium och kolatomer i lungartärer. Den exakta orsaken till utfällningarna kunde inte identifieras [13].
I en beskrivning av en patient med långvarig behandling med total parenteral nutrition beskrevs efter postmortal biopsi kristallina utfällningar, troligen bestående av kalciumfosfat, som orsakat mikroembolier i lungorna [14].
Enligt en äldre fallbeskrivning hade ett 12-månaders barn som under lång tid fått total parenteral nutrition plötsligt avlidit. Vid postmortal biopsi fann man granulom i lungorna, vilka ansågs bero på ansamling av partiklar från den stora mängd nutritionslösning som infunderats, bl a bomullsfibrer och glaspartiklar och även troliga utfällningar [15].
Total parenteral nutrition omfattar mycket komplexa lösningar med flera riskfaktorer för inkompatibilitet och bör så långt det är möjligt administreras separat eller endast med läkemedel där pålitliga kompatibilitetsdata finns [16].
Det finns studier som talar för att infusion av partiklar även kan ha andra skadliga effekter. I en nyligen genomförd randomiserad kontrollerad studie på en pediatrisk intensivvårdsavdelning sågs en signifikant förkortad intensivvårdstid och signifikant minskning av allvarliga komplikationer, främst systemiskt inflammatoriskt svarssyndrom (SIRS), efter införande av infusionsfilter [17]. Filtren minskar infusion av partiklar från både inkompatibilitetsreaktioner och andra källor.
Vidare analys av resultaten visade signifikant minskad förekomst av pulmonär, renal och hematologisk organdysfunktion i filtergruppen, medan det beträffande kardiovaskulär, neurologisk och hepatisk dysfunktion inte förelåg några signifikanta skillnader [18]. Studien var inte utformad för att upptäcka skillnader i förekomst av enskilda undergrupper av komplikationer, men belyser att oavsiktlig infusion av partiklar från olika källor kan ha negativa konsekvenser, som normalt inte upptäcks. Rutinmässig användning av infusionsfilter är en separat fråga med flera aspekter som inte fullständigt kan belysas i detta sammanhang.
Problem med inkompatibla läkemedelskombinationer upptäcks och registreras sällan, vilket leder till att negativa konsekvenser för patienten inte alltid kopplas till inkompatibiliteten. Emellertid känner de som arbetar med infusionsterapier vanligen till att inkompatibilitet förekommer och måste undvikas.
Problemen kan förebyggas
Gängse kompatibilitetsinformation i litteratur och databaser [19] är ofta baserad på fysikaliska kompatibilitetsstudier, där läkemedel blandas i lika delar och sedan observeras för utfällning under en definierad tid (vanligtvis 4 timmar) [20]. Exempel på användbara källor för kompatibilitetsdata ges i Tabell II. Informationen från sådana källor bör jämföras med den tänkta kliniska användningen med avseende på koncentration, lösningsmedel, beredningsform och eventuella hjälpämnen [21, 22]. Det är inte ovanligt att olika information om blandbarhet finns för samma kombination av läkemedel, beroende på variabilitet i ovan nämnda faktorer.
Om empirisk information om blandbarhet saknas, kan information om pH och kemiska egenskaper bidra till att undvika en stor mängd riskabla kombinationer [23]. Det finns exempel på olika system som tagits fram för att förenkla beslut om samadministration; ett exempel är att förse alla läkemedel med färgkoder redan i läkemedelsrummet för att ange vilka som kan blandas med varandra [24]. Bedömningen kan behöva göras från fall till fall, och på vissa enheter arbetar kliniska farmaceuter för att i enskilda fall ge råd om kompatibilitet.
Skräddarsydda hjälpmedel kan också tas fram lokalt för att hjälpa vårdpersonal att planera administrationen av de läkemedel som normalt förekommer på just den enheten [20, 25].
Lathundar utarbetas på Sahlgrenska universitetssjukhuset
På Sahlgrenska universitetssjukhuset i Göteborg har apotekare arbetat i projektform med att sammanställa enhetsbundna översikter/lathundar för blandbarhet av intravenösa läkemedel, baserade på tillgänglig kompatibilitetsinformation och den kliniska användningen av läkemedel på några utvalda enheter. Varje översikt utgörs av 35 läkemedel som kombineras med varandra två och två. Detta innebär 595 läkemedels-kombinationer per översikt.
Arbete pågår för att göra dokumentationen tillgänglig och validerad för ytterligare vårdenheter i landet som vill kunna arbeta på motsvarande sätt (Fakta 1).
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1.
Inom Västra Götalandsregionen har ett IT-projekt påbörjats som ska göra blandbarhetsbedömningar tillgängliga genom en webbaserad applikation. Målet är att en första version ska vara tillgänglig för testning under 2015.
Databasen kommer att göra det möjligt för vårdpersonal att på ett enkelt sätt själva söka kvalitetssäkrad information om de läkemedel man avser ge till sin patient. Den kan i framtiden även kopplas direkt till elektroniskt journalsystem i form av ett ordinationsstöd.
Projektet drivs av apotekare på klinisk farmakologi vid Läkemedelsenheten vid Sahlgrenska universitetssjukhuset i Göteborg.