Sammanfattat
Skallskador är extremt vanliga (incidens 400–600/100000/ år). Lätta skallskador utgör 80–97 procent.
Många patienter uppvisar betydande symtom, funktions- och/eller aktivitetsnedsättning lång tid efter trauma.
S100B är ett protein, rikligt förekommande i gliaceller och Schwannceller, som »läcker ut« från skadad hjärnvävnad till blodet där dess halt kan analyseras. S100B kan därmed användas som »biokemisk markör av hjärnvävnadsskada«.
Vi har kritiskt granskat de studier (sammanlagt 15) som använt S100B för prediktion av besvär, funktions- och aktivitetsnedsättningar längre tid (>3 månader) efter traumat.
Studierna visar varierande och delvis motsägande resultat. En möjlig delförklaring kan vara att man inte tagit hänsyn till S100B:s dynamiska egenskaper (snabb ökning i blodet med maximal koncentration 1–2 timmar efter trauma, därefter snabb minskning med »klinisk« halveringstid på några timmar).
Nya prospektiva studier behövs för att adekvat beakta S100B:s marköregenskaper (med hänsyn till tiden mellan trauma och provtagning och till koncentrationen för källor utanför CNS). Resultaten behöver valideras i ytterligare studier.
Den akuta diagnostiken vid lätt skallskada har som mål att avslöja intrakraniella blödningar som kan vara potentiellt livshotande och kräva neurokirurgisk åtgärd. Datortomografi (DT) av hjärnan är nu den gängse avbildningsmetoden som används i akutskede; den är tillgänglig på alla akutsjukhus i Sverige, kan användas som säkert alternativ för omhändertagande och är billigare än inläggning och observation på sjukhus [1].
Tidiga studier av biokemiska markörer av hjärnvävnadsskada (dvs ämnen som vid skada på hjärnvävnaden släpps ut från hjärnan till cerebrospinalvätskan och blodet, där de kan mätas) indikerade att analys av dessa markörer kan ha högre grad av sensitivitet än DT för att detektera hjärnvävnadsskada i samband med lätt skallskada [2]. Möjligheten att med hjälp av dessa markörer diagnostisera förekomst och omfattning av cerebral vävnadsskada har varit utgångspunkt för många studier, vilkas huvudmål varit att försöka förbättra möjligheterna till prognostisering efter traumatiska skall-/ hjärnskador.
Syftet med denna artikel är att ge en översikt av diagnostik vid lätta skallskador (mild traumatic brain injuries [MTBI]) och att kritiskt granska resultaten av forskningen kring möjlig användning av den sannolikt mest studerade biokemiska markören för hjärnvävnadsskada – S100B – för prediktion av patienternas besvär, funktions- och aktivitetsnedsättning längre tid efter traumatidpunkten (dvs >3 månader efter trauma).
En folksjukdom
Skallskador som orsakar någon påverkan eller skada på hjärnan drabbar individer i alla åldrar och är den enskilt absolut vanligaste CNS-åkomman.
Klassificeringen av skallskadans svårighetsgrad sker på basis av skattning av patientens kliniska tillstånd vid ankomsten till sjukhuset utifrån Reaction Level Scale (RLS) [3] eller Glasgow Coma Scale (GCS) [4] (GCS 3–8: svåra skallskador; GCS 9–12: medelsvåra skallskador; GCS 13–15: lätta skallskador).
Majoriteten av skallskadorna (80–97 procent) [5-10] är sk lätt skallskada/hjärnskakning/commotio/MTBI.
Incidensen av lätt skallskada (räknad som antal skallskadade som har kontakt med sjukvård/akutmottagning) varierar mellan 100 och 500 per 100000 individer i olika undersökningar [5, 10, 11]. Eftersom många individer som drabbas av lätt skallskada/MTBI inte tar kontakt med sjukvården, har WHO Collaborating Centre Task Force on Mild Traumatic Brain Injury dragit slutsatsen att den verkliga populationsbaserade incidensen för dessa skador sannolikt är >600 per 100000 individer och år [5].
Detta innebär att >54000 individer får en skallskada i Sverige varje år. Lätta skallskador/hjärnskakningar är således en folksjukdom.
Naturligt förlopp efter lätt skallskada
I akutskedet vid lätt skallskada ses, i anslutning till traumat, omtöckning alternativt kortare medvetslöshet (<30 minuter) och eventuellt amnesi (<24 timmar). Vid ankomst till sjukhuset uppvisar patienten ofta huvudvärk, illamående, kräkning, yrsel, dubbelseende, ljud- och ljuskänslighet [12]. Kognitiva symtom som koncentrationssvårigheter och minnessvårigheter samt affektiva symtom som irritabilitet, rastlöshet och känsla av att vara deprimerad hör till de symtom som patienter kan rapportera något senare.
Patienterna genomgår DT (omkring 6–10 procent av patienterna uppvisar patologiska DT-fynd [13]) alternativt observeras på sjukhuset eller i hemmet. Symtomen brukar försvinna eller minska successivt inom 3 månader. WHO Collaborating Centre Task Force on Mild Traumatic Brain Injury [14] konkluderade att »best evidence« indikerar att det inte finns några objektivt påvisbara kognitiva nedsättningar senare än 1–3 månader efter skadan hos majoriteten av vuxna och vidare att starkare studier visar att symtomen i allmänhet försvinner inom veckor eller några månader. En andel av patienterna har dock kvarstående symtom och funktionsnedsättningar under flera månader eller år efter skadan.
Det finns varierande uppgifter om hur många individer med lätt skallskada som har symtom 3 månader (24–84 procent [15]), 6 månader (82,8 procent [16]), 1 år (1–50 procent [15, 17, 18]), 3 år (79 procent [19]) eller upp till 7 år efter skadan (51 procent [20]).
Diagnos enligt internationella klassifikationer
Den internationella sjukdomsklassifikationen ICD-10 [21] innehåller diagnosen F07.2 med rubriker »postkontusionellt syndrom«, »postkommotionellt syndrom«, »posttraumatiskt hjärnsyndrom« för fall av kvarstående besvär och funktionsnedsättningar efter lätt skallskada. Mest etablerad är termen postkommotionellt syndrom, och vi väljer därför att använda denna benämning.
För att diagnosen ska kunna ställas krävs att minst tre av följande symtom föreligger: huvudvärk, yrsel, trötthet, irritabilitet, koncentrationssvårigheter och svårigheter att utföra intellektuella uppgifter, minnesstörningar, sömnlöshet samt nedsatt tolerans för stress, emotionella upplevelser eller alkohol.
Motsvarande diagnosförslag i den amerikanska psykiatriklassifikationen DSM-IV [22] är »post-concussional disorder«. För att ställa denna diagnos krävs, utöver anamnes på skalltrauma och minst tre symtom (lätt uttröttbar, sömnstörning, huvudvärk, yrsel/illamående, irritabilitet eller aggressivitet, ångest/oro, depression eller affektiv labilitet, personlighetsförändring [tex social eller sexuell avvikelse], apati eller nedsatt spontanitet), att man med neuropsykologiska test objektivt kan fastställa kognitiv nedsättning med avseende på koncentration eller minne.
Villkoren för bägge diagnoserna överlappar varandra i vissa delar – men de tillåter att det kan finnas patienter som uppfyller villkoren för postkommotionellt syndrom enligt ICD-10 men inte villkoren för »post-concussional disorder« enligt DSM-IV och tvärtom. Diagnoserna fortsätter att vara föremål för debatt och kritik (se tex [23-25]) med avseende på bla bristande specificitet och konsistens.
Det bör också observeras att symtomprofilen hos en patient med anamnes på lätt skallskada kan överensstämma i stort med symtomspektrum vid depression [26], långvarig smärta [27], WAD (whiplash associated disorder) [28], ångesttillstånd [29], posttraumatiska stresstillstånd [26], olika typer av missbruk [30] och hypofysinsufficiens [31] och att dessa tillstånd inte sällan föreligger samtidigt.
Definition av tillstånd efter lätt skallskada
Den oklarhet, oenighet och debatt som kännetecknar koncepten för diagnosdefinitioner av tillstånd efter lätt skallskada återspeglar villrådighet med avseende på tillståndens orsaker. De i litteraturen beskrivna orsakerna kan i stort klassificeras som att vara av i huvudsak organisk natur (skada på hjärnvävnaden) [32], psykologisk natur (frånvaro av påvisbara patologiska förändringar i hjärnan) [33] och kombinerad organisk/psykologisk natur [34].
Betydelsen av olika faktorer som ekonomisk kompensation [35], stress [23], premorbida faktorer som personlighet [36] samt posttraumatisk stress [37] för utveckling och bibehållande av symtom efter lätt skallskada har poängterats.
S100B – funktion
S100 är ett relativt litet protein (21 kDa) som består av två immunologiskt olika subenheter, S100A och S100B, med tre dimeriska isoformer S100A1A1, S100A1b och S100BB. Isoformerna S100BB och S100A1B benämns allmänt S100B [38] och finns i huvudsak i hjärnvävnadens gliaceller och Schwannceller. Utanför nervsystemet förekommer S100B [39] i fettceller, benmärg, kondrocyter och melanocyter (S100B används också som tumörmarkör för melanom [40]).
S100B-proteinet tillhör S100-proteinfamiljen [39] som är en grupp av kalciumbindande proteiner. S100B har visat sig ha en mängd funktioner såväl intra- som extracellulärt. Intracellulärt verkar S100B genom att inhibera proteinfosforylering av ett antal proteiner, genom att påverka cytoplasmatiska skelettet och genom att delta i regleringen av hjärnans energimetabolism.
S100B tycks utsöndras av gliaceller, och i låga koncentrationer (nanomolära) har det neurotrofisk funktion (stimulerar neurittillväxt och förlänger överlevnaden hos neuron etc). I högre koncentrationer (mikromolära) har S100B närmast toxisk effekt (stimulerar produktionen av proinflammatoriska cytokiner och NO och kan också i cellkulturer inducera celldöd genom apoptos och nekros [41]).
S100B – dynamik
S100B kan mätas i såväl cerebrospinalvätskan och blodet som urinen [42]. Efter skada på hjärnvävnaden orsakad av trauma ökar S100B-koncentrationen i blodet snabbt, varefter proteinet metaboliseras och/eller utsöndras via njurarna [43]. Den aktuella blodkoncentrationen är resultatet av både hur snabbt S100B »fylls på« till blodet och hur snabbt det försvinner/elimineras från blodbanan (genom att metaboliseras och/eller utsöndras till urinen).
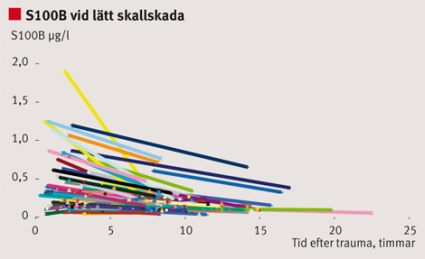
Figur 1 visar koncentrationer av S100B i blod hos en grupp patienter (n=88) med lätt skallskada (GCS 13–15), där koncentrationerna (y-axel) är plottade mot tiden efter skadan (x-axel). Koncentrationerna synes ha varit mycket varierande, och många patienter hade förhöjd koncentration (>0,15 (my)g/l) tidigt efter trauma, medan koncentrationerna var markant lägre i det sena provet. Hos patienter med okomplicerad MTBI (GCS 13–15 vid ankomst till sjukhuset) faller S100B-koncentrationen snabbt och understiger 0,2 (my)g/l inom 48 till 96 timmar efter trauma [44].
Metod
Sökning via PubMed med sökord »(S100B OR S-100B) AND traumatic brain injury« med begränsningen studier på människor gav 86 träffar. Genomgången av studierna visade att 15 studier redovisade uppföljningsvariabler insamlade 3 månader eller längre tid efter skadan, där relationen mellan dessa uppföljningsvariabler och S100B i blod i akutskede hade analyserats statistiskt. Ytterligare krav var att rapporten skulle innehålla en tydlig redogörelse för patienter med GCS 13–15 (några studier inkluderade även patienter med medelsvåra och svåra skallskador – dvs med GCS 9–12 respektive GCS 3–8).
Resultat
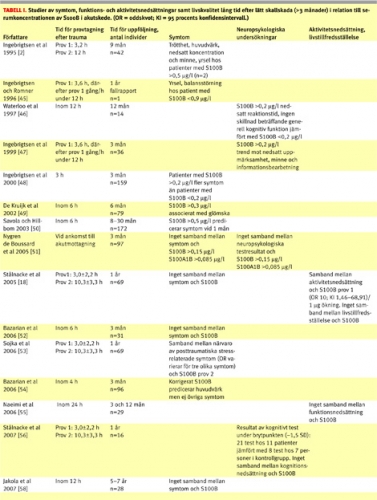
I 15 studier har koncentrationen av S100B i serum relaterats till olika utfallsmått/variabler (symtom, resultat av neuropsykologiska test, funktions- och/eller aktivitetsnedsättning, livstillfredsställelse) vid uppföljning efter 3 månader eller senare (Tabell I).
Symtom
I tio studier har symtom studerats i relation till koncentrationen av S100B, i sju av dem har instrumentet Rivermead Postconcussion Symptoms Questionniare (RPQ) [57] använts (instrumentet är särskilt utvecklat för att registrera och kvantifiera 16 vanliga symtom efter lätt skallskada, bla huvudvärk, yrsel, illamående och glömska).
Som kriterium för »post-concussion syndrome« använde Ingebrigtsen och medarbetare [48] närvaro av tre eller fler symtom 3 månader efter skadan. Författarna rapporterade en trend mot ökad förekomst av symtom hos patienter med förhöjd koncentration av S100B (>0,2 (my)g/l).
Bazarian och medarbetare [52] definierade »post-concussive syndrome« som närvaro av fem eller fler symtom. De korrigerade koncentrationen av S100B för extrakraniellt utsläpp med kreatinkinas (CK) och visade att korrigerat S100B kunde predicera huvudvärk 3 månader efter skadan, men inte övriga symtom.
Savola och Hillbom [50] registrerade enbart närvaro av symtom. Författarna använde sig av standardiserade S100B-värden (utifrån en halveringstid på 120 minuter) för konstruktion av ROC-kurvor (receiver operating characterististic curves) och visade att S100B >0,5 (my)g/l predicerade närvaro av symtom vid 1 månad efter trauma. Stålnacke och medarbetare [18] registrerade också närvaro av symtom men fann inte något samband mellan symtom 1 år efter trauma och koncentrationen av S100B i akutskede. RPQ har använts i ytterligare tre studier, som inte har kunnat påvisa någon relation mellan symtom och S100B [51, 54, 58].
De Kruijk och medarbetare [49] har använt ett egenkonstruerat formulär vid uppföljning 6 månader efter trauma och rapporterat om ett samband mellan S100B >0,3 (my)g/l och glömska.
Sojka och medarbetare [53] har undersökt förekomst av posttraumatiska stressrelaterade symtom i relation till S100B. De fann ett signifikant samband mellan koncentrationen av S100B i blodprov taget cirka 10 timmar efter skadan och närvaro av tre olika symtom registrerade med instrumentet Impact of Event Scale (IES) [59] 1 år efter skadetillfället.
Neuropsykologiska undersökningar
I fyra studier har neuropsykologiska test ingått i uppföljning. Nedsättningar av enstaka neuropsykologiska testresultat hos 7 patienter med S100B >0,2 (my)g/l [46] och en trend med nedsättningar av uppmärksamhet, minne och informationsbearbetning hos patienter med S100B >0,2 (my)g/l [47] har rapporterats tidigt. Ytterligare två studier har relaterat neuropsykologiska testresultat och koncentrationen av S100B utan att påvisa samband [51, 56].
Funktions- och aktivitetsnedsättning
Två studier har undersökt funktionsnedsättning/aktivitetsnedsättning efter lätt skalltrauma. Stålnacke och medarbetare [18] följde upp patienter 1 år efter skadetillfället med Rivermead Head Injury Follow Up Questionnaire (RHFUQ; ett instrument som används för att registrera förändringar av aktivitetsnivå hos patienter med hjärnskador [60]). Det inkluderar bla frågor om arbete, fritid och utförandet av rutinaktiviteter i hemmet. I studien kunde ett statistiskt signifikant samband mellan aktivitetsnedsättning och ökad koncentration av S100B påvisas.
Naeimi och medarbetare [55] använde Jennetts och Bonds 5-gradiga skala, men kunde inte finna något samband mellan funktionsnedsättning 1 år efter skadetillfället och S100B.
Livstillfredsställelse
Livstillfredsställelse (mätt med instrumentet LiSat-11 [61]) studerades av Stålnacke och medarbetare [18] 1 år efter trauma. Signifikant samband med koncentrationen av S100B i akutskede kunde dock inte påvisas.
Diskussion
Enstaka studier har visat på statistiskt, signifikanta samband (eller trender) mellan S100B i akutskede och utfallsmått, dvs symtom och/eller kognitiva funktionsnedsättningar (påvisade med neuropsykologiska test) och aktivitetsnedsättningar 3 månader eller längre tid efter skadan. I de olika studierna användes dock olika variabler, statistiska metoder, tidpunkter för blodprovstagning och olika metoder för analys av S100B. Mycket få studier (totalt fyra) har inkluderat kontrollgrupper i något avseende. Olika brytpunkter för S100B har använts, och ingen prospektiv validering av de föreslagna kriterierna (brytpunkter) har gjorts.
Egenskaper hos S100B som markör av hjärnvävnadsskada
Specificitet och sensitivitet. S100B förekommer normalt i nervsystemet i stora mängder i gliaceller och Schwannceller, men påträffas också i icke-neuronal vävnad (fettceller, benmärg, kondrocyter och melanocyter [39]. Detta faktum medför att ökning av serumkoncentrationen av S100B inte är specifikt bevis på förekomst av hjärnvävnadsskada. Ökning av S100B-koncentrationen i blodet kan således också ses utan föregående skalltrauma vid tex frakturer/multitrauma [62] eller efter återtransfusion av sårblod vid exempelvis torakotomioperationer [63].
I djurförsök har man visat att även stress kan leda till att S100B-koncentrationen i blodet ökar [64, 65].
S100B kan stiga i blodet också under till synes helt ordinära förhållanden – tex löpning, simning, matchspel av basketball, fotboll och ishockey [66-72]. Om skallskadan ägt rum under eller i anslutning till muskulärt arbete, kan ökningen av S100B i blodet tidigt efter skadan vara utryck för hjärnvävnadsskada, själva arbetet eller för kombinationen av båda.
Med utgångspunkt i observationen att serumkoncentrationerna av S100B och kreatinkinas var korrelerade till varandra hos maratonlöpare [71] tog Bazarian och medarbetare fram en korrektionsfaktor för att kompensera för S100B-utsläpp till blodet från extrakraniella vävnader [52]. När författarna på detta sätt korrigerade serumkoncentrationen av S100B för patienterna med lätt skallskada fann de att S100B:s förmåga att predicera huvudvärk 3 månader efter skadan förbättrades. När korrigerat S100B kombinerades med brytpunkt som maximerade sensitiviteten förbättrades dessutom prediktionen av negativa DT-fynd i akutskede.
Sensitiviteten hos S100B som markör av allvarlig intrakraniell patologi är inte helt övertygande, eftersom Undén och medarbetare [73] har rapporterat avsaknad av förhöjd S100B-halt i blodet hos några patienter med epidural blödning.
Sammanfattningsvis är specificiteten hos S100B med avseende på hjärnvävnadsskada således begränsad, framför allt vid små/mindre koncentrationshöjningar, men det tycks vara möjligt att korrigera för det S100B som inte härstammar från CNS. Ytterligare prospektiva studier behövs för att dokumentera och bekräfta om detta tillvägagångssätt är tillämpligt i praktiken för att förbättra prediktionen av långtidsbesvär efter lätt skallskada.
Kinetiken hos S100B vid traumatisk hjärnskada. Det har tidigt varit känt att koncentrationen av S100B i blod varierar under de första dagarna efter trauma hos patienter med svåra skallskador [74], medan den hos patienter med lätta skallskador minskar snabbt under de första timmarna efter trauma [2].
Ingebrigtsen och medarbetare [47] har något senare visat på behovet av att fastställa optimal tidpunkt efter trauma för analys av S100B. I studien tog de prov från 14 patienter upprepade gånger efter trauma och kunde visa att medelkoncentrationen av S100B i serum var högst 1–2 timmar efter trauma och att den därefter minskade snabbt med en halveringstid runt 2 timmar.
Trots denna kunskap har bara ett fåtal forskargrupper registrerat exakta tidpunkten för provtagning [2, 18, 45, 47, 48, 53, 56] och/eller tagit hänsyn till provtagningstider i sina analyser och prediktioner [50]. Att använda sig av S100B-koncentrationer i serum såsom mått på hjärnvävnadsskadan (prediktor) för att förutsäga långtidsutfallet utan att ta hänsyn till tidpunkten för blodprovstagningen medför nämligen att man inför en avsevärd osäkerhet i prediktorn; prediktionen blir därmed osäker och otillförlitlig.
Sammanfattningsvis sker den kliniskt observerade minskningen av koncentrationen hos patienter efter lätt skallskada mycket snabbt (halveringstid 1–2 timmar), vilket är en potentiellt starkt försvårande omständighet vad gäller den praktiska användningen av S100B för prediktion. Det finns således behov av nya studier som adekvat beaktar S100B-kinetiken och tar hänsyn till tidpunkten för provtagningen vid analyser av prediktioner.
Uppföljningsvariabler
Symtom. De flesta studier med symtom som utfallsmått (sju av tio studier som fokuserade på symtom) har använt instrumentet RPQ. Det finns således en tydlig standardisering med detta instrument av vilka symtom som registrerades, men tolkningen varierar. De flesta studier har använt helhetsskattningen av alla symtom (dvs totalsumman av RPQ) vid uppföljning [48, 51, 52, 54, 58], andra studier har bara registrerat närvaro av symtom [18, 50], medan studier av enbart enskilda symtom också förekommer [49, 52]. Bazarian och medarbetare använde sig av en egen definition av »post-concussion syndrome«, som tog hänsyn till symtomens svårighetsgrad [54].
I fyra studier har man visat statistiskt signifikanta relationer mellan S100B i akutskede och symtom sent efter skallskadan [49, 50, 52, 53]. Tre studier har varit negativa, dvs inte funnit statistiskt signifikant relation mellan S100B och sena symtom [18, 51, 54]. Förekomsten av posttraumatiska stressrelaterade symtom 1 år after skalltrauma har studerats av Sojka och medarbetare [53]. De fann ett statistiskt signifikant samband mellan dessa symtom och S100B i blodprovet taget relativt sent (cirka 10 timmar) efter skadan. Sammanfattningsvis föreligger det inte konsistenta resultat/data, som visar att symtom kan prediceras utifrån S100B-koncentrationer i blodet tidigt efter trauma. Se Fakta.
Neuropsykologiska undersökningar. Kognitiva symtom har undersökts i fyra studier med neuropsykologiska test [46, 47, 51, 56] 3 månader till 1 år efter skadan. Tre studier har också inkluderat bedömning av depression i samband med neuropsykologisk undersökning [46, 47, 56] (två olika instrument: BDI (Beck´s Depression Inventory) [46, 47] och MADRS (Montgomery–Åsberg Depression Rating Scale) [56]). Endast enstaka neuropsykologiska nedsättningar med avsaknad av statistisk signifikans förekommer hos patienter med mätbar S100B-koncentration [46, 47]. Således finns det inga övertygande relationer mellan kognitiva symtom påvisade med neuropsykologiska test och S100B. Se Fakta.
Övrigt. Två studier har använt funktions- och aktivitetsnedsättning som utfallsmått [18, 55]. Den ena studien visar att aktivitetsnedsättning med instrumentet RHFUQ kan prediceras med S100B [18], medan den andra studien visar på avsaknad av samband mellan funktionsnedsättning enligt Jennets och Bonds skala och S100B [55]. Livstillfredsställelse vid uppföljning ingår i endast en studie, som har använt instrumentet LiSat-11 utan att kunna påvisa samband med S100B [18].
Det är inte möjligt att dra någon tydlig slutsats från dessa studier beträffande möjligheter att predicera aktivitetsnivåer eller livstillfredsställelse utifrån koncentrationerna av S100B tidigt efter trauma. Se Fakta.
Material/populationer
Trots att samtliga studier har inklusionskriterier som baseras på GCS är de inte enhetliga. I de flesta studier (tio studier) har patienter med GCS 13–15 inkluderats [18, 47, 48, 50, 52-56, 58], medan enbart patienter med GCS 14–15 ingår i fem studier [2, 45, 46, 49, 51].
Patienternas ålder varierar i olika studier med medelvärden från 27 till 52 år; spridningen är stor, från 6 till 88 år.
Kontrollgrupper som omfattar friska icke-skallskadade individer förekommer bara i tre studier: Nygren de Boussard och medarbetare hade en kontrollgrupp med avseende på markörkoncentrationen [51], Stålnacke och medarbetare hade en kontrollgrupp med avseende på kognitiva nedsättningar [56] och Jakola och medarbetare hade en kontrollgrupp för jämförelse av RPQ och hälsoupplevelse [58].
Det skulle vara önskvärt att fler studier jämförde resultat med en kontrollgrupp, eftersom symtom efter lätt skallskada ofta är så allmänna och dessutom även förekommer hos personer som inte varit med om skallskada [75].
Konklusion
Kunskapen om S100B:s egenskaper som potentiell »biokemisk markör av hjärnvävnadsskada« har funnits i drygt 15 år. Incidensen av lätta skallskador bedöms vara mycket hög (>600/100000 invånare och år). Många patienter som drabbas av dessa skador uppvisar symtom, funktions- och aktivitetsnedsättningar i månader och år efter trauma.
Det är därför mycket förvånande att det finns endast 15 studier i vilka man undersökt S100B:s möjliga betydelse som prediktor av dessa långtidssequelae. Studierna inkluderar generellt relativt små populationer (14–182 personer), och andelen uppföljda är mycket varierande (mellan 30 och 100 procent). Likaså finns det olikheter vad beträffar de utfallsmått (i huvudsak symtom, endast i enstaka fall aktiviteter och livstillfredsställelse) och de statistiska metoder som använts.
Sammantaget gör skillnaderna mellan de olika studierna med avseende på design, brytpunkter, statistiska metoder och utfallsmått att det är svårt att bedöma resultaten, eftersom de inte sällan är motsägande. En möjlig delförklaring till dessa varierande fynd kan vara att man i regel inte tagit hänsyn till S100B:s dynamiska egenskaper som skademarkör vid lätt skallskada (snabb ökning i blodet med maximal koncentration 1–2 timmar efter trauma, därefter snabb minskning med »klinisk« halveringstid på några timmar).
Både positiva och negativa fynd med avseende på S100B:s roll som prediktor har rapporterats, och det är inte möjligt att dra en slutsats om huruvida S100B kommer att kunna spela en roll i den vardagliga kliniska handläggningen av patienter med lätt skallskada/MTBI vad beträffar långtidsprognostisering. Behovet av tidig prognostisering av patienter som löper stor risk att få symtom och funktions- och aktivitetsnedsättningar lång tid efter skadan kvarstår. En framgångsrik och effektiv prognostiseringsmetod skulle göra det möjligt att rikta uppföljnings- och rehabiliteringsinsatserna mot de patienter som är i störst behov av sådana åtgärder.
Nya prospektiva studier behövs i vilka man adekvat beaktar S100B:s marköregenskaper (tar hänsyn till tiden mellan trauma och provtagning för analys av S100B och beaktar/korrigerar för S100B från källor utanför CNS). Resultaten behöver sedan valideras i ytterligare studier, innan man kan ta definitiv ställning till om S100B är praktiskt användbart som prediktionsinstrument av långtidssequalae efter lätt skallskada.
Mycket talar för att genesen till de besvär som förekommer lång tid efter lätt skallskada är multifaktoriell, varför S100B:s roll som prediktor också borde studeras samtidigt med andra potentiella prediktionsfaktorer.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.