Sammanfattat
Svenska infektionsläkarföreningens programgrupp för pneumoni har utarbetat evidensbaserade riktlinjer för handläggning av immunkompetenta vuxna patienter med samhällsförvärvad pneumoni, som bedöms på sjukhus.
Riktlinjerna rekommenderar användning av ett prognostiskt index, CRB-65, för alla pneumonipatienter. Detta index kan hjälpa klinikern i valen av vårdnivå, mikrobiologisk diagnostik och antibiotikabehandling.
Patienter med icke-allvarlig pneumoni (CRB-65-poäng 0–1) kan i många fall behandlas polikliniskt, och här rekommenderas som förstahandsval penicillin V. För patienter med CRB-65-poäng 2 rekommenderas sjukhusvård och som behandling i första hand bensylpenicillin.
Vid allvarlig pneumoni (CRB-65-poäng 3–4) bör intensivvård övervägas, och här rekommenderas intravenös antibiotikabehandling med bensylpenicillin+kinolon alternativt cefalosporin+makrolid.
Man bör eftersträva etiologisk diagnos för att få stöd för initial behandling eller för antibiotikabyte.
Som prevention rekommenderas influensa- och pneumokockvaccination av riskgrupper samt rökavvänjning.
Samhällsförvärvad pneumoni är en vanlig diagnos med varierande svårighetsgrad från lindrig till livshotande sjukdom [1]. Hos de svårast sjuka patienterna har valet av vårdnivå och antibiotikabehandling betydelse för utgången. Valet av antibiotika har även betydelse för biverkningsrisken och den totala sjukvårdskostnaden, och sannolikt också för bakteriernas utveckling av resistens mot antibiotika.
Riktlinjer för handläggning av pneumonipatienter har utarbetats i Nordamerika [2] och i Europa [3], men rekommendationerna varierar mycket. Variationerna kan sannolikt delvis förklaras av olika epidemiologi avseende etiologiskt spektrum och antibiotikaresistens, olika tolkning av studieresultat samt också olika traditioner.
På uppdrag av Svenska infektionsläkarföreningen har en programgrupp för pneumoni utformats, med primärt syfte att utarbeta evidensbaserade riktlinjer för handläggning av patienter med samhällsförvärvad pneumoni. De första riktlinjerna utkom 2004 och publicerades internationellt 2005 [4]. Riktlinjerna har nyligen reviderats (2007) och publicerats på Infektionsläkarföreningens webbplats http://www.infektion.net . För att nå större spridning i läkarkåren publiceras nu dessa riktlinjer i förkortad och något omarbetad form. Bakgrundsinformation och referenslista finns i det webbaserade dokumentet.
Sökning
I arbetet med att ta fram riktlinjerna har sökningar gjorts på Medline för tiden januari 1966 till mars 2007 med följande sök-ord: »´pneumonia or empyema or lung abscess or pulmonary infection or chest infection or respiratory tract infection´ not ´child or children or childhood or infant or paediatric or tuberculosis or in vitro or cystic fibrosis or human immunodeficiency virus or acquired immunodeficiency syndrome or review´«.
Bland över 11000 träffar har drygt 700 artiklar tagits fram och diskuterats. Dessa artiklar har tillsammans med ett hundratal andra artiklar legat till grund för riktlinjerna.
Avgränsning
Dessa riktlinjer gäller handläggning av vuxna, icke-immunsupprimerade patienter med samhällsförvärvad lunginflammation, som bedöms på sjukhus. För handläggning av patienter med samhällsförvärvad pneumoni i primärvården hänvisas till Läkemedelsverkets behandlingsrekommendationer för farmakoterapi vid nedre luftvägsinfektioner, vilka publicerats under våren 2008, se http://www.lakemedelsverket.se.
Definition av pneumoni
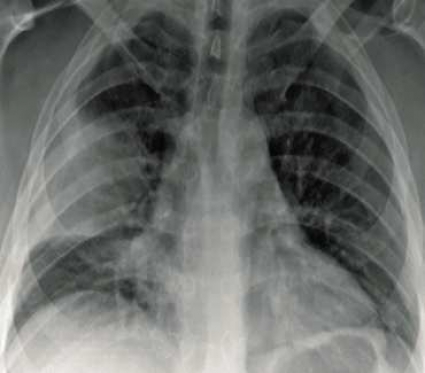
Definitionen av pneumoni är symtom/statusfynd förenliga med akut nedre luftvägsinfektion i kombination med lungröntgenförändringar talande för denna sjukdom. Vanliga symtom är feber, hosta, dyspné, nytillkommen uttalad trötthet och andningskorrelerad bröstsmärta. I Figur 1 presenteras ett patientfall.
Evidensgradering
Evidensgradering och styrka av rekommendationer är i överensstämmelse med British Thoracic Society (Tabell I) [3].
Incidens och mortalitet
Den årliga incidensen av samhällsförvärvad pneumoni i industriländer är omkring 1 procent, med tydligt ökande incidens hos äldre individer [5]. Bland dem som insjuknar i pneumoni sjukhusvårdas omkring 20–40 procent av fallen [5] (evidensgrad Ib).
Mortaliteten hos patienter med samhällsförvärvad pneumoni som vårdas på infektionsklinik i Sverige är 3,5–6 procent [4, 6]. Mortaliteten inom 3 månader var 12 procent i en studie [7] (evidensgrad Ib). Patienter som sjukhusvårdats för pneumoni har också på längre sikt (år) högre mortalitet än åldersmatchade personer (evidensgrad Ib).
Etiologi
Samhällsförvärvad pneumoni kan orsakas av ett stort antal mikroorganismer. Bland sjukhusvårdade patienter i Sverige är dock Streptococcus pneumoniae (pneumokocker) helt dominerande följt av Haemophilus influenzae, Mycoplasma pneumoniae (mykoplasma) och olika luftvägsvirus (framför allt influensa) [4] (evidensgrad Ib). Frekvensen av mykoplasmainfektioner har visat sig variera mycket från år till år (evidensgrad II). Fynd av flera etiologiska agens förekommer i varierande frekvens, men den kliniska betydelsen av detta är oklar.
Pneumokocker och H influenzae är vanliga etiologier i alla åldersgrupper [3] (evidensgrad Ia), medan mykoplasma drabbar framför allt patienter under 50 års ålder (evidensgrad Ib).
I svenska studier av sjukhusvårdade pneumonipatienter är Chlamydophila spp, Legionella spp, gramnegativa tarmbakterier och Staphylococcus aureus relativt ovanliga agens (evidensgrad Ib). Utbrott av Chlamydophila pneumoniae och Legionella spp har dock beskrivits (evidensgrad Ib). Legionella spp, gramnegativa tarmbakterier och S aureus är vanligare bland svårt sjuka pneumonipatienter som kräver intensivvård, även om pneumokocker och i mindre utsträckning H influenzae dominerar som etiologier också bland dessa patienter (evidensgrad II). H influenzae är särskilt vanlig som etiologi hos pneumonipatienter med kronisk bronkit eller kroniskt obstruktiv lungsjukdom (KOL).
Epidemiologiska uppgifter som utlandsvistelse (legionella), fågelkontakt (Chlamydophila psittaci) och kontakt med personer med luftvägssymtom i omgivningen (mykoplasma, influensa) kan ha ett diagnostiskt värde (evidensgrad IVa).
Klinisk och radiologisk bild
Etiologiskt agens vid samhällsförvärvad pneumoni kan hos den enskilde patienten inte med säkerhet förutsägas med hjälp av den kliniska och röntgenologiska bilden (evidensgrad II). Äldre patienter (>75 år) har dessutom ofta mer ospecifika symtom och kan sakna feber (evidensgrad II).
Vissa kliniska fynd såsom akut sjukdomsdebut, hållsmärta och LPK >15×109/l kan tala för pneumokocketiologi. Lunginflammation orsakad av sk atypiska bakterier (mykoplasma, Chlamydophila spp och legionella) har ingen helt gemensam klinisk bild. Låg ålder, långsamt injuknande, torrhosta, LPK <10x109/l och interstitiella lungröntgeninfiltrat kan tala för mykoplasma, medan CNS-påverkan, leverpåverkan, hyponatremi och relativ bradykardi ger stöd för Legionella spp. Ett uteblivet behandlingssvar på betalaktamantibiotika kan tala för någon av dessa patogener som pneumoniorsak (evidensgrad II).
Den röntgenologiska förbättringen inträder som regel efter den kliniska. Detta gäller speciellt infektioner orsakade av pneumokocker och legionella (evidensgrad II). Normalisering av röntgenbilden tar längre tid hos äldre patienter och hos patienter där flera lunglober är involverade (evidensgrad Ib).
Handläggning
Den akuta handläggningen vid pneumoni består i allvarlighetsbedömning (Figur 2), mikrobiologisk diagnostik (Fakta 1), initiering av antibiotikabehandling (Fakta 2) och planering av uppföljning om patienten behandlas i hemmet.
Allmänna undersökningar. Hos alla patienter med misstänkt pneumoni rekommenderas (rekommendationsstyrka C)
• lungröntgen
• pulsoximetri
• blodprov: Hb, LPK, trombocyter, CRP, SR, kreatinin/urea, albumin, Na, K och ALAT.
Artärblodgaser. Mätning av artärblodgaser bör övervägas hos pneumonipatienter med allvarlig sjukdom (se nästa stycke) eller sänkt medvetande, hos rökare (framför allt om syrgasbehandling inletts), vid misstanke om kronisk bronkit/KOL samt vid SaO2 <92 procent.
Bedömning av sjukdomens svårighetsgrad
Bedömning av sjukdomens svårighetsgrad är avgörande för val av vårdnivå (hemmet, vårdavdelning eller intensivvårdsavdelning) och behandling.
Flera prognostiska faktorer har visat sig vara kopplade till ökad mortalitet hos pneumonipatienter, men ingen enskild faktor kan användas för att prediktera död [3]. Genom att kombinera olika riskfaktorer har flera prognostiska modeller utarbetats. Bruk av dessa modeller har visat sig minska antalet inläggningar och minska sjukvårdskostnader. Flera av dessa modeller är komplicerade att använda i kliniskt bruk. Vi rekommenderar CRB-65 [8], ett rent kliniskt index, som använder sig av 4 olika prognostiska markörer. Figur 2 beskriver detta index och hur vi rekommenderar att det bör användas för att stödja beslut om vårdnivå vid samhällsförvärvad pneumoni. CRB-65 bör ses som ett hjälpmedel men ersätter inte den kliniska bedömningen.
Mikrobiologiska undersökningar
Mikrobiologisk diagnostik är viktig för en riktad antibiotikabehandling [9] och möjliggör epidemiologisk övervakning (evidensgrad IVa). För patienter med allvarlig pneumoni ska utförlig etiologisk diagnostik utföras, medan valet av undersökningar vid icke-allvarlig pneumoni bör styras av klinisk bild (ålder, bakomliggande sjukdomar och prognostiska markörer), epidemiologiska riskfaktorer och tidigare antibiotikabehandling (rekommendationsstyrka C). Rekommenderade rutinundersökningar visas i Fakta 1.
Odlingar. Utöver blododlingar (rekommendationsstyrka B–) är sputumprov för allmän odling och resistensbestämning önskvärt hos alla patienter som förmår hosta upp (rekommendationsstyrka B+). Genom inhalation av 3-procentig koksaltlösning kan fler sputumprov erhållas (inducerat sputum) (evidensgrad II). Sputumproven ska utodlas kvantitativt och bedömas mikroskopiskt avseende representativitet (rekommendationsstyrka B+).
Odling från nasofarynxsekret (aspirat eller pinnprov) bör utföras hos alla patienter som inte lyckas hosta upp ett purulent sputumprov (rekommendationsstyrka C). Fynd av pneumokocker men även H influenzae kan vara vägledande (evidensgrad Ib).
Pneumokockantigen i urin. Snabbtest (Binax NOW) för påvisande av pneumokockantigen i urin ökar det diagnostiska utbytet vid pneumokockinfektion (evidensgrad Ib). I en svensk pneumonistudie var sensitiviteten 79 procent jämfört med blododling och 54 procent jämfört med blod- och luftvägsodling [9]. Ett negativt resultat utesluter alltså inte pneumokocketiologi. En patient kan vara testpositiv flera veckor efter en pneumokockinfektion och därför möjligen bli falskt positiv vid en senare pneumoni. Testet är användbart också vid pågående antibiotikabehandling (rekommendationsstyrka B+).
Diagnostik av mykoplasma och chlamydophila. PCR-metoder för mykoplasma är numera väl etablerade och har till stor del ersatt serologi i den akuta diagnostiken (evidensgrad Ib). PCR för C pneumoniae finns nu också tillgänglig på åtskilliga svenska laboratorier.
Legionelladiagnostik. Test för påvisande av legionellaantigen i urin har hög specificitet för infektion av Legionella pneumophila serogrupp 1 (evidensgrad Ia). Sensitiviteten av testet varierar dock med infektionens allvarlighetsgrad. I en nyligen publicerad studie av patienter med pneumoni orsakad av L pneumophila serogrupp 1 var sensitiviteten 38 procent bland de lindrigast sjuka och 86 procent bland de svårast sjuka patienterna [10]. PCR för legionella på nedre luftvägssekret har visat sig öka det diagnostiska utbytet jämfört med legionellaodling (evidensgrad Ib).
Diagnostik av luftvägsvirus. Antigendetektion med immunfluorescens på nasofarynxaspirat har länge varit rutinmetod för påvisande av influensavirus och RS-virus (evidensgrad Ib). På senare tid har dock PCR-metoder tagit över diagnostiken alltmer, eftersom dessa metoder visat sig fungera väl för påvisande av luftvägsvirus och eftersom PCR är en mindre arbetskrävande teknik än immunfluorescens. Ett antal kommersiella snabbtest för influensavirus med hög specificitet men varierande sensitivitet har också blivit tillgängliga. Användning av snabbtest har visat sig kunna minska antibiotikaanvändningen hos patienter som sjukhusvårdas för influensa (evidensgrad Ib).
Diagnostik via bronkoskopi. Bronkoskopi bör övervägas hos kritiskt sjuka patienter (CRB-65-poäng 3–4) och hos patienter som inte svarar på given antibiotikabehandling (rekommendationsstyrka B+). Provtagning med skyddad borste eller bronkoalveolärt lavage bör utföras och analyseras med diagnostiska metoder för såväl vanliga bakterier som Mycobacterium tuberculosis och Pneumocystis jiroveci.
Diagnostik avseende M tuberculosis på nedre luftvägssekret bör också övervägas vid långvarig hosta och hos patienter med epidemiologi eller lungröntgenförändringar som inger misstanke om tuberkulos.
Smittsamhet
Mykoplasma, influensavirus, RS-virus, adenovirus och M tuberculosis kan spridas med aerosol (evidensgrad Ia). Vid misstänkt eller verifierad infektion med något av dessa agens bör patienten inte dela rum med någon annan patient om sjukhusvård erfordras (rekommendationsstyrka A–).
Antibiotikaresistens
I ett europeiskt perspektiv har Sverige en låg frekvens av pneumokocker med nedsatt känslighet för penicillin. Det rapporterade antalet fall av sådana isolat har varit stabilt i Sverige under de senaste åren. Andelen fall med nedsatt penicillinkänslighet bland invasiva pneumokockisolat har också legat relativt stabilt mellan 2 och 4 procent [11] (evidensgrad Ib).
Bland konsekutiva kliniska pneumokockisolat, i huvudsak från nasofarynxodling, har man dock noterat en successiv ökning av andelen isolat med nedsatt känslighet för penicillin, från 4 procent 1997 till 7 procent 2006 [11] (evidensgrad Ib). Under samma tidsperiod har man även noterat en ökning av andelen pneumokockisolat med resistens mot erytromycin (2 procent till 7 procent), tetracyklin (3 procent till 7 procent) och trimetoprim–sulfametoxazol (4 procent till 9 procent) [11] (evidensgrad Ib).
Azitromycin (evidensgrad Ib) och perorala cefalosporiner (evidensgrad II) har visat sig vara särskilt benägna att driva fram resistens hos pneumokocker.
På senare år har man även uppmärksammat negativa effekter av antibiotika avsedda för pneumonibehandling på bakteriepopulationer utanför luftvägarna. Bruk av kinoloner och parenterala cefalosporiner har kopplats till infektioner med Clostridium difficile (evidensgrad Ib) och extended-spectrum betalactamases(ESBL)-producerande gramnegativa bakterier [12] (evidensgrad Ib). Kinolonbruk har även kopplats till infektioner med meticillinresistenta Staphylococcus aureus (MRSA) [12] (evidensgrad Ib).
Eftersom vi i Sverige har ökande problem med både MRSA och ESBL, rekommenderar programgruppen att cefalosporiner och kinoloner i första hand ska reserveras för patienter med allvarlig pneumoni och patienter där behandlingseffekt inte uppnåtts med initial empirisk behandling (rekommendationsstyrka A–; se rekommendationer nedan).
Antibiotikabehandling
Då pneumokocker är den vanligaste etiologin till pneumoni och den mest frekvent identifierade etiologin vid pneumoni med dödlig utgång [1], måste all behandling ha god effekt mot denna bakterie (rekommendationsstyrka A+). De nordamerikanska pneumoniriktlinjerna [2] rekommenderar rutinmässig antibiotikatäckning av även atypiska patogener hos sjukhusvårdade patienter. Risken för legionella som etiologi vid icke-allvarlig pneumoni i Sverige är dock liten, och enligt vår kliniska erfarenhet är det heller inte nödvändigt att rutinmässigt täcka för mykoplasma och Chlamydophila spp (evidensgrad III). Två metaanalyser bekräftade också nyligen att antibiotikabehandling med täckning även för atypiska patogener inte är bättre än enbart (beta)-laktambehandling för att åstadkomma läkning vid icke-allvarlig pneumoni och vid pneumoni som kräver sjukhusvård [13] (evidensgrad Ia).
Sjukhusvårdade patienter med icke-allvarlig pneumoni och normal tarmabsorption kan behandlas med antibiotika peroralt (rekommendationsstyrka B+).
I Sverige har vi god erfarenhet av behandling med penicillin V vid icke-allvarlig pneumoni [6] (evidensgrad II). Argumenten för denna tradition har varit ekologiska (evidensgrad IVb), biverkningsmässiga (evidensgrad III) och ett alltjämt gynnsamt resistensläge hos pneumokocker [11] (evidensgrad Ib).
Den högre absorptionen, längre halveringstiden och lägre proteinbindningen av amoxicillin i kombination med en bättre effekt på (beta)-laktamasnegativa H influenzae gör att amoxicillin ofta rekommenderas som förstahandsbehandling vid pneumoni internationellt [3]. Högdos amoxicillin (1g x 3) har visat sig vara effektiv även mot pneumokocker med nedsatt känslighet för penicillin (evidensgrad II).
Empirisk antibiotikabehandling. I Fakta 2 redovisas den rekommenderade empiriska antibiotikabehandlingen för pneumoni relaterad till svårighetsgrad och misstanke om etiologiskt agens. Hos patienter med CRB-65-poäng 0–2 riktas behandlingen i första hand mot pneumokocker om klinik, epidemiologi, laboratoriedata och röntgenfynd inte inger misstanke om något annat specifikt agens.
Hos äldre sjukhusvårdade pneumonipatienter har antibiotika givna inom 4 timmar efter ankomst till sjukhuset visat sig förbättra prognosen (evidensgrad Ib).
Övergång från parenteral till peroral antibiotika. Patienter som erhållit parenteral behandling initialt bör ställas över på peroral regim så snart som en klinisk förbättring inträtt och patienten är feberfri (<38 °C) [14] (B+).Antibiotikabehandling vid känd etiologi. Så snart en etiologi har identifierats [9] ska riktad behandling ges (rekommendationsstyrka C). Vid verifierad legionellainfektion rekommenderas behandling med kinolon (levofloxacin 750 mg x 1 eller 500 mg x 2 eller moxifloxacin 400 mg x 1), alternativt azitromycin 500 mg x 1 (rekommendationsstyrka B+). Observera dock att moxifloxacin är kontraindicerat vid leverpåverkan med transaminasstegring till >5 gånger övre normalvärdet, http://www.fass.se .
Behandlingstid. För patienter med icke-allvarlig pneumoni (CRB-65-poäng 0–1) rekommenderas 7 dagars behandling (rekommendationsstyrka B+). Även för patienter med allvarlig pneumoni (CRB-65-poäng 2–4) utan känd etiologi och med okomplicerat förlopp räcker sannolikt 7 dagars behandling (evidensgrad II). Patienter med verifierad legionellainfektion bör behandlas i 10 dagar (rekommendationsstyrka B–). Vid långsamt terapisvar eller komplikation med smältning eller empyemutveckling ska behandlingstiden förlängas (rekommendationsstyrka C).
Övrig handläggning
Kroppstemperatur, andningsfrekvens, syrgasmättnad, hjärtfrekvens, blodtryck och mentalt status (vakenhet, förvirring) ska initialt följas minst två gånger per dygn (rekommendationsstyrka C). Vid allvarlig pneumoni (CRB-65-poäng 2–4) ska registrering av andningsfrekvens, syrgasmättnad, hjärtfrekvens och blodtryck göras betydligt mer frekvent, initialt ofta 1–2 gånger per timme (rekommendationsstyrka C). Om patienten har sjunkande blodtryck trots parenteral vätsketillförsel eller en andningsfrekvens >30 per minut trots syrgasbehandling bör intensivvård övervägas (rekommendationsstyrka C).
Ställningstagande till begränsningar av vårdnivå bör dock alltid göras hos äldre multisjuka personer eller hos personer med svåra bakomliggande sjukdomar (rekommendationsstyrka C).
Alla patienter med pneumoni ska vid behov ges syrgasbehandling med målsättningen att upprätthålla SaO2 ≥92 procent (PaO2 8 kPa) (rekommendationsstyrka C). Syrgasbehandling av patienter med KOL ska följas med upprepade blodgasanalyser (rekommendationsstyrka C).
Dokumentation för behandling med CPAP (continuous positive airway pressure) vid pneumoni saknas. Vid koldioxidretention kan CPAP ofta förvärra situationen. CPAP-behandling kan dock ibland vara av värde för sekretmobilisering. För non-invasiv ventilation med ansiktsmask, tex bilevel PAP (positive airway pressure), är effekten väl dokumenterad hos KOL-patienter med akut respiratorisk acidos i samband med exacerbationer (evidensgrad Ia). För pneumonipatienter utan KOL finns positiva erfarenheter med bilevel PAP-behandling, men dokumentation för sådan behandling saknas för närvarande.
Flaskblåsning och tidig mobilisering har visat sig vara gynnsamma vid pneumoni (evidensgrad II).
Handläggning vid utebliven förbättring
För patienter som inte förbättras inom 48 till 72 timmar från behandlingsstart bör en noggrann genomgång göras av sjukhistoria, klinik och laboratorieresultat [15] (rekommendationsstyrka B+).
Orsaker till utebliven förbättring av empirisk antibiotikabehandling (evidensgrad Ib):
• Felaktig diagnos, exempelvis lungembolism, lungödem, sy-stemisk vaskulit, malignitet.
• Lungkomplikationer, såsom pleuravätska, empyem, lungabscess och ARDS (akut svår andningsinsufficiens).
• Extrapulmonella komplikationer, tex metastatisk infektion/ endokardit, ny nosokomial infektion, tromboflebit av antibiotika och tromboembolism sekundärt till immobilisering.
• Pneumoniagens som inte täcks av given antibiotikabehandling, tex atypisk bakterie, P jiroveci, M tuberculosis, resistent patogen, dubbelinfektion.
• Långsamt behandlingssvar.
• Läkemedelsreaktion.
• Dålig peroral antibiotikaabsorption.
Utredning som bör övervägas vid utebliven förbättring (rekommendationsstyrka C):
• Provtagning: Hb, LPK med differentialräkning, CRP, SR, kreatinin/urea, Na, K, Ca, albumin, ALAT, ASAT, bilirubin, ALP, LD, CK, D-dimer.
• Mikrobiologisk diagnostik: Se Fakta 1 under behandlingssvikt.
• Radiologi: ny lungröntgen, DT-torax.
• Bronkoskopi.
Byte av antibiotika vid pneumoni med okänd etiologi och terapisvikt:
• Initial behandling med penicillin V (CRB-65-poäng 0–1). Byte till amoxicillin (vid misstanke om H influenzae 500 mg(gånger)3 eller pneumokocker med nedsatt penicillinkänslighet 1 g(gånger)3) alternativt bensylpenicillin 1–3 g(gånger)3 (rekommendationsstyrka C).
Byte till en peroral makrolid eller doxycyklin vid misstanke om atypiskt agens (rekommendationsstyrka C).
• Initial behandling med makrolid eller doxycyklin (CRB-65-poäng 0–1).
Byte till bensylpenicillin 1–3 g(gånger)3 eller amoxicillin 0,5–1 g(gånger)3 (rekommendationsstyrka C).
• Initial behandling med bensylpenicillin (CRB-65-poäng 0–1). Byte till makrolid eller doxycyklin (rekommendationsstyrka C).
• Initial behandling med bensylpenicillin (CRB-65-poäng 2–4). Tillägg av kinolon, alternativt byte till parenteral cefalosporin + parenteral makrolid (rekommendationsstyrka C).
• Initial behandling med parenteral cefalosporin (CRB-65-poäng 2–4)
Tillägg av parenteral makrolid eller kinolon (rekommendationsstyrka C).
Utskrivning
Sjukhusvårdade patienter kan som regel skrivas ut när förbättring inträtt och patienten varit kliniskt stabil i 1 dygn [14] (rekommendationsstyrka B+). I samband med utskrivning ska patienterna informeras om sjukdomen (rekommendationsstyrka C). Eftersom rökning är en riskfaktor för att insjukna i pneumoni och för att utveckla invasiv pneumokocksjukdom, bör vikten av att sluta röka understrykas.
Uppföljning
Patienter som behandlats för pneumoni bör som regel erbjudas uppföljning. Denna uppföljning kan utgöras av ett återbesök på aktuell klinik eller hos distriktsläkare efter 6–8 veckor. För patienter med okomplicerat förlopp kan denna kontroll utgöras av ett telefonsamtal [16] (rekommendationsstyrka B–). Lungröntgen ska inkluderas i kontrollen för patienter som har haft ett komplicerat förlopp eller som har kvarvarande symtom. Lungröntgen är också motiverad vid recidiverande pneumoni, immunsuppression och för patienter med ökad risk för underliggande malignitet, framför allt rökare (rekommendationsstyrka C). Patienter med kvarvarande symtom och/eller lungröntgenförändringar bör utredas med DT-torax och eventuellt bronkoskopi [17] för diagnostik av lungembolism, systemisk vaskulit, malignitet, empyem och tuberkulos (rekommendationsstyrka C).
Prevention
Eftersom pneumoni är associerad med morbiditet och mortalitet [1], bör åtgärder vidtas för att förebygga sjukdomen. Dessa åtgärder bör omfatta ansträngningar för rökavvänjning, influensa- och pneumokockvaccination.
Influensavaccination. Influensavaccination av vuxna med inaktiverat influensavirus ger cirka 70-procentigt skydd [18] (evidensgrad Ia). Hos äldre personer är skyddet sämre, cirka 50 procent (evidensgrad Ib), men vaccinationen minskar också risken för komplikationer såsom pneumoni (evidensgrad II) och död, oavsett orsak, under influensasäsong (evidensgrad II). Årlig influensavaccination rekommenderas därför till alla personer som har ökad risk för att utveckla allvarlig influensa (rekommendationsstyrka A+). De patientgrupper som omfattas är de som är ≥65 år gamla och/eller har någon av följande underliggande riskfaktorer: sjukhemsboende, kronisk hjärtsjukdom, framför allt hjärtsvikt, kronisk lungsjukdom, instabil diabetes mellitus, kronisk njursvikt eller cancersjukdom.
Det inaktiverade influensavaccinet är både immunogent och ofarligt; upprepade vaccinationer leder inte till fler biverkningar eller försämrat antikroppssvar (evidensgrad II). Vaccination av hälso- och sjukvårdspersonal har visats minska dödligheten hos patienter inom geriatrik och sjukhemsvård (evidensgrad Ib). Eftersom äldre och nedsatta patienter återfinns inom alla vårdformer rekommenderas årlig vaccination av all hälso- och sjukvårdspersonal för att minska risken för vårdrelaterad influensasmitta till patienterna (rekommendationsstyrka B+).
Pneumokockvaccination. Det 23-valenta pneumokockpolysackaridvaccinet (PPV23) ger ett cirka 50–60-procentigt skydd mot invasiv pneumokocksjukdom hos vuxna (evidensgrad Ia) och äldre individer (evidensgrad Ib) [19, 20]. I randomiserade studier och i metaanalyser av sådana studier [19] har inte någon skyddseffekt mot pneumoni eller pneumokockpneumoni hos äldre personer kunnat påvisas. Några nyare observationella studier har dock indikerat en viss skyddseffekt mot pneumoni (evidensgrad III).
De få studier som finns indikerar att PPV23 har dålig skyddseffekt hos immunsupprimerade, med undantag av splenektomerade patienter.
Pneumokockvaccination ska erbjudas till immunkompetenta personer med ökad risk för pneumokocksjukdom samt till personer med aspleni (rekommendationsstyrka A–). De huvudsakliga riskfaktorerna för pneumokockpneumoni hos immunkompetenta personer är ålder ≥65 år, sjukhemsvård, aspirationstendens, hjärtsvikt, kronisk lungsjukdom, kronisk leversjukdom och instabil diabetes mellitus. Patienter som genomgått en invasiv pneumokockinfektion rekommenderas också vaccination (rekommendationsstyrka C), vilken lämpligen ges i samband med ett återbesök efter cirka 2 månader [20]. Även om bevis saknas kan det inte uteslutas att vaccinet ger ett visst skydd även hos immunsupprimerade patienter, varför vaccination ofta rekommenderas även till dessa grupper [2] (rekommendationsstyrka C).
Efter pneumokockvaccination sjunker antikroppshalten successivt och når basnivån efter cirka 5–10 år. Revaccination ger då en signifikant stegring av antikroppshalten även hos äldre personer (evidensgrad Ib). Skyddseffekten av revaccination är dock dåligt studerad. Risken för signifikanta lokala biverkningar är något större än vid primärvaccination (evidensgrad Ib). Sammantaget kan därmed en revaccination >5 år efter primärvaccinationen rekommenderas till personer med aspleni och övervägas till övriga patientgrupper med indikation för pneumokockvaccination (rekommendationsstyrka B+).
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.