Makuladegeneration är den vanligaste synhotande sjukdomen i västvärlden.
Sjukdomen har en våt (neovaskulär) och en torr (degenerativ) form.
Den våta formen kan kontrolleras med biologiska läkemedel, medan den torra formen saknar behandling.
Nya generationer biologiska läkemedel samt genterapi och stamcellsbaserade behandlingar är under utveckling.
Makuladegeneration, den vanligaste synhotande sjukdomen i västvärlden, var länge en av många ålderssjukdomar utan behandling. De senaste 20 årens framsteg har gjort att makuladegeneration nu är en behandlingsbar sjukdom som engagerar inte bara ögonsjukvården utan även forskning och läkemedelsutveckling i den biomedicinska frontlinjen.
Utvecklingen är en konsekvens av flera faktorer. Upptäckten att vaskulär endoteltillväxtfaktor (VEGF; vascular endothelial growth factor) har en central roll vid den aggressiva våta formen av makuladegeneration identifierade en måltavla för terapi [1, 2]. Läkemedel mot VEGF, ursprungligen utvecklade mot maligna tumörer, testades därför på patienter med våt makuladegeneration.
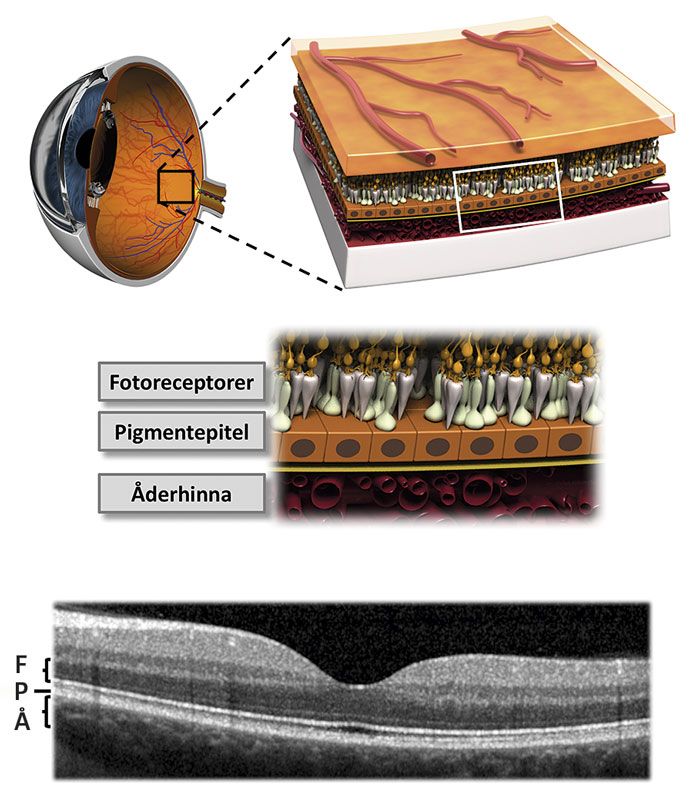
Resultaten från flera randomiserade studier var mycket goda: över 90 procent av patienterna fick stabiliserad eller förbättrad synskärpa efter behandling med antikroppen ranibizumab [3, 4]. Det innebar också ett nytt genombrott för terapigruppen biologiska läkemedel, där främst antikroppar ingår, och flera läkemedelsföretag började utveckla läkemedel mot makuladegeneration. Framgångarna hade sannolikt uteblivit om det inte samtidigt gjordes viktiga framsteg inom området bilddiagnostik. Att ögat och näthinnan är förhållandevis lätta att studera och tillgängliga för kirurgisk intervention har också haft stor betydelse (Figur 1).
Tillsammans har detta gjort näthinnans sjukdomar, och främst makuladegeneration, till ett förstahandsval vid utveckling av flera nya biomedicinska terapier.
I denna översikt beskrivs den pågående utvecklingen av nästa generations biologiska läkemedel, men också hur genterapi och stamceller kan förändra dagens behandling.
Klinisk presentation
Makuladegeneration drabbar näthinnans gula fläck (makula) och har vanligen ett mycket långsamt förlopp. Vid sjukdomens tidiga stadier saknas ofta symtom, medan avancerad makuladegeneration orsakar bildförvrängning (metamorfopsi), nedsatt central synskärpa och skotom.
Prevalensen för svår synnedsättning uppskattas i Sverige till 100 000 med en årlig incidens på 5 000 individer fördelad 2:1 mellan sjukdomens slutstadier våt makuladegeneration och geografisk atrofi.
Diagnostik
En enkel ögonbottenundersökning är i allmänhet tillräcklig för att ställa diagnosen makuladegeneration. Utöver detta finns flera metoder för klinisk och terapeutisk uppföljning, t ex angiografi, autofluorescens och optisk koherenstomografi. I synnerhet optisk koherenstomografi, en icke-invasiv metod för högupplöst sagittal avbildning av näthinnans olika lager, har inneburit ett genombrott som möjliggjort att effekten av insatt behandling kan följas i detalj (Figur 1).
Patofysiologi
Makuladegeneration beror på en långsamt sviktande funktion i näthinnans pigmentepitel orsakad av livslång ackumulation av toxiska metaboliter. Pigmentepitelet är nödvändigt för normal funktion hos ovanliggande fotoreceptorer liksom underliggande åderhinna; ett sviktande pigmentepitel orsakar därför kollateral skada på dessa strukturer.
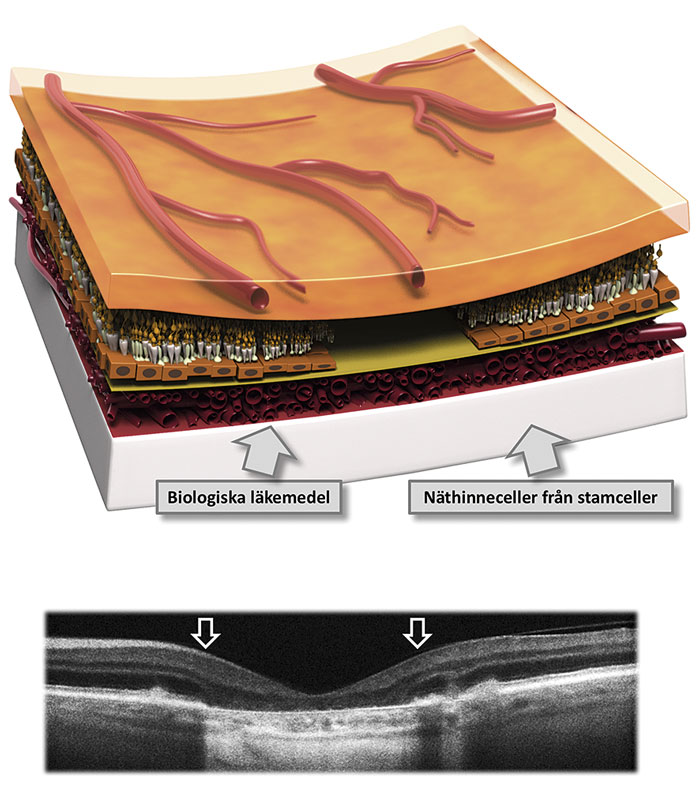
Om mängden toxiska metaboliter blir för stor, kommer först pigmentepitelet och därefter fotoreceptorerna i makula att degenerera (torr makuladegeneration) och så småningom dö (geografisk atrofi) (Figur 2). En annan konsekvens är nedsatt blod–retinabarriärfunktion, vilken kan leda till inväxt av kärl från åderhinnan, våt makuladegeneration. Blodkärlen som då bildas under makula orsakar kärlläckage med ödem och synnedsättning som följd (Figur 3).
Nuvarande behandling
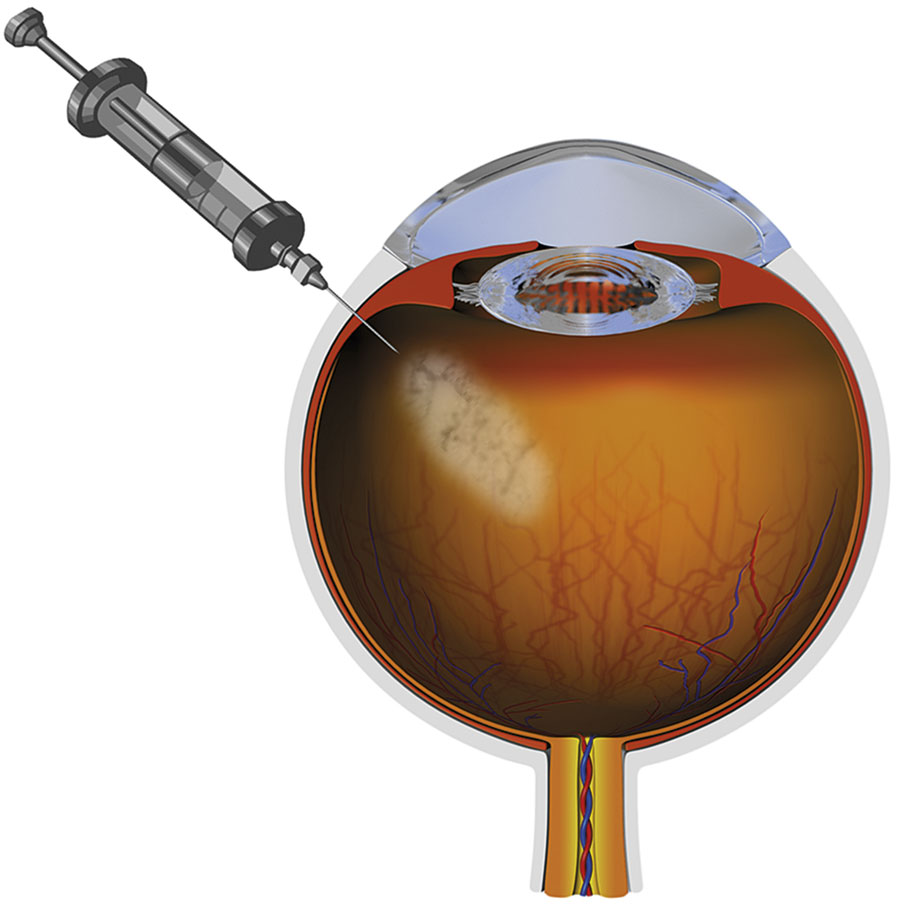
Våt makuladegeneration kan bromsas med intravitreala anti-VEGF-injektioner (injektioner i glaskroppen) (Figur 4) [3, 4]. Läkemedlet har i allmänhet mycket god effekt på ödemet i makula, medan effekten på de nybildade kärlen är begränsad.
Som en konsekvens måste behandlingen upprepas (i snitt 7 injektioner per år) för att positiv effekt ska kunna upprätthållas. Detta leder i sin tur till omfattande logistik, risk för injektionsrelaterade biverkningar och höga kostnader. Under 2016 kommer uppskattningsvis 50 000 injektioner att göras i Sverige. I motsats till våt makuladegeneration saknar geografisk atrofi i dag behandling.
Behandlingar under utveckling
Biologiska läkemedel. Som nämnts ovan kan den våta formen av makuladegeneration i dag behandlas med anti-VEGF-injektioner (Figur 4). Sin goda effekt till trots har den första generationens anti-VEGF-preparat, ranibizumab, relativt kort halveringstid. Fokus inriktas nu mot att ta fram läkemedel mot VEGF med längre behandlingseffekt för att minska antalet injektioner.
Nyligen har andra generationens anti-VEGF-preparat lanserats: aflibercept, en syntetisk molekyl med liknande egenskaper som ranibizumab men med något längre effekt [5]. Ett attraktivt alternativ är depåer som långsamt utsöndrar anti-VEGF, och flera företag arbetar med att utveckla denna typ av depåläkemedel.
Anti-VEGF förhindrar mycket effektivt läckage och ödem men har begränsad effekt på själva kärlet. Detta förklarar i sin tur den övergående behandlingseffekten.
Ett sätt att angripa problemet är således att förlänga halverings- eller utsöndringstiden. Ytterligare en möjlighet är att tillbakabilda själva blodkärlet. När nya blodkärl bildas genom s k angiogenes är de först »nakna« och saknar stödjeceller i form av främst pericyter. Processen är helt beroende av VEGF, och kärlen är därför i detta tidiga skede känsliga för anti-VEGF. Så snart kärlen mognat och omslutits av pericyter blir de också resistenta mot anti-VEGF.
I experimentella studier har man visat att en annan tillväxtfaktor, PDGF (platelet-derived growth factor), är viktig för pericyternas funktion. Biologiska läkemedel mot PDGF, som E10030 (Fovista), har utvecklats, och tanken är att kombinera dem med anti-VEGF. Förhoppningen är att uppnå synergi: både ödem och blodkärl angrips, med förlängd eller till och med permanent behandlingseffekt som följd. Lovande resultat från en fas 1-studie med E10030 har publicerats [6], och en uppföljande randomiserad fas 3-studie pågår. En spännande utveckling har inletts, där kombinationer av biologiska läkemedel riktade mot olika molekyler används för att uppnå bättre behandlingseffekt.
Även om utvecklingen av läkemedel mot våt makuladegeneration varit framgångsrik, ska det understrykas att vi för majoriteten av patienterna, dvs patienter med olika stadier av torr makuladegeneration, i dag helt saknar behandling. Stora resurser läggs därför på att öka kunskapen om sjukdomens patogenes och på att utveckla behandlingar mot främst geografisk atrofi. Flera studier har funnit en stark association mellan genetiska varianter i komplementsystemet och slutstadierna av makuladegeneration. Komplementfaktorer är därför en möjlig måltavla för terapi, och lampalizumab, en antikropp mot komplementfaktor D, studeras nu i den första fas 3-studien på patienter med geografisk atrofi [7].
Genterapi. Uppmuntrade av goda experimentella resultat har förhoppningarna att kunna ersätta defekta gener med friska (genterapi) varit stora. Konceptet har visat sig oväntat svårt att överföra på människa, och de kliniska resultaten har låtit vänta på sig. Situationen påminner på många sätt om utvecklingen för biologiska läkemedel som före de stora genombrotten, exemplifierade med makuladegeneration, var kantad av bakslag.
Nyligen har emellertid lovande resultat erhållits med genterapi vid ovanliga genetiska näthinnesjukdomar [8, 9]. Vid makuladegeneration är den genetiska bakgrunden komplex, och i dag saknas därför specifika måltavlor för genterapi.
Ett annat sätt att utnyttja genterapi är att förmå celler att producera proteiner som i sin tur fungerar som biologiska läkemedel. Ett exempel är de kliniska studier som nu pågår av att låta näthinnans celler själva tillverka anti-VEGF. Metoden innebär att adenovirus innehållande genen för VEGF-receptorn injiceras subretinalt (under näthinnan) strax intill området med våt makuladegeneration. Viruset byggs in i näthinnecellernas DNA, och cellerna börjar producera VEGF-receptorer som i sin tur fungerar som antikroppar och binder VEGF.
Fördelen med denna metod är, i teorin, en mycket långvarig effekt. Nackdelen är ett större kirurgiskt ingrepp än vid injektioner i glaskroppen. Preliminära resultat har publicerats på ett mindre antal patienter med våt makuladegeneration. Huvudsyftet har varit att påvisa metodens säkerhet, men man har även noterat en långvarig stabilisering av synen hos majoriteten av behandlade [10].
Om den positiva utvecklingen fortsätter, är det inte osannolikt att subretinala injektioner i framtiden blir lika odramatiska och vanliga som intravitreala injektioner är i dag.
Stamcellsbaserade behandlingar. Framsteg inom området regenerativ medicin gör det nu teoretiskt möjligt att ersätta döda celler i kroppen med nya celler från pluripotenta stamceller; geografisk atrofi är den första sjukdom där konceptet prövats på patienter [11]. Pluripotenta stamceller har förmåga att bilda kroppens alla celltyper, och de kan framställas och odlas dels från in vitro-fertiliserade embryon (embryonala stamceller), dels från reprogrammerade adulta celler (inducerade pluripotenta stamceller).
Retinalt pigmentepitel har visat sig vara förhållandevis enkelt att framställa från pluripotenta stamceller, ett viktigt skäl till att geografisk atrofi ansetts lämplig för pionjärstudier. Andra skäl är att ögat är mikrokirurgiskt tillgängligt och relativt immunprivilegierat. Eventuella komplikationer, som teratombildning, kan dessutom lätt upptäckas och åtgärdas.
Experimentella förstudier i en människolik djurmodell visar att transplanterade celler integreras väl och är funktionella [12]. En liknande teknik har använts i uppmärksammade pilotförsök på ett litet antal patienter där pigmentepitelceller från embryonala stamceller transplanterats under makula [13]. Försöken har i första hand syftat till att utvärdera metodens säkerhet, och allvarliga komplikationer har glädjande nog inte noterats. Man har även registrerat viss synförbättring, men resultatet ska tolkas med försiktighet eftersom behandlade patienter haft avancerad sjukdom innefattande fotoreceptordegeneration.
Det är osannolikt att transplanterade pigmentepitelceller verkligen kan förbättra synskärpan. Sannolikt kan pigmentepitelceller i dessa fall som bäst bibehålla synfunktionen, ett i sig stort framsteg. För verklig förbättring av synfunktionen krävs att även fotoreceptorer ersätts, vilket är teoretiskt möjligt men i praktiken utmanande. Ett första viktigt steg mot detta mål har tagits då man lyckats framställa och framgångsrikt transplantera fotoreceptorer från embryonala stamceller till möss [14].
Näthinneceller framställda från embryonala stamceller är allogena (ej kroppsegna) och riskerar avstötning efter transplantation även i det immunprivilegierade ögat. Näthinneceller från inducerade pluripotenta stamceller är i stället autologa (kroppsegna), och risken för avstötning är därför minimal. Metoden kräver dock att celler, som pigmentepitelceller, framställs individuellt för varje patient, en i dag oerhört tidskrävande och kostsam process [15]. Trots detta har nyligen det första försöket gjorts med celler tillverkade från inducerade pluripotenta stamceller. Försöket gjordes i Japan, då en patient med makuladegeneration transplanterades med pigmentepitelceller framställda från egna hudceller.
Ett annat, och troligen mer realistiskt, sätt att angripa avstötningsproblemet vid allogen transplantation är stamcellsbanker av pluripotenta celler med olika HLA-uppsättning, något som planeras på flera håll i världen.
Det ska understrykas att stamcellsbehandling vid makuladegeneration är i sin linda, men om dessa och kommande försök visar sig långsiktigt framgångsrika är det ett framsteg för stamcellsforskningen i stort.
Utvecklingen är inte oproblematisk
Makuladegeneration har på kort tid blivit en modell för avancerade biomedicinska terapier. Även om denna utveckling är positiv är den inte oproblematisk. Dagens behandling av våt makuladegeneration har redan ansträngt ögonsjukvården ekonomiskt och tvingat fram prioriteringar. Alltmer avancerade och i vissa fall individualiserade terapier riskerar att ytterligare förstärka denna utveckling. Samtidigt är nya behandlingar goda nyheter för alla patienter med svår synhotande sjukdom.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.