Sammanfattat
Vid Barretts esofagus är risken att utvecka esofaguscancer lägre än man tidigare trott.
Höggradig dysplasi bör behandlas, och synliga lesioner bör avlägsnas med endoskopisk resektion.
Det finns en påtaglig risk (upp mot 30 procent) för recidiv i kvarvarande Barrett-slemhinna även om höggradig dysplasi eller tidig cancer avlägsnats radikalt. All metaplastisk slemhinna bör därför eradikeras hos dessa patienter.
Radiofrekvenskbehandling är en säker och effektiv metod att eradikera Barretts esofagus.
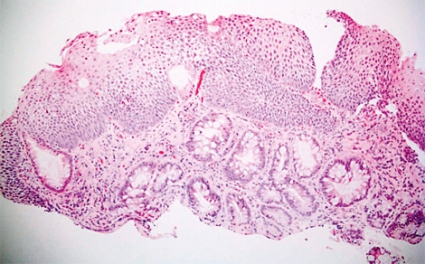
På senare år har det skett en kraftig incidensökning av adenokarcinom i esofagus i Sverige och västvärlden [1, 2]. Någon säker orsak till detta har inte kunnat påvisas, men sambandet med gastroesofageal refluxsjukdom är tydligt [3]. Av speciellt intresse är förekomsten av körtelmetaplasi, som ses hos cirka 5–10 procent av patienterna med gastroesofageal refluxsjukdom. Dessa förändringar har ett karakteristiskt endoskopiskt utseende, vilket gör att diagnosen ställs först vid endoskopiundersökningen. Körtelmetaplasi innebär att en del av det normalt förekommande skivepitelet i distala esofagus ombildats till körtelslemhinna. Om körtelslemhinnan innehåller bägarceller klassas den som intestinal metaplasi, vilket krävs för att den ska få kallas Barretts esofagus (Figur 1, Fakta 1). Dessa epiteliala körtelstrukturer kan därefter successivt utveckla olika grader av dysplasi (låggradig eller höggradig) och även progrediera till cancer (adenokarcinom).
Risken för adenokarcinom hos patienter med Barretts esofagus diskuteras fortfarande. Tidigare studier har kommit fram till att incidensen ligger kring 0,5 procent per år, vilket skulle betyda att cancerrisken är ungefär 100 gånger högre jämfört med normalpopulationen. Senare studier har dock visat en betydligt lägre incidens. I en dansk studie omfattande 11 028 patienter låg incidensen på endast 0,124 procent per år [4]. Gastroesofageal refluxsjukdom och Barretts esofagus utgör ändå en mycket väsentlig riskfaktor för utvecklandet av adenokarcinom i matstrupen [3].
Viktigt att identifiera riskgrupper
Eftersom en stor andel adenokarcinom i esofagus upptäcks kliniskt först i ett avancerat stadium är det väsentligt att definiera riskgrupper där en mer preventiv strategi skulle kunna vara applicerbar, alternativt definiera grupper där förutsättningar finns att hitta tumören tidigare. Screening bland patienter med gastroesofageal refluxsjukdom för att upptäcka Barretts esofagus anses i allmänhet inte motiverat. Det har föreslagits att patienter med påvisad Barretts esofagus borde följas med olika uppföljningsprogram, vilket innebär att de monitoreras med upprepade, relativt omfattande biopsitagningar. Uppföljningsprogram rekommenderas av allt fler stora gastroenterologiska föreningar [5]. Det finns dock inga randomiserade studier som på ett övertygande sätt har kunnat påvisa en gynnsam effekt av sådana program, vare sig på överlevnaden eller på den verkliga risken att drabbas av adenokarcinom. 2012 tog Svensk gastroenterologisk förening (SGF) fram nya riktlinjer för handläggning av Barretts esofagus. Den låga risken för att utveckla cancer gör att dessa patienter, om de inte uppvisar dysplasi, bara behöver kontrolleras efter ett år. Påträffas inte dysplasi då behöver inga nya kontroller ske. Dysplasi bör alltid eftergranskas av oberoende patolog. Om låggradig dysplasi påträffas bör patienten kontrolleras eller behandlas. Höggradig dysplasi bör som grundregel alltid behandlas. Detta bör också diskuteras på multidisciplinär konferens. Riktlinjerna kan laddas ner från SGF:s hemsida.
Effektiva medicinska och kirurgiska metoder
I dag finns effektiva medicinska och kirurgiska metoder att på kort och lång sikt behandla gastroesofageal refluxsjukdom oavsett om Barretts esofagus föreligger eller inte [6]. En nyligen publicerad studie visar att protonpumpshämmare (PPI) kan minska risken för att utveckla cancer [7]. Det finns dock ett flertal riskfaktorer som tycks bestämma risken för en sådan farlig processcancerutveckling. En av de mest betydelsefulla är utbredningen av den metaplastiska slemhinnan liksom om biopsier uppvisar höggradig dysplasi. Standardbehandlingen av sådana tillstånd var tidigare att göra en esofagusresektion, ett ingrepp som är förenat med hög morbiditet och även mortalitet. Numera kan vi i de flesta sådana fall uppnå samma resultat med endoskopisk resektion via gastroskop (se nedan). Ett annat uttryck för riskprofilen är att om inte hela det metaplastiska epitelet avlägsnas finns det en påtaglig risk att få recidiv av höggradiga dysplasier och tidig cancer [8].
Det ter sig därför logiskt att försöka abladera den körtelmetaplastiska slemhinnan, som därmed ersätts av nybildat friskt skivepitel, sannolikt utan förhöjd malignitetsrisk. En sådan behandling ska ses som ett komplement till endoskopisk resektion av synliga lesioner och ges tillsammans med effektiv antirefluxbehandling. Ett flertal abladerande metoder har kommit och gått, medan andra verkar behålla sin plats i den kliniska behandlingsarsenalen. Ablation av körtelslemhinnan i esofagus kan antingen vara mekanisk, termisk eller fotokemisk.
Endoskopisk ablation
Endoskopisk resektion är en mekanisk ablationsform där synliga förändringar i Barrett-slemhinnan tas bort. Den efterföljande histologiska bedömningen bestämmer om tumören är radikalt avlägsnad. Den stora fördelen med endoskopisk resektion är att ett ordentligt preparat fås för en avgörande viktig värdering. Man kan även särskilja mellan submukosala och intramukosala karcinom. Vid eventuell bristande radikalitet kan kompletterande endoskopisk resektion genomföras eller patienten remitteras för esofagusresektion.
En vanlig metod innebär att slemhinnan lyfts med sug, antingen efter att koksalt sprutats in eller genom att sätta ett ligaturband som vid varixbehandling, varefter preparatet kan avlägsnas med en diatermislynga. Metoden brukar benämnas endoskopisk mukosaresektion (EMR) vilket är något missvisade, då även submukosan kommer mer i preparatet. Komplikationer till EMR är ovanliga i vana händer, men strikturer och blödningar kan uppstå. Perforationer är ovanliga, men är viktiga att upptäcka eftersom även de enkelt kan behandlas endoskopiskt. Komplett eradikering av tidiga neoplasier uppnås i 97–100 procent av fallen.
Endoskopisk submukosadissektion (ESD) är tekniskt mer krävade än traditionell endoskopisk resektion men möjliggör större preparat. Metoden har använts med stor framgång i Japan och introduceras nu i västvärlden.
Ett problem efter framgångsrikt genomförd endoskopisk resektion är hur den kvarvarande Barrett-slemhinnan ska hanteras. Kompletterande endoskopisk resektion kan genomföras, men komplikationsriskerna ökar med antal behandlingar. Strikturrisken är stor vid endoskopisk resektion av cirkumferent utbredd Barretts esofagus.
För att uppnå fullständig ablation av hela Barrett-segmentet efter att endoskopisk resektion har utförts av alla synliga lesioner finns i stället en rad icke vävnadsbevarande metoder såsom fotodynamisk terapi, argonplasmakoagulation, kryoterapi och radiofrekvensbehandling.
Multipolär elektrokoagulation
Multipolär elektrokoagulation var en av de första endoskopiska ablationsmetoderna som användes. En värmeelektrod används för att fokalt koagulera slemhinnan. Metoden har numera ersatts med andra pålitligare ablationsmetoder, men kan övervägas vid mindre Barrett-förändringar hos patienter som uppvisar kontraindikationer för de övriga metoderna (exempelvis implanterad defibrillator).
Fotodynamisk terapi
Vid så kallad fotodynamisk terapi administreras ett fotosensibiliserande ämne intravenöst (porfyrinderivater, till exempel porfimernatrium (Photofrin] och 5-aminolevulinsyra) varefter området som ska abladeras belyses. När ljuset av en viss våglängd (630 nm) träffar slemhinnan uppstår fria syreradikaler som ger upphov till en destruktion av körtelslemhinnan.
Det finns en del problem med denna behandling. Under och efter behandlingen måste patienten undvika starkt ljus. Djupet av vävnadsdestruktionen kan ibland vara svårt att styra, varför upp emot en tredjedel av patienterna som genomgår fotodynamisk terapi riskerar att utveckla esofagusstriktur. Andra komplikationer är kräkningar, dysfagi och bröstsmärta. Förekomst av »buried glands« (kvarvarande Barrett-slemhinna) har också rapporterats hos upp till 51 procent av patienterna, vilket innebär att malignitetsrisken förmodligen fortfarande finns kvar [9]. I en 5-årsuppföljning med 208 patienter som genomgått fotodynamisk terapi påvisades komplett ablation hos 77 procent med från början höggradig dysplasi. En randomiserad multicenterstudie kunde påvisa en signifikant minskad risk för höggradig dysplasi och cancer om fotodynamisk terapi gavs som tillägg till behandling med protonpumpshämmare. Risken var dock fortfarande cirka 20 procent [10]. Dessa metoder har inte vunnit någon större popularitet i vår del av världen.
Argonplasmakoagulation
Vid argonplasmakoagulation används en kontrollerad ström av joniserad argongas som orsakar en värmeskada (destruktion) av slemhinnan till ett djup av 1–3 mm. Metoden är mycket arbetsam och kräver ett stort antal behandlingar. Dessutom verkar den vara förenad med hög recidivfrekvens. För närvarande rekommenderas argonplasmakoagulation endast som komplement till andra ablationsmetoder, till exempel vid mindre områden (< 1 cm) av kvarstående Barretts esofagus, främst av kostnadsskäl [5, 11].Kryobehandling
Vid kryobehandling används en lågtryckssprej för att administrera flytande kväve över slemhinnan, och epitelet fryses ned till ett djup av 2 mm. Sprejen appliceras lokalt och orsakar en fokal nekros. Kryobehandling har inte studerats lika mycket som andra endoskopiska behandlingsmetoder, men de resultat som har publicerats verkar lovande. Komplett eradikering av Barrett-slemhinnan har i en studie rapporterats hos så många som 78 procent av patienterna [12].
Radiofrekvensbehandling
Vid radiofrekvensbehandling koaguleras slemhinnan genom att radiofrekvensvågor med en hög effekt (cirka 300 W) appliceras under en kort tid (< 300 ms). Energin kan varieras mellan 10 och 15 Joule. Tät elektrodplacering (< 250 µm) möjliggör en kontrollerad vävnadsdestruktion av epitelet ned till muscularis mucosa. Detta sker utan att skada submucosan, vilket är viktigt för att undvika blödning, fibros och strikturer [13]. Ablationsdjupet blir i allmänhet 500 µm.
De första försöken med radiofrekvensbehandling påbörjades 2003, och den första 5-årsuppföljningen publicerades 2010. Initialt var 61 patienter inkluderade i studien, men tio valde att inte fortsätta efter 2,5-årsuppföljningen [14]. Av de kvarvarande 50 patienterna hade fyra (8 procent) utvecklat intestinal metaplasi, men 46 (92 procent) var alltjämt recidivfria. Ingen hade utvecklat dysplasi eller cancer och inga »buried glands« hittades. De fyra patienterna med recidiv behandlades alla framgångsrikt med förnyad radiofrekvensbehandling.
I maj 2009 publicerade Shaheen et al en randomiserad, skenkontrollerad multicenterstudie som utvärderade denna teknik. Vid 1-årskontrollen var 90,5 procent av slemhinnorna hos patienter med låggradig dysplasi eradikerade, jämfört med 22,7 procent hos kontrollgruppen. 81,0 procent av patienterna med höggradig dysplasi i slemhinnan var framgångsrikt abladerade jämfört med 19,0 procent i kontrollgruppen. I hela patientgruppen sågs en komplett eradikation av intestinal metaplasi hos 77,4 procent av dem som hade genomgått radiofrekvensbehandling jämfört med 2,3 procent hos kontrollgruppen. Sex patienter i ablationsgruppen utvecklade strikturer [15].Genomförande av radiofrekvensbehandling
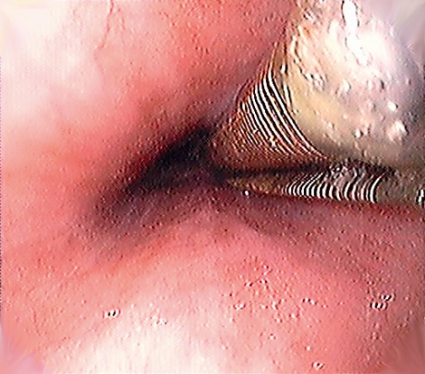
Vid radiofrekvensbehandling används två typer av ablationsinstrument (Figur 2); dels en 3 cm lång ballongkateter, dels en kateter som sätts fast längst ut på gastroskopet med passande generator. Vanligtvis krävs flera behandlingar innan Barrett-slemhinnan är helt eradikerad.
Cirkumferentiell ablation används för behandling av längre segment (> 3 cm) av Barretts esofagus. Innan behandlingen påbörjas görs en gastroskopi för att säkerställa utbredningen. En ledare förs ned och gastroskopet avlägsnas. Sedan mäts diametern i esofagus med en 4 cm lång »mätballong« så att rätt kateterstorlek kan väljas. När ballongkatetern har förts på plats introduceras gastroskopet på nytt för att säkerställa att den proximala delen av elektroden på ballongkatetern hamnar 1 cm ovanför den mest proximala delen av Barrett-slemhinnan. Ballongen blåses upp genom generatorn. Själva elektroden aktiveras med en pedal och en hög energipuls levereras till esofagus-slemhinnan. Ballongkatetern flyttas successivt i distal riktning, och behandlingen upprepas med 5–10 millimeters överlappning mot den föregående ablationszonen. Mer än nio centimeters behandling av slemhinnan rekommenderas inte vid samma tillfälle. Esofagus rengörs genom att all behandlad slemhinna skrapas bort, och därefter upprepas abladeringsproceduren en andra gång. Postoperativt kan patienten besväras av retrosternal smärta och/eller sväljningssmärta, varför vi har valt att ge esomeprazol 40 mg × 2, xylokain viskös, paracetamol oral lösning och tramadol brustabletter vid behov. En kontrollgastroskopi bokas in efter cirka åtta veckor. Vid behov görs då en ny radiofrekvensablation.
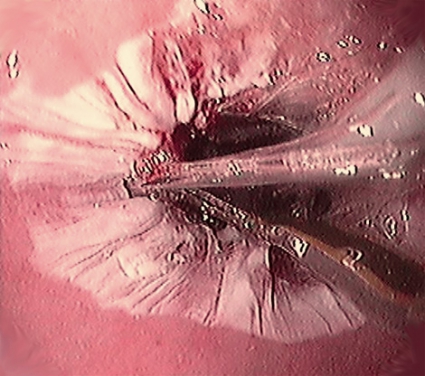
Fokal ablation (Figur 3) används vid kortare segment av Barretts esofagus (< 3 cm), kvarvarande små tungor och/eller enstaka öar av Barrett-epitel. Katetern fästes distalt på gastoskopet i »klockan 12-position«. Med ögonkontroll kan elektroden placeras fokalt mot den slemhinna som ska abladeras. Elektroden aktiveras på samma sätt som beskrivits ovan. När alla fokala förändringar är abladerade rengörs slemhinnan och proceduren upprepas [16]. Patienten har vanligtvis mindre besvär efter fokal behandling än efter en cirkumferentiell behandling, men båda genomförs alltid polikliniskt. Med ett vant arbetslag tar en behandling inte mer än en halvtimme.
Den första behandlingen i Sverige gjordes på Gastrocentrum, Karolinska universitetssjukhuset, i augusti 2007 och nu har metoden blivit en del i vår behandlingsarsenal mot dysplastiska epitelförändringar i Barretts esofagus. Synliga lesioner avlägsnas först med endoskopisk resektion för att få finnålspunktionssvar. Högupplösande gastroskopi och virtuell kromoskopi (narrow band imaging, NBI) görs för att identifiera synliga lesioner i slemhinnan. Virtuell kromoskopi är en endoskopisk teknik som kan underlätta diagnostiken vid exempelvis Barretts esofagus. Genom att filtrera bort en del av ljusets våglängder kan vissa slemhinneförändringar visualiseras tydligare.
Det primära syftet med radiofrekvensablation av Barretts esofagus är att förhindra cancer, ett annat är att minimera behovet av uppföljningsprogram efter endoskopisk resektion. Det krävs dock ett stort att antal behandlingar för att förebygga ett cancerfall. Andra ablationsformer har visat att Barretts esofagus har en tendens att återkomma, men det är oklart hur lång tid det tar och i vilken omfattning det sker. Den kliniska forskningen måste ta reda på hur man kan påverka recidivrisken. I nuläget kan ablation av ickedysplastisk slemhinna inte rekommenderas annat än i kontrollerade studier [17].Sammanfattning
Traditionellt har patienter med Barretts esofagus med samtidig höggradig dysplasi eller tidigt adenokarcinom genomgått esofagusresektion. Denna strategi har ändrats och i dag görs i stället endoskopisk resektion eller endoskopisk submukosadissektion. Om en aktiv behandling och uppföljning av Barretts esofagus ska vara meningsfull bör det kvarvarande metaplastiska epitelet abladeras, annars är risken för recidiv stor. Tidigare tekniker för ablation av Barretts esofagus var inte tillräckligt framgångsrika. Radiofrekvensbehandling är en numera beprövad metod som visat sig vara både säker och effektiv. Radiofrekvensbehandling bör därför övervägas hos patienter med Barretts esofagus med dysplastiska förändringar i esofagus. Långtidsstudier behövs för att avgöra vilka patienter som har ökad risk att få recidiv av Barretts esofagus.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.