Analys av syra–basstatus är av stor vikt vid svår sjukdom.
Klassisk tolkning av syra–basstatus baserad på bikarbonat är lätt att lära ut och tillämpa, men har svagheter.
Ett alternativt sätt att tolka syra–basstatus såsom beskrivet av den kanadensiska fysiologen Peter Stewart ger mer insikt i komplexa metabola syra–basrubbningar.
Metoden är svårare att tillämpa bedside, men webbaserade verktyg ger bra stöd och tolkningen kan leda till en ändring av behandlingen.
Koncentrationen av vätejoner i blodet (pH) är avgörande för proteiners form och därmed funktion i kroppen, och hålls vanligtvis inom ett mycket snävt intervall (0,000035–0,000045 mmol/l; pH 7,35–7,45). En analys av patientens syra–basstatus (blodgas) är därför rutin vid bedömning och behandling av måttligt till kritiskt sjuka patienter. En tolkning av ett blodgassvar fungerar för de flesta i Sverige antagligen ungefär så här [1]: Baserat på pH-värde bedömer man om det föreligger en acidos eller alkalos (mer korrekt vore att använda termerna acidemi och alkalemi eftersom pH-värdet i blod avspeglar summan av alla acidotiska och alkalotiska processer i kroppen). Sedan bedömer man om det är en metabol eller respiratorisk process som är den primära orsaken till pH-förändringen, baserat på basöverskott (BE), aktuellt bikarbonat- eller standardbikarbonatvärde och koldioxidtensionen (PaCO2). Därefter bedöms om den sekundära processen kompenserar den primära avvikelsen eller om den förvärrar tillståndet. En eventuell metabol acidos (minskat bikarbonatvärde och negativt basöverskott) kan sedan delas upp i hyperkloremiska acidoser, där kloriderna antas orsaka en lägre bikarbonatkoncentration [2], och acidoser med ökat anjongap orsakade av en ökad mängd syror såsom laktat. För detta krävs mätning av klorider, vilket långt ifrån alltid görs. Det finns även vissa tumregler för att kvantitativt bedöma om kompensationsmekanismerna är adekvata eller om det finns fler primära rubbningar.
I den här metoden spelar bikarbonat en central roll. Metoden är relativt lätt att lära ut och fungerar rätt bra i många fall. Den har dock vissa begränsningar, bland annat att det är svårt att upptäcka kombinationen av motsatta metabola rubbningar. Till exempel brukar en patient med ketoacidos utveckla acidemi på grund av ansamling av ketosyror, men om patienten dessutom får våldsamma kräkningar (»vätejonförlust«) kan denna alkalos delvis kompensera för acidosen. Basöverskott och bikarbonat blir mindre avvikande och blodgasen ser bättre ut, men patienten är sjukare. Att bedöma allvaret av en ketoacidos baserad på pH [3] är därmed inte självklart. Dessutom ger den klassiska tolkningen ibland inget svar på »konstiga rubbningar« som inte svarar på behandling och den gör en inte uppmärksam på den direkta effekten på pH av »neutrala« substanser såsom albumin och framför allt klorider.
Ett radikalt annorlunda perspektiv på syra–basstatus beskrevs under 1980-talet av den kanadensiska fysiologen Peter Stewart. Sammanfattat spelar bikarbonat i hans teori ingen primär roll utan den, liksom vätejonkoncentrationen, bestäms slutligen av tre oberoende faktorer: 1) koldioxidtensionen, PaCO2, 2) den totala mängden svaga syror (främst plasmaproteiner såsom albumin men även fosfat), Atot, 3) summan av starka katjoner (främst natrium och kalium) minus summan av starka anjoner (främst klorid och laktat), »strong ion difference«, SID [4-7]. I plasma är det framför allt skillnaden mellan natrium- och kloridkoncentrationerna som bestämmer SID, och normalvärdet är ca 40 mEq/l. Ju lägre SID, desto lägre pH.
Det som i praktiken skiljer det här perspektivet från det klassiska är bland annat att albumin nu fungerar som en svag syra via Atot (och inte som en buffert) [8]. Grovt sett orsakar en sänkning av P-albumin med 3 g/l (normalvärde ca 40 g/l) en ökning (förändring mot positiva värden) av basöverskottet med ca 1 mEq/l. Även kloridernas roll är nu annorlunda. Det är inte kloridernas effekt på bikarbonat som orsakar deras påverkan på pH, utan skillnaden mellan natrium- och kloridkoncentrationerna (genom SID). Det blir också tydligt att infusion med till exempel 0,9-procentig NaCl (SID 0 eftersom [Na+] = [Cl–] = 154 mmol/l) kommer att minska SID i plasma och därmed orsaka en acidos.
För många är Stewarts teori svår att förstå och ännu svårare att tillämpa. Några entusiastiska intensivvårdsläkare har dock utvecklat ett datorprogram, tillgängligt på www.acidbase.org [9], för blodgastolkning enligt Stewart som i vissa fall kan ge ett nytt perspektiv på komplicerade syra–basrubbningar.
Fall 1. En äldre kvinna kom till akuten på grund av konfusion. Hon hade sedan tidigare pacemaker, förmaksflimmer och hypertoni. ABC-kontroll var utan större anmärkningar. Laboratorieprov (Tabell 1) visade hyponatremi samt akut njursvikt inklusive metabol acidos. Ultraljud visade inga tecken på renalt avflödeshinder. Infusion med 0,9-procentig NaCl påbörjades och patienten fördes över till akutvårdsavdelning. pH-rubbningen förvärrades dock, varför patienten överfördes till IVA. Patienten bedömdes där ha en hypoton dehydrering, och man fortsatte behandlingen med 0,9-procentig NaCl. 9 liter 0,9-procentig NaCl gavs under drygt ett dygn utöver 2 liter glukos med natriumtillsats (Addex-natriumklorid). Med denna behandling steg S-natrium i önskad takt (10 mmol/l/24 timmar), diuresen kom igång och njurproven förbättrades. Trots detta förbättrades dock inte den metabola acidosen under det första dygnet. Man misstänkte då att den initiala acidosen korrelerad till njursvikten med ansamling av organiska syror (ökat anjongap) nu hade ersatts av en nytillkommen hyperkloremisk acidos. Patienten behövde dock fortfarande natriumsubstitution, och för detta ändamål valdes natriumbikarbonat. Härmed normaliserades patientens syra–basrubbning snabbt.
Det är dock inte helt lätt att förstå varför anjongapet inte minskade mer under det första dygnet, med en uppseglande hyperkloremisk acidos, en förväntad minskad ansamling av organiska syror och ett mer eller mindre konstant basöverskott. Patientens provsvar vid ankomst till IVA och efter intensiv behandling med NaCl matades därför in i datorprogrammet på www.acidbase.org (Figur 1 och 2).
Programmet visar att det redan vid intagningen till IVA, trots en låg–normal kloridnivå i plasma, fanns en svår hyperkloremisk acidos som ytterligare försämrats av NaCl-behandlingen. Behandlingsmålet bör rimligen vara att sakta normalisera natriumvärdet med så litet kloridtillskott som möjligt. Valet av NaCl som enda natriumkälla, både som 0,9-procentig infusionslösning och som glukostillsats, kan i detta fall ifrågasättas. Det hade troligen varit bättre att i alla fall delvis använda sig av till exempel Ringer-Acetat eller Plasmalyte i stället för NaCl och att ge extra natrium med hjälp av kontrollerad tillförsel av natriumbikarbonat, helst med sprutpump.
Notera att det enligt Stewart inte är bikarbonatet utan det (kloridfria) natriumet i natriumbikarbonat som, genom att öka SID, påverkar pH. Detta är lättare att förstå när man inser att natriuminnehållet i natriumbikarbonat är mycket högt, nämligen 600 mEq/l (4 gånger mer än i 0,9-procentig NaCl). Det här fallet visar också att begreppet hyperkloremisk acidos egentligen är felaktigt. Det handlar om den absoluta skillnaden mellan natrium- och kloridkoncentrationerna och kan därmed även uppstå vid normala eller till och med låga kloridnivåer. Detta visas även i Fall 2.
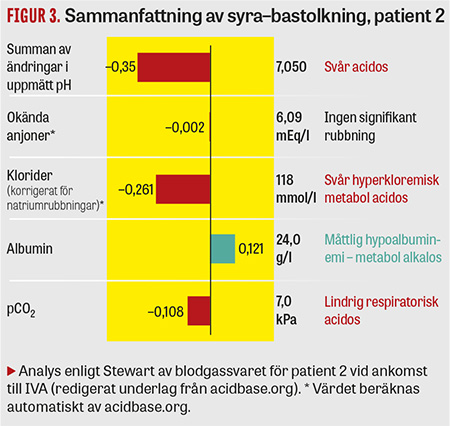
Fall 2. En patient hade en grav kombinerad respiratorisk och metabol acidos och hyponatremi (Tabell 2). Kloridvärdet (det första som togs efter mer än 12 timmars vård på intermediärvårdsavdelning) var lägre än referensintervallet, så en hyperkloremisk acidos misstänktes inte i första hand. Analys enligt Stewart (Figur 3) visar dock att den viktigaste komponenten i acidosen var hyperkloremisk. Inte heller här borde därmed troligen 0,9-procentig NaCl ha varit förstahandsval för resuscitering.
I olika svenska översiktsartiklar angående hyponatremi rekommenderas NaCl som en hörnsten i behandlingen [10, 11]. Ingen av dessa nämner risken för iatrogen acidos på grund av överdosering av klorider, och få beskriver alternativa natriumkällor [12]. Troligen skulle vissa patienter med hyponatremi må bättre av att få en del av sitt natriumbehov tillgodosett på annat sätt än genom natriumklorid, i alla fall när man har intensivvårdens resurser till sitt förfogande. En kontrollerad korrigering av S-natrium ska dock ha högsta prioritet vid svår hyponatremi.
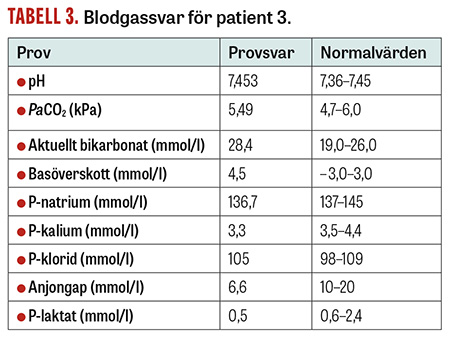
Fall 3. En medelålders kvinna togs till operation för en akut loop-ileostomi på grund av ileus i samband med en svår divertikulit. Patient hade en ventrikelsond som dränerat stora mängder vätska under några dagar. Dessa förluster hade på avdelningen ersatts med såväl Ringer-Acetat som med 0,9-procentig NaCl. Inför anestesin gjordes en blodgasanalys för att bedöma patientens syra–basstatus. Man förväntade sig antingen en hyperkloremisk acidemi, om mängden 0,9-procentig NaCl varit relativt för stor, eller en hypokloremisk alkalemi, om mängden 0,9-procentig NaCl varit relativt för liten. Överraskande nog visade blodgasen en lindrig metabol alkalemi samt en lindrig hyperkloremi (Tabell 3).
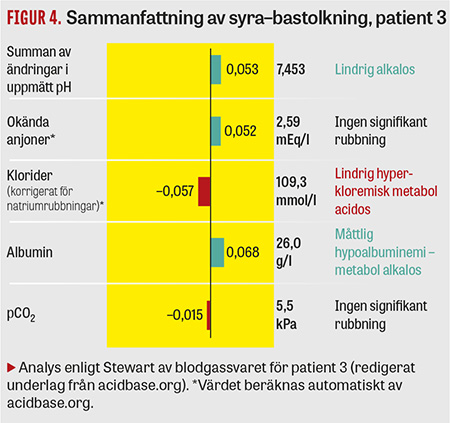
För att förklara detta lades värdena in i acidbase.org. Eftersom ett aktuellt albuminvärde saknades antogs ett lågt–normalt värde (35 g/l). Analysrapporten visade att sifforna inte riktigt gick ihop och ställde frågan huruvida det kunde föreligga en felmätning av albumin. P-albumin togs och visade sig vara 26 g/l. Således hade patienten en lindrig hyperkloremisk acidos som överskuggades av en måttlig alkalos sekundär till hypoalbuminemi (Figur 4).
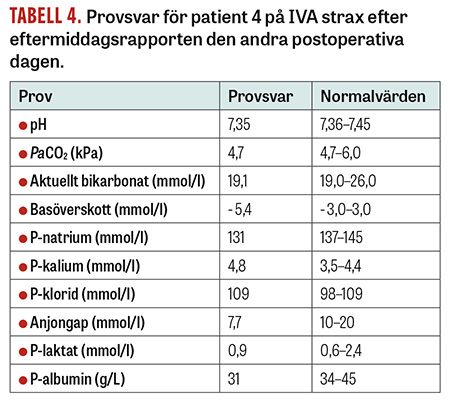
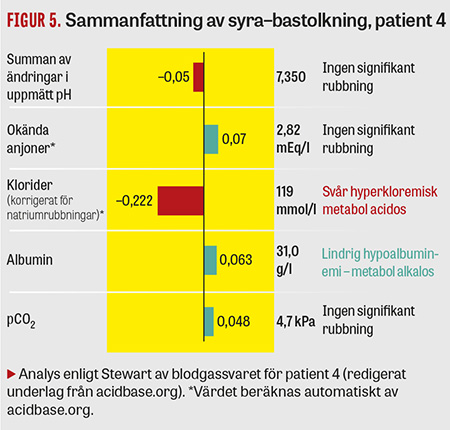
Fall 4. En 11 månader gammal flicka med preoperativ vikt på 7,9 kg vårdades postoperativt på IVA efter ett längre neurokirurgiskt ingrepp på ryggmärgen. Under vårdtiden hade patienten ett »besvärligt« negativt basöverskott som inte förbättrades (Tabell 4). Eftersom barnet även hade en takykardi föreslogs vid eftermiddagsrapporten ytterligare en albumininfusion ifall det hela ändå berodde på hypovolemi, trots ordentliga mängder tillförd vätska sedan ankomsten, både intravenöst och per os. Blodgasanalys enligt Stewart visade dock att patienten hade en hyperkloremisk acidos (Figur 5). Tillförsel av albumin (som ökar Atot) samt dess främsta lösningsmedel 0,75-procentig NaCl (som minskar SID) kunde därmed inte förväntas förbättra ett negativt basöverskott. Man avstod således från albumininfusionen. Efter genomgång av patientens vätskebalans och en förnyad klinisk bedömning på kvällen blev den nya arbetsdiagnosen iatrogen hypervolemi, som även den kan orsaka takykardi [13]. Patienten behandlades med vätskerestriktion och furosemid, och basöverskottet normaliserades över natten.
Sammanfattat
Stewart-modellen har sina kritiker [14], och det är tveksamt om det någonsin går att bevisa att den leder till ett bättre utfall. Ändå illustrerar dessa fall hur modellen leder till en djupare insikt i den enskilda patientens patofysiologi som har potential att förbättra behandlingen. Tolkningshjälpen är gratis och tillgänglig dygnet runt. Programmet kan dessutom länkas till sjukhuslaboratoriet och därmed bidra med automatisk analys av alla blodgaser. På Narkosguiden (www.narkosguiden.se) under kapitlet »Syra–basrubbningar« finns en sammanfattning av Stewarts teori på svenska med förslag på bedside-analys.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Lina De Geer, Linköping, Per W Möller, Bern, Schweiz, och Rainer Gatz, Köpenhamn, har granskat manuskriptet.