Årets Nobelpris i fysiologi eller medicin tilldelas James Rothman, Randy Schekman och Thomas Südhof för upptäckter om hur våra celler lyckas leverera viktiga substanser till exakt rätt ställe vid exakt rätt tidpunkt.
Vesiklar är bubbelliknande membranomgärdade strukturer som transporterar substanser mellan organeller inuti våra celler och ut till cellytan.
Vesikeltransporten är av central betydelse för en rad fysiologiska processer, t ex signalering mellan nervceller, frisättning av hormoner och immunsystemets funktion.
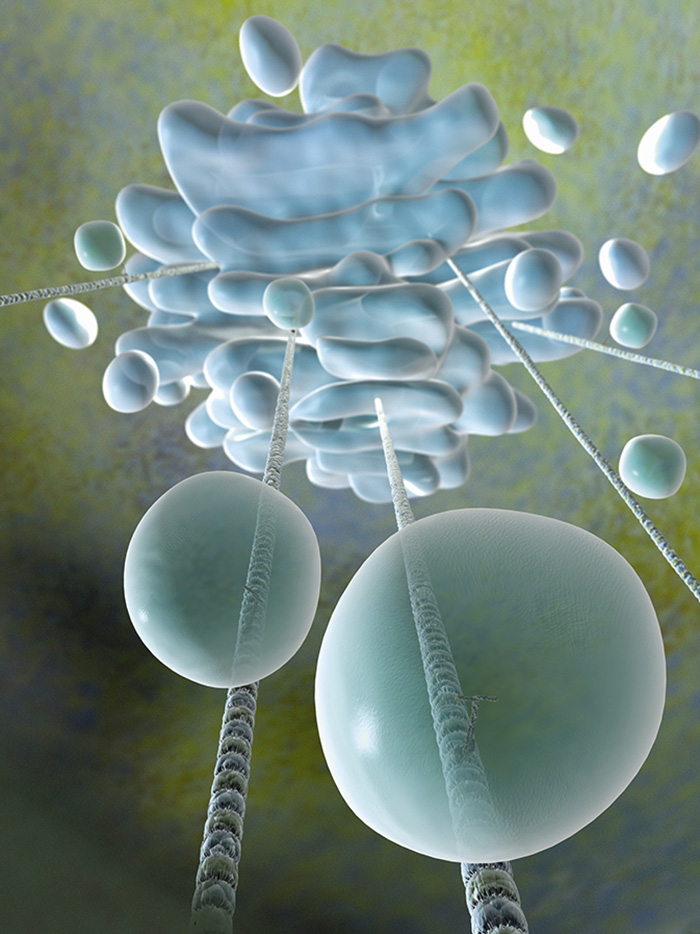
Årets Nobelpristagare i fysiologi eller medicin har löst mysteriet med hur de sfäriskt formade vesiklarna transporterar molekyler mellan organeller inuti våra celler och ut till cellmembranet (den blå formationen överst i bilden föreställer Golgiapparaten).
Illustration: Gunilla Elam/Science Photo Library/IBL
Kärnförande celler skiljer sig från bakterier genom sin komplexa organisation. De innehåller en mängd åtskilda fack, organeller, som är specialiserade för att utföra specifika funktioner. Organellerna är liksom själva cellen omgärdade av membran. Genom att funktionellt olika områden – såsom cellkärnan, mitokondrien, lysosomen, det endoplasmatiska nätverket och Golgiapparaten – är skilda från varandra kan olika kemiska miljöer föreligga oberoende av varandra i samma cell, och potentiellt farliga molekyler kan också hindras från att spridas fritt.
De olika organellerna måste dock kunna sända molekyler till varandra. Cellen måste också kunna frisätta substanser ut ur cellen på ett kontrollerat sätt. Nervceller måste exempelvis kunna frisätta transmittorsubstanser för att kommunicera med närliggande nervceller eller med våra muskler. Hormoner måste också frisättas för att vår ämnesomsättning ska fungera normalt och anpassa sig till våra skiftande behov.
Tidigare mysterium
Man har länge känt till att transporten av molekyler inuti cellen, mellan de olika organellerna och ut till cellmembranet, sker med hjälp av små bubbelliknande membranomgärdade strukturer som kallas vesiklar.
George Palade belönades med 1974 års Nobelpris i fysiologi eller medicin för sin kartläggning av hur cellen är organiserad med endoplasmatiskt nätverk och Golgiapparat. Han visade också att vesiklar förefaller röra sig inom cellen mellan dessa olika strukturer på sin väg mot cellytan.
Hur dessa vesiklar kan styras till exakt rätt ställe och hur deras frisättning av molekyler kan ske vid exakt rätt tidpunkt var däremot länge ett mysterium.
Jäst som första modellsystem
Årets Nobelpris i fysiologi eller medicin tilldelas James Rothman, Randy Schekman och Thomas Südhof, samtliga verksamma i USA, för upptäckter som radikalt har förändrat vår förståelse av denna aspekt av cellens fysiologi.
Randy Schekman använde jäst som modellsystem för att detaljstudera cellens transportsystem. Genom att systematiskt studera muterade jästceller där vesiklarna inte transporterades som de skulle utan i stället ansamlades inuti cellen, kunde han identifiera ett antal gener med kritisk funktion för vesikeltransporten. Han visade att dessa gener är livsnödvändiga och att de kan klassificeras i olika kategorier som reglerar vesikeltransporten på principiellt olika nivåer, t ex från det endoplasmatiska nätverket, från Golgiapparaten eller ut till cellytan.
Blixtlåsliknande mekanism
James Rothman använde ett biokemiskt tillvägagångssätt för att studera vesikeltransporten. Genom att rekonstituera fusion mellan vesiklar och Golgiapparaten in vitro kunde han rena fram proteiner som bildar det kritiska fusionskomplexet, det molekylära maskineri som kontrollerar membranens fusion.
Han insåg hur maskineriet är uppbyggt; att proteiner på vesiklarnas membran lokaliserar motsvarande proteiner på målmembranet och att dessa komplementära proteiner binder till varandra i specifika kombinationer och därefter smälter samman i en blixtlåsliknande mekanism. Denna process tvingar de två membranen att öppna sig och smälta samman med varandra. På detta sätt frisätts vesiklarnas innehåll.
Proteiner kontrollerar vesikelfusionen
Thomas Südhof var intresserad av hur vesikelfusionen kan kontrolleras så att transmittorsubstanser blixtsnabbt kan frisättas som svar på nervimpulser. Han upptäckte hur vesiklarna kan hållas redo att frisätta sitt innehåll i väntan på rätt signal. Han identifierade proteiner som känner av koncentrationen av kalciumjoner inuti cellen och snabbt initierar membranfusionen och vesikeltömningen när koncentrationen stiger.
Thomas Südhof identifierade även andra kritiska regulatoriska komponenter i vesikelmaskineriet.
Relevans för många sjukdomstillstånd
Årets tre Nobelpristagare har löst ett fundamentalt problem inom cellbiologin. Deras upptäckter har medfört ett paradigmskifte i vår förståelse av hur den kärnförande cellen – med sin komplexa interna organisation – kan sortera och transportera livsviktiga substanser så att de når rätt destination.
Vesikeltransporten är nödvändig för alla våra celler, och har relevans för en lång rad sjukdomstillstånd inom olika organsystem. Ett exempel är diabetes typ 2, där både frisättningen av insulin från bukspottkörteln och den insulinmedierade translokationen av glukostransportörer i muskel och fettvävnad är direkt beroende av en fungerande vesikeltransport.
En korrekt signalering mellan nervceller är också helt nödvändig för våra kognitiva funktioner, liksom för en normal kontroll av våra muskler. Immunsystemet är också helt beroende av vesikeltransporten för att kunna frisätta cytokiner och andra essentiella substanser som medierar såväl det medfödda som det adaptiva immunförsvaret.
Koppling till ärftliga sjukdomar
Förutom dessa generella sjukdomskopplingar finns även ett litet antal sällsynta men viktiga sjukdomar som direkt orsakas av ärftliga defekter i de proteiner som upptäckts av de tre pristagarna.
Ett exempel är den ovanliga sjukdomen familjär hemofagocyterande lymfohistiocytos (FHL). Vid FHL kan kroppens NK- och T-celler inte frisätta rätt substanser, och immunförsvaret kan därmed inte reglera sig självt på rätt sätt. Det medför ett hyperinflammatoriskt tillstånd som är livshotande men som kan botas med benmärgstransplantation, förutsatt att rätt diagnos ställs i tid. När det finns misstankar om att ett barn har sjukdomen testas lymfocyternas förmåga att avge vesiklar. Om denna förmåga är nedsatt, bekräftas diagnosen med ett genetiskt test.
Ett annat exempel är en specifik form av katastrofal epilepsi med hjärnskador hos små barn, vilken beror på genetiska defekter i ett av proteinerna i fusionskomplexet i hjärnans nervceller.
Det finns även kopplingar till infektionssjukdomar. Vissa bakterietoxiner angriper direkt fusionskomplexets proteiner. Tetanustoxinet förstör en komponent av det fusionskomplex som finns på vesiklar innehållande signalämnena GABA och glycin. Dessa inhibitoriska signalsubstanser kan därmed inte frisättas normalt, med följd att vi drabbas av stelkramp. Botulinumtoxinet förstör i stället proteiner i nervändslutens fusionskomplex så att frisättningen av acetylkolin till musklerna förhindras, med förlamning som följd.
Öppnat för nya forskningsområden
Botulinumtoxinet används som behandling vid svåra fall av dystoni och spasticitet. I övrigt finns ännu ingen direkt medicinsk terapi som bygger på de upptäckter som belönas med årets Nobelpris i fysiologi eller medicin.
Upptäckterna har dock öppnat en rad nya forskningsområden. Thomas Südhof arbetar exempelvis i dag med att försöka förstå hur en störd vesikeltransport kan vara inblandad i uppkomsten av Alzheimers sjukdom. En lång rad andra forskargrupper är intensivt sysselsatta med liknande frågeställningar, och det finns all anledning att förvänta sig ytterligare stora medicinska framsteg i kölvattnet av Schekmans, Rothmans och Südhofs banbrytande grundläggande upptäckter.
Läs även:
De kartlade cellernas transportsystem




















