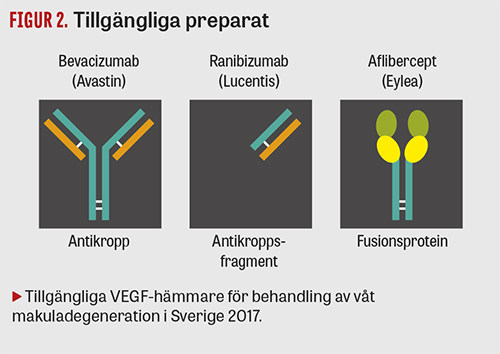
I dag används tre läkemedel mot våt makuladegeneration i Sverige. Ett av dem, Avastin, saknar indikation för ögonsjukdom.
Stora regionala skillnader råder i synen på off label-användning av Avastin, vilket gör att årskostnaden för en patient med våt makuladegeneration varierar från 2 000 till 44 000 kronor.
De stora skillnaderna kan inte sägas vara förenliga med hälso- och sjukvårdslagens mål, »en vård på lika villkor för hela befolkningen«, varför en större samsyn vore önskvärd.
Hälso- och sjukvårdslagen anger att sjukvårdens mål är »en god hälsa och en vård på lika villkor för hela befolkningen« [1]. Ändå råder i Sverige omfattande regionala skillnader inom flera medicinska områden [2]. Ett av dessa är behandlingen av våt AMD (åldersrelaterad makuladegeneration), där resursanvändningen visar stor variation beroende på bostadsort. Den genomsnittliga läkemedelskostnaden för en patient med våt AMD var under 2015 mer än 20 gånger högre i Region Västmanland (44 000 kr) än i Västerbottens läns landsting (2 000 kr). Den viktigaste orsaken till prisskillnaden är olika förhållningssätt till läkemedelsanvändning utanför godkänd indikation, förskrivning »off label«. Det är därmed inte självklart att det högre priset innebär en bättre kvalitet. Denna artikel redogör för hur denna situation uppstått, hur de regionala skillnaderna i behandlingen av våt AMD ser ut i dag samt presenterar en möjlig åtgärd för att uppnå en vård på lika villkor.
Förskrivning utanför godkänd indikation
Att använda läkemedel off label är utbrett inom flera medicinska fält. Läkare i Sverige har också laglig möjlighet att på eget ansvar, enligt vetenskap och beprövad erfarenhet, överskrida det användningsområde som är godkänt av myndighet [3]. Flera orsaker kan ligga bakom. Medicinska skäl är kanske de mest uppenbara: registrerad terapi kan saknas eller vara otillräcklig. Betydligt mer kontroversiellt är det när off label-förskrivning sker av ekonomiska skäl. Två preparat har skapat särskilt mycket debatt de senaste åren. Mabthera (rituximab) är registrerat för behandling av lymfom och reumatiskt artrit, men används på många håll mot MS [4]. Avastin (bevacizumab) är registrerat för behandling av flera cancersjukdomar, men används också vid ögonsjukdom med kärlnybildning.
Makuladegeneration och VEGF-hämmare
Åldersrelaterade förändringar i gula fläcken, makuladegeneration, är den vanligaste orsaken till irreversibel synnedsättning i västvärlden. I den allvarligaste formen sker nybildning av kärl i näthinnan med påföljande vätskeläckage, svullnad och snabb synnedsättning. För bara ett decennium sedan var sjukdomen inte möjlig att behandla och ledde till social blindhet hos två tredjedelar inom två år [5]. Kärlhämmande läkemedel för ögonbruk kan därför med rätta betraktas som en medicinsk revolution. Denna utveckling inleddes redan på 1970-talet då det fastställdes att tumörers förmåga att växa är beroende av kärlnybildning. I slutet av 1980-talet upptäcktes VEGF-A (vaskulär endoteltillväxtfaktor A), som är en viktig signalsubstans i denna process. I början av 2000-talet kom det första läkemedlet avsett att hämma VEGF.
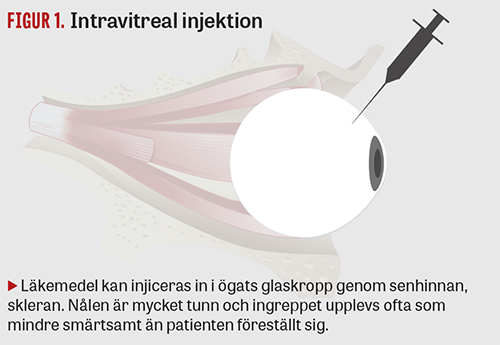
Bevacizumab är en humaniserad antikropp som blockerar alla former av VEGF-A. Preparatet utvecklades av företaget Genentech och började 2004 saluföras av Roche som Avastin, för systemiskt bruk mot koloncancer. Samtidigt fortsatte Genentech att utveckla en annan VEGF-hämmare för injektion i ögats glaskropp (intravitrealt) mot våt AMD. Eftersom antikroppar är stora molekyler användes endast det antigenbindande fragmentet från bevacizumab för att öka penetransen till näthinnan. I djurmodeller nådde inte heller bevacizumab fram till näthinnan i samma utsträckning som den nya substansen ranibizumab [6]. Ranibizumab lanserades 2007 som Lucentis, av Genentech i Nordamerika och av Novartis i resten av världen. Behandlingen inleds med månatliga injektioner (Figur 1) som sedan glesas ut. I många fall måste behandlingen fortsätta i flera år. Lucentis har god effekt och säkerhet; i registreringsstudierna fick 90 procent av patienterna förbättrad eller stabiliserad syn [7-9].
Före lanseringen av Lucentis hade dock oftalmologer på flera håll i världen börjat behandla intravitrealt med Avastin, som visade sig fungera alldeles utmärkt. Vid denna tid hade off label-användningen tydliga medicinska skäl – ingen annan behandling fanns tillgänglig. När den första (men numera avregistrerade) VEGF-hämmaren mot våt AMD, Macugen (pegaptanib; Bausch & Lomb), registrerats 2006 fortsatte ändå användningen av Avastin. Orsaken var då i stället att off label-terapin hade bättre effekt än den registrerade. Även efter Lucentis behöll Avastin sin position, men då av ett tredje skäl. Effekten var likvärdig men priset betydligt lägre [10]. Eftersom Avastin utvecklats för systemiskt bruk behövde endast en bråkdel av dosen användas vid injektion i ögat. Kostnaden blev därför ca en fyrtiondedel av kostnaden för Lucentis.
År 2013 lanserades ytterligare en VEGF-hämmare för ögonbruk, Eylea (aflibercept; Bayer). Utöver en del av en antikropp består detta fusionsprotein också av delar från en VEGF-receptor. De inledande studierna visade en effekt jämförbar med Lucentis, men därutöver att injektionerna inte behöver ges lika ofta [11]. Den likvärdiga effekten kunde bekräftas i en relativt färsk litteraturgenomgång. Data är i dag för begränsade för att några säkra slutsatser avseende eventuella skillnader mellan säkerhetsprofilerna för Eylea och Lucentis ska kunna dras. Det är dock rimligt att en glesare doseringsregim minskar risken för injektionsrelaterade komplikationer och underlättar för både patient och vårdgivare [12]. Eylea var det mest använda preparatet i Sverige mot våt AMD under 2015 [13]. Även aflibercept finns tillgängligt i större doser för onkologiskt bruk. Zaltrap (aflibercept; Sanofi) är också möjlig att dela upp i mindre doser för ögonbruk och kostar då avsevärt mindre än Eylea. Detta har endast provats i liten skala, varför inga säkra data finns gällande effektivitet eller säkerhet [14]. Det är också svårare att motivera en sådan studie etiskt i dag, jämfört med tiden för Avastins lansering. I dag finns ju flera registrerade preparat tillgängliga (Figur 2).
Avastin i Sverige
Under 2011 blev användningen av Avastin mot våt AMD utbredd i Sverige. Orsaken var resultatet från den amerikanska offentligt finansierade CATT-studien. Över 1 000 patienter med våt AMD följdes i fyra olika grupper som fått Lucentis eller Avastin månatligen eller vid behov. Efter ett år sågs ingen relevant skillnad i synskärpa mellan grupperna [15]. Resultatet har också bekräftats i andra studier med längre uppföljning [16]. Efter publiceringen beslutade flera ögonkliniker i Norrland, Örebro, Östergötland, Småland och Blekinge att Avastin skulle vara förstahandsval vid våt AMD [17]. Läkemedlet började också användas mot andra ögonsjukdomar med indikation för VEGF-hämmare. Kritiken lät inte vänta på sig, och den efterföljande debatten ledde till att Läkemedelsverket tydliggjorde att »godkända preparat skall användas när sådana finns tillgängliga«. Myndigheten kunde därtill inte »bedöma värdet av den beprövade erfarenhet av Avastin som finns i sjukvården« [18].
Kontroversen komplicerades ytterligare när Tandvårds- och läkemedelsförmånsverket (TLV), som beslutar om statlig läkemedelssubvention, under sommaren 2016 meddelade att off label-användning är ett »jämförelsealternativ«. Läkemedelsverket förnyade därför sin ståndpunkt i december 2016 till att godkända läkemedel ska vara förstahandsval och att omfattande förskrivning utanför det regulatoriska godkännandet alltid bör ske inom ramen för klinisk forskning [19]. I januari 2017 behöll dock TLV sin position: Valda läkemedel bör vara de mest kostnadseffektiva och off label-preparat kan vara ett alternativ i »särskilda situationer« [20]. Två svenska myndigheter uttryckte därmed motsägelsefulla åsikter. Till deras försvar bör nämnas att de också har motsatta ansvarsområden. Läkemedelsverket ansvarar för att läkemedel är säkra och effektiva, TLV för att de är prisvärda.
Avastin utanför Sverige
Liknande kontroverser har naturligtvis uppstått i resten av världen. Avastin används i stor utsträckning i både Finland och Norge. Ögonsektionen vid Oslo universitetssjukhus utför ca en fjärdedel av alla intravitreala injektioner i Norge, varav hälften i dag är Avastin. I Finland är motsvarande siffra 90 procenr, övriga 10 procent utgörs av Eylea. I Danmark används Avastin däremot inte alls, eftersom varken vårdgivare eller myndigheter vill ansvara för eventuella biverkningar av ett icke-registrerat preparat [Toke Bek, Århus, pers medd, 2017; Kai Kaarniranta, Joensuu, pers medd, 2017; Øystein Kalsnes Jørstad, Oslo, pers medd, 2017]. Det danska Rådet for anvendelse af dyr sygehusmedicin anser Eylea och Lucentis vara likvärdiga, och förstahandsvalet avgörs av årliga upphandlingar [21].
I Tyskland uppstod 2013 en rättslig tvist mellan Novartis och företaget Apozyt, som tillverkat och sålt förfyllda sprutor med Avastin. Frågan behandlades i EU-domstolen, som fastställde att en ompaketering utan modifiering inte behöver ett nytt medicinskt godkännande. Efterföljande år stämde det italienska konkurrensverket Roche och Novartis för att ha enats om att framställa Avastin som farligare än Lucentis. På samma sätt har konsumentgrupper i Spanien velat utreda om Roche och Novartis samarbetat för att hålla Avastin borta från ögonmarknaden. Franska myndigheter rekommenderar i dag Avastin före Lucentis [10]. De många turerna har lett till att EU-kommissionen bett Europeiska läkemedelsmyndigheten (EMA) att framställa riktlinjer för off label-användning inom unionen. Tre år försenad lades rapporten fram i februari 2017, men riktlinjerna uteblev [10]. Frågan är komplicerad för EU. Även om läkemedel regleras inom EU styrs deras användning av medlemsländerna. Frågan har stor ekonomisk betydelse. Det har uppskattats att den amerikanska sjukvården skulle spara nästan 3 miljarder dollar om året vid en total övergång till Avastin, trots att Avastin redan i dag är det vanligaste intravitreala preparatet i USA, med två tredjedelar av alla injektioner [22].
Behandling av våt AMD i Sverige i dag
Majoriteten av alla kliniker som ger intravitreala injektioner i Sverige är anslutna till det svenska makularegistret. I registrets årsrapport från 2015 finns information om aktiva patienter, antal injektioner och terapival uppdelad på klinik. Utifrån upphandlingspriset i Region Jönköpings län 2015 för de olika preparaten har den ungefärliga kostnaden per patient och år kunnat beräknas [13].
Avastin ingick i behandlingsarsenalen hos 10 av Sveriges 21 landsting. Hos dessa varierade användningen från 3 till 96 procent av alla injektioner mot våt AMD. En tydlig skillnad sågs mellan stad och landsbygd. Avastin användes inte i någon av Sveriges tre främsta tillväxtregioner. Antalet injektioner per patient och år för våt AMD visade också stor variation, från 2,5 till 7,1. Injektionsantalet uppvisade inte något tydligt samband med andelen nyregistrerade patienter, som varierade från 24 till 48 procent. Den uppskattade årskostnaden per patient varierade från 2 000 kronor i Västerbottens läns landsting till 44 000 kronor i Region Västmanland (Figur 3).
Eftersom antalet patienter med aktiv behandling under 2015 var över 12 000 motsvarar skillnaden mellan det billigaste och dyraste alternativet applicerat på alla landsting mer än en halv miljard kronor.
Ögon mot framtiden
Denna framställning kan kritiseras för användandet av rådata. Eftersom antalet injektioner ofta är högre det första året får kliniker med många nyregistrerade patienter ett högre antal injektioner per patient. Rutiner för hur länge patienter kontrolleras när behandling inte längre ges kan också variera. De flesta regionerna hade dock omkring en tredjedel nyregistrerade patienter 2015. En annan svaghet är att Svenska makularegistret inte har full täckning. Jämfört med statistik över diagnos- och åtgärdskoder så verkar vissa landsting rapportera mindre än 80 procent av injektionerna [Inger Westborg, pers medd; 2017]. Skillnader i upphandlat pris för olika regioner gör det också svårt att få fram helt korrekta prisjämförelser.
Trots felkällorna kan den nuvarande situationen omöjligen sägas vara förenlig med »en vård på lika villkor för hela befolkningen«. Enligt ovan finns i dag gott vetenskapligt stöd för att de tre tillgängliga preparaten är medicinskt jämförbara. Inte heller i Svenska makularegistret har signifikanta skillnader kunnat påvisas mellan Avastin och Lucentis [23]. Nyckelfrågan handlar alltså om förhållningssättet till rutinmässig förskrivning off label, vilket inte endast är en angelägenhet för oftalmologin utan kan komma att få betydelse för många andra medicinska fält. Här kan man undra om varje landsting ska ha en egen linje.
Sammanfattningsvis råder stora skillnader i behandlingen av våt AMD, både regionalt inom Sverige och internationellt. Frågan vem som förfördelas av dessa skillnader är däremot fortfarande obesvarad. Är det patienten som utsätts för risken av ett icke-registrerat läkemedel? Är det skattebetalaren, som tvingas betala för ett liknande men dyrare preparat? Eller är det läkemedelsföretaget, som utsätts för konkurrerande preparat som tillåts ta en genväg förbi det regulatoriska systemet? En nationell behandlingsstrategi skulle onekligen göra det mer logiskt för både patienter och vårdgivare, oavsett om man landar i den danska eller finska hållningen.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Läs även: