Melioidos är en tropisk infektionssjukdom som är vanlig i Sydostasien och orsakas av den högpatogena jordbakterien Burkholderia pseudomallei.
Allvarlighetsgraden varierar från subklinisk infektion till svår sepsis och risken för recidiv är hög hos patienter med diabetes.
Risk för laboratorieassocierad smitta föreligger vid odlingsdiagnostik.
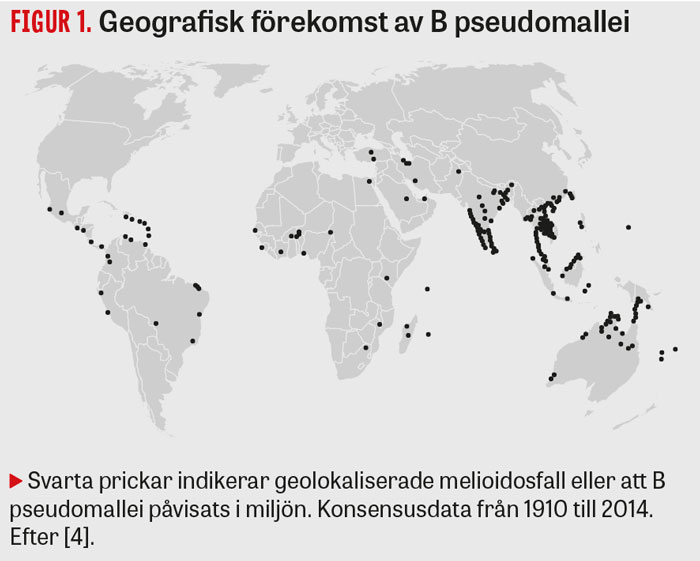
Melioidos är en bakteriell infektion med brett kliniskt spektrum. Den orsakas av Burkholderia pseudomallei, en gramnegativ stavformig bakterie som finns i jord och vatten i tropiska och subtropiska områden. Symtomen är inte specifika utan yttrar sig likt andra bakteriella infektioner beroende på infektionsfokus och värdfaktorer. Det är vanligt med svåra akuta infektioner som pneumoni och sepsis, men också kroniska tuberkulosliknande infektioner med långdragen feber och viktnedgång förekommer. Hudinfektioner är vanliga, likaså abscessbildning både via lokal och hematogen spridning [1]. Smitta sker via inhalation av aerosoler och damm, kontakt med skadad hud samt nedsväljning. Smitta mellan människor är däremot mycket ovanligt [2]. Efter kraftiga regn insjuknar fler på grund av inhalation av aerosoler, och i norra Australien rekommenderas befolkningen att stanna inne vid regn och blåsväder [3]. Sjukdomen är vanligast i Thailand och norra Australien (50 fall/100 000 invånare och år), men tros vara vanlig i hela Sydostasien och förekommer i tropiska och subtropiska områden globalt (Figur 1) [4]. Enligt en nylig uppskattning är melioidos underdiagnostiserat i världen, där så många som 165 000 människor beräknas insjukna och 89 000 beräknas dö varje år av sjukdomen [4].
Hemvändande resenärer från riskområden kan insjukna flera år efter resan, även om inkubationstiden oftast är 1–21 dagar [2]. Det är viktigt att ställa rätt mikrobiologisk diagnos då endast ett fåtal antibiotika har effekt och dödligheten är hög utan korrekt antibiotikabehandling i ett tidigt skede [2]. Bakterieodling måste ske vid skyddsnivå 3-laboratorium på grund av risk för laboratorieassocierad smitta [5].
Här presenteras tre fall av melioidos och en sammanställning av de odlingsverifierade fall vi kunnat identifiera i Sverige under 2000-talet.
Fall 1
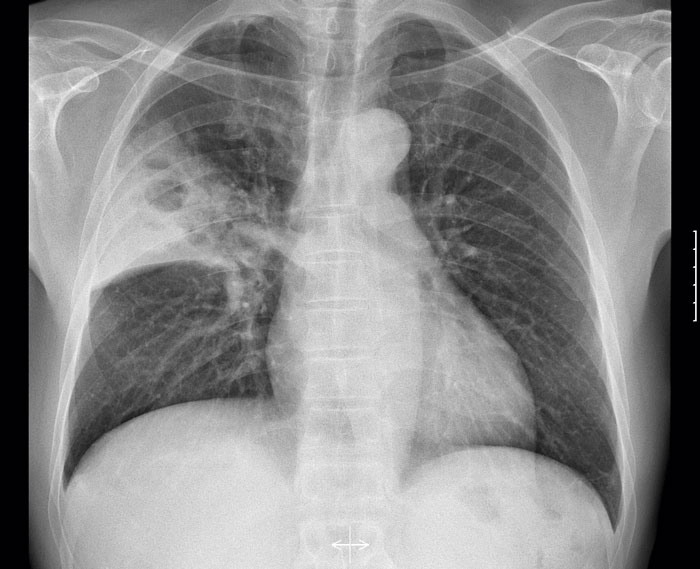
Fallet rör en tidigare frisk, rökande, 50-årig thailändsk man som sökte akut på vårdcentralen med tre dagars anamnes på hög feber och hosta. Han hade rest till Sverige en vecka tidigare för att arbeta som bärplockare. Patienten, som var högfebril och takypnoisk, remitterades akut till infektionskliniken där han behandlades med cefotaxim och erytromycin mot pneumoni (Figur 2). Patienten fortsatte att ha hög feber på avdelningen. Dagen efter inläggning kunde misstänkt B pseudomallei påvisas i sputumodlingen och man bytte antibiotika till ceftazidim. Ett dygn senare var patienten feberfri och förbättrades successivt. Blododlingar utföll negativa. Efter 10 dagars ceftazidimbehandling skrevs patienten ut med 3 månaders trimetoprim–sulfametoxazol-behandling. Under vårdtiden diagnostiserades även diabetes typ 2.
Fall 2
Fallet rör en tidigare frisk 48-årig man som sökte primärvårdsjouren med feberkänsla och öronvärk en månad efter semesterresa i Thailand. Vid undersökning sågs en svullen, varig hörselgång och förtjockad trumhinna på vänster sida. Behandling inleddes med penicillin mot perforerad akut mediaotit och kortisonsalva mot extern otit. Patienten blev feberfri men hade fortsatta symtom från örat som krävde upprepad lokalbehandling av hörselgången. Efter sex veckor noterades en abscess på kinden framför vänster öra. I abscessodling växte B pseudomallei och patienten övertogs för inneliggande vård på infektionsklinik med intravenös ceftazidimbehandling i 10 dagar, följt av peroralt trimetoprim–sulfametoxazol i kombination med doxycyklin under tre månader. Vid uppföljande kontakt ett år senare noterades god utläkning.
Fall 3
Fallet rör en 67-årig man med insulinbehandlad diabetes som sökte akut med feber, frossa och luftvägssymtom som debuterat under hemresa från semester i Malaysia. Lungröntgen visade hilusnära infiltrat, och i blododlingar växte B pseudomallei. Behandling inleddes med ceftazidim följt av trimetoprim–sulfametoxazol, men på grund av överkänslighet ersattes trimetoprim–sulfametoxazol med doxycyklin i kombination med ciprofloxacin under fyra månader. En månad efter avslutad behandling insjuknade patienten åter med B pseudomallei-bakteriemi. Infektionsfokus visade sig vara osteit med abscessbildning på underbenet. Antibiotikabehandling inleddes med piperacillin–tazobaktam i 14 dagar följt av amoxicillin–klavulansyra under sex månader.
Efter ytterligare 10 månader recidiverade infektionen ånyo varför underbenet amputerades. Uppföljande behandling med doxycyklin och amoxicillin–klavulansyra ordinerades därefter under ett år. Fyra månader efter avslutad behandling insjuknade patienten dock i ett tredje recidiv av B pseudomallei-bakteriemi. Något säkert infektionsfokus kunde inte identifieras, men livslång antibiotikabehandling ansågs indicerad och han ordinerades därför amoxicillin–klavulansyra i kombination med doxycyklin. Efter tre år avslutades dock doxycyklin på grund av fototoxiska biverkningar. Fyra månader senare avled patienten till följd av sepsis, men B pseudomallei påträffades inte i odlingar från det tillfället.
Svenska melioidosfall under 2000-talet
Melioidos är inte anmälningspliktigt och därför saknas säkra data avseende förekomsten i Sverige. Folkhälsomyndigheten påvisade B pseudomallei hos sju patienter mellan 2000 och 2016. De två svenska resenärerna vi beskrivit ovan diagnostiserades på ett lokalt mikrobiologiskt laboratorium, varför vi därmed identifierat nio fall av odlingsverifierad melioidos i Sverige under 2000-talet. Där uppgifter fanns var alla medelålders män (45–67 år; n = 8) som varit på semesterresa i Sydostasien (n = 6), och en var mannen från Thailand i fall 1. B pseudomallei isolerades oftast från blod (n = 5), och i alla nio fall hade bakterieisolaten vuxit fram på lokala mikrobiologiska laboratorier.
Diskussion
De beskrivna fallen illustrerar hur melioidos kan orsaka akuta livshotande infektioner men också hur förloppet hos en i övrigt frisk person kan vara lindrigt. Två av patienterna hade diabetes, vilket är den enskilt viktigaste riskfaktorn för att utveckla melioidos. Människor med diabetes löper dessutom högre risk för ett allvarligt sjukdomsförlopp och recidiverande infektioner [2]. I endemiska områden har majoriteten av melioidospatienterna någon bakomliggande riskfaktor, medan resenärer oftare är tidigare friska [6]. Kroniskt obstruktiv lungsjukdom, njursvikt, alkoholöverkonsumtion och kortisonbehandling är andra kända riskfaktorer [2, 7]. Av de fall som identifierades i Sverige under 2000-talet var samtliga män. Detta stämmer överens med sjukdomens könsfördelning bland resenärer [6] och bland boende i endemiska områden, vilket har uppfattats bero på könsskillnader i grad av utomhusvistelse [7].
Det kan vara svårt att primärt misstänka melioidos då symtombilden är varierande och då det är en sällsynt sjukdom i Sverige. Diagnosen borde ändå övervägas vid abscederande eller svårläkta bakteriella infektioner samt allvarlig infektion efter vistelse i riskområden. Det är viktigt att melioidosmisstanken framgår av bakterieodlingsremissen så att proven endast odlas på skyddsnivå 3-laboratorium. I alla de nio fall av odlingsverifierad melioidos vi identifierat under 2000-talet hade stammar vuxit fram accidentellt på lokala laboratorier. Det innebär risk för laboratorieassocierad smitta, men risken är ändå låg om god mikrobiologisk praxis följs och om direktkontakt och aerosolbildning undviks. Personal som hanterat isolat av B pseudomallei i skyddsnivå 2 bör följas med serologi, och postexponeringsprofylax kan övervägas beroende på exponeringstyp och personliga riskfaktorer [5, 8].
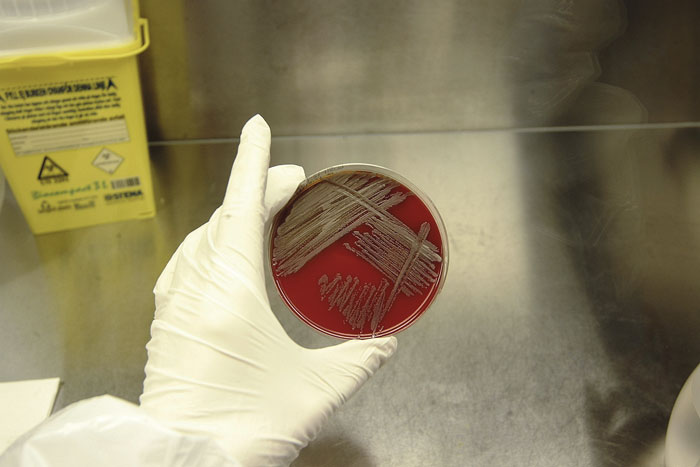
Folkhälsomyndigheten erbjuder serologi, odlingsdiagnostik och specifik PCR. Specifik PCR ger snabb diagnostik med hög känslighet medan odling ger möjlighet till resistensbestämning och högre känslighet vid bakteriemi. Även om bakterien växer på rutinodlingsmedier (Figur 3) har den svårt att hävda sig i en riklig normalflora [9]. I patientfall 1 växte sputumisolatet endast fram på antibiotikainnehållande medier för Legionellaodling, och för odlingsdiagnostik rekommenderas selektivt odlingsmedium [9]. Artbestämning med kommersiella metoder är inte tillräcklig [1]. I patientfall 1 gav analysmetoden MALDI-TOF (matrix-assisted laser desorption/ionization – time of flight) tillsammans med företaget Brukers rutindatabas resultatet B thailandensis med en kommentar om att den lågpatogena B thailandensis liknar B pseudomallei. Med hjälp av Folkhälsomyndighetens avgiftsfria webbplats Spektra [10] kan säkrare artidentifiering erhållas med MALDI-TOF, och spektrum för B pseudomallei finns även i företaget bioMérieuxs forskningsdatabas och Brukers säkerhetsdatabas. Artbestämningen bör dock konfirmeras med specifik PCR. Serologi ses som ett komplement till odling och kan vara av värde vid screening av hemvändande resenärer med oklar feber, påbörjad antibiotikabehandling, kroniska tillstånd eller då infektionsfokus inte medger provtagning, exempelvis hjärnabscess.
Burkholderiaarter är liksom andra jordlevande bakterier naturligt resistenta mot flertalet antibiotika. B pseudomallei växer dessutom intracellulärt och blir därmed ännu mer svåråtkomliga för antibiotika [2]. De preparat som visats ha bäst klinisk effekt är ceftazidim, meropenem och trimetoprim–sulfametoxazol. Meropenem rekommenderas till de svårast sjuka och vid CNS-engagemang. De rekommenderade behandlingstiderna är långa: minst 10 dagar intravenös antibiotika följt av 3–6 månaders peroral behandling [8]. Om trimetoprim–sulfametoxazol inte tolereras är amoxicillin–klavulansyra andrahandsalternativ, dock med sämre utläkningsfrekvens [11, 12]. Den tredje patienten utvecklade intolerans mot trimetoprim–sulfametoxazol och behandlades med andrahandsalternativ vilket i kombination med underliggande diabetessjukdom sannolikt bidrog till de många återfallen. Doxycyklin användes vid tidpunkten för behandlingen i kombination med trimetoprim–sulfametoxazol, men nyare kliniska studier har visat att trimetoprim–sulfametoxazol ensamt har likvärdig behandlingseffekt och lägre risk för biverkningar [13]. Ciprofloxacin anses i dag inte ha någon plats i behandlingen [12]. I Australien ges intravenös behandling i 2–8 veckor med god utläkningsfrekvens trots dålig följsamhet till den uppföljande perorala behandlingen [14, 15]. Brytpunkter för resistensbestämning finns endast från CLSI (Clinical and Laboratory Standards Institute, USA) och förvärvad antibiotikaresistens är ovanlig [11, 12, 16].
Konklusion
Melioidos är en allvarlig infektionssjukdom med ett brett symtomspektrum som är vanligt förekommande i Sydostasien. Endast ett fåtal antibiotika har visats ha god klinisk effekt. Intravenös behandling rekommenderas inledningsvis följt av peroral behandling under minst tre månader. Svenskar reser flitigt till endemiska områden, och vi har identifierat nio fall av melioidos i Sverige under 2000-talet, men det är möjligt att fler fall har diagnostiserats. Vid klinisk misstanke om melioidos bör patientprov skickas till Folkhälsomyndighetens skyddsnivå 3-laboratorium för specifik diagnostik och på grund av risken för laboratorieassocierad smitta.
Läs även författarintervjun med Åsa Gylfe
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.