Okomplicerade fall av lungemboli har låg mortalitet, men vid hemodynamisk påverkan är mortaliteten ca 50 procent trots behandling.
Rekommenderad initial behandling vid lungemboli med hemodynamisk påverkan är intravenös trombolys.
Om trombolys är kontraindicerad eller ger otillräcklig effekt måste andra alternativ tillgripas snabbt.
Alternativen är kateterledd intervention eller kirurgisk embolektomi, eventuellt med hjälp av extrakorporeal cirkulation.
Nationella riktlinjer för val mellan dessa alternativ saknas.
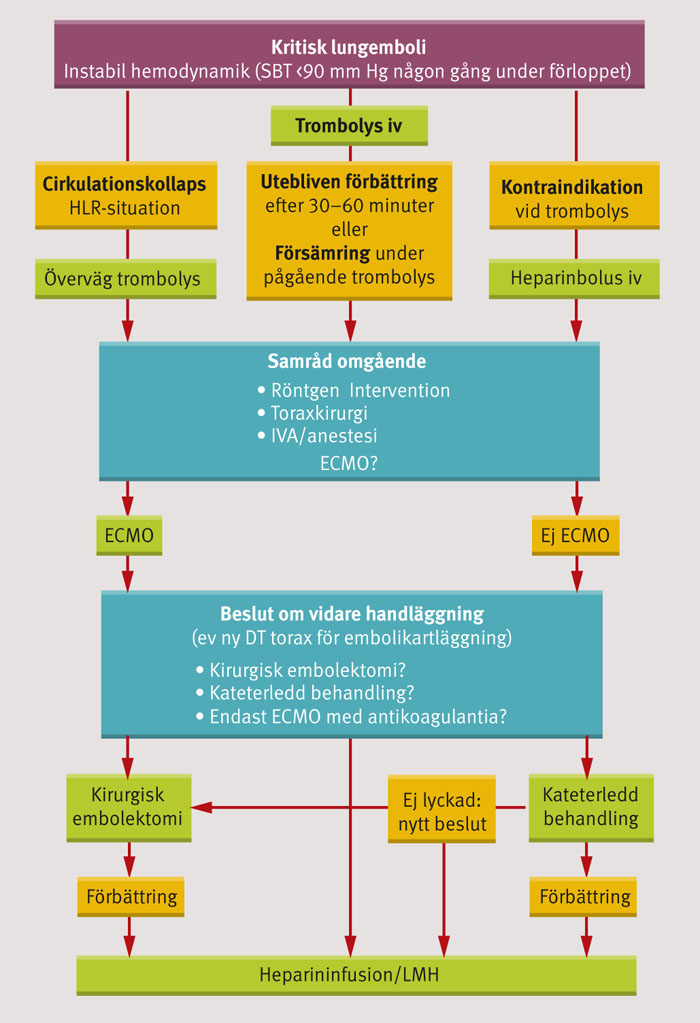
En algoritm för handläggning av kritisk lungemboli med hemodynamisk påverkan presenteras.
Handläggning vid lungemboli har diskuterats i Läkartidningen i en rad artiklar under 2000-talet [1-5]. Enligt Socialstyrelsen [6] har incidensen hos vuxna i slutenvård ökat från 54 till 86/100 000 mellan 2001 och 2011. Samma trend ses i andra länder och brukar hänföras till det ökade diagnostiska bruket av datortomografi (DT). Den totala dödligheten är ca 15 procent tre månader efter behandling [7]. Okomplicerade fall har låg mortalitet, men om patienten utvecklar hemodynamisk påverkan (systoliskt blodtryck under 90 mm Hg) är risken att avlida närmare 50 procent trots behandling [8]. De flesta dödsfall uppträder tidigt, och därmed finns sannolikt ett mörkertal av odiagnostiserade fall med letal utgång.
Rekommenderad initial behandling vid akut lungemboli med hemodynamisk påverkan är intravenös trombolys, även om kirurgi utan föregående trombolys har använts historiskt i ett mindre antal fall [9]. På senare år har dock alternativen till farmakologisk behandling utvecklats. Det gäller såväl kateterledd behandling som kirurgi [10], eventuellt med hjälp av extrakorporeal cirkulation [11]. Dessa kan komma i fråga om trombolys är kontraindicerad eller inte har tillräcklig effekt.
Syftet med denna artikel är att redovisa olika behandlingsprinciper och föreslå en ordnad handläggning.
Etiologi
Flertalet lungembolier kommer från tromboser i benets djupa vener (DVT). Riskfaktorerna för lungemboli är desamma som för DVT: malignitet, immobilisering, infektioner, kirurgi, hög ålder, hormonbehandling, graviditet och koagulationsrubbningar. Uppkomstmekanismen är nedsatt blodflöde i kombination med störningar i kärlväggens eller blodets inneboende skydd mot trombbildning. Blodets koagulationspotential gör att en 20–30 cm lång tromb som diagnostiserats i underbensvener kan byggas på så snabbt att den kan påvisas i v femoralis något dygn senare [12, 13]. Nybildade tromber har dålig hållfasthet, vilket möjliggör akut lungembolisering. Hur stor andel av de djupa tromberna som släpper embolier är inte känt, men asymtomatiska lungembolier har påvisats hos 50 procent av patienterna med DVT [14].
Majoriteten av patienterna med små lungembolier har normal lungfunktion vid uppföljning efter ett år [15]. Graden av resolution efter 6–12 månader är emellertid beroende av emboliernas utbredning och eventuell samtidig förekomst av hjärt–kärlsjukdom [16, 17]. Den initiala lysen beror på hög fibrinolytisk kapacitet i lungkärlen [18], medan slutresultatet är avhängigt av i vilken grad embolin organiseras. Denna process är ett samspel mellan endotelceller, fibrinolytiska systemet, proteolytiska enzymer och tillväxtfaktorer från aktiverade makrofager i kärlväggen samt trombocyter och monocyter i trombmassan [19].
Fibrinolys medieras av proenzymet plasminogen som är bundet i tromben. Kroppsegen plasminogenaktivator (tPA), frisatt från kärlendotelet, aktiverar plasminogen till plasmin, som i sin tur löser upp fibrinet. Den fibrinolytiska kapaciteten är hög i centrala kärl [18], vilket gör att större centrala embolier kan lyseras effektivt [15]. Vid livshotande embolisering kan processen påskyndas med rekombinant tPA. Detta medför att embolimaterialet fragmenteras och förs ut i perifera kärl där det destrueras tack vare kontakt med en större kärlyta [19]. Om tromben är äldre än två veckor kan embolimaterialet vara delvis organiserat, och då kan mekanisk fragmentering eller kirurgi ha bättre effekt än trombolys.
Farmakologisk behandling
Intravenös trombolys vid akut lungemboli har efter 24 timmar gynnsammare effekt på lungartärtryck och högerkammarfunktion och därmed även på genomblödning i lungor än heparin [20]. Metaanalyser av randomiserade studier som jämfört trombolys med antikoagulantia antyder lägre mortalitet och lägre recidivfrekvens efter trombolys, men entydig evidens saknas [20, 21]. En stor journalstudie med mer än 70 000 patienter med diagnosen lungemboli och samtidigt chocktillstånd och/eller respiratorvård visade lägre mortalitet med trombolys [22]. Trots avsaknad av säkerställd överlevnadseffekt i randomiserade studier råder etablerad konsensus om att lungemboli med hemodynamisk påverkan är indikation för trombolys i frånvaro av hög blödningsrisk [23]. Trombolys kan även övervägas vid hjärt–lungräddning (HLR) [24].
Diagnosen bör ha säkerställts med DT eftersom allvarliga blödningskomplikationer är vanligare efter systemisk trombolys än efter sedvanlig antikoagulantiabehandling [25]. Ekokardiografiska förändringar talande för akut lungemboli förekommer hos 30–40 procent av alla patienter med lungemboli. Vid hemodynamisk påverkan är förändringar på ekokardiografi betydligt vanligare [26], varför undersökningen kan vara ett alternativ när snabb diagnos krävs. Akut nedsatt högerkammarfunktion i kombination med förhöjda biomarkörer (troponin T och NT-proBNP) diskuteras som indikation för trombolys även till patienter utan hemodynamisk påverkan [27].
Radiologisk kateterledd behandling
Kateterledd behandling har tillämpats i drygt 40 år [28]. Syftet är att reducera lungartärtrycket och belastningen på höger kammare. Från början var katetersystemen grova och krävde friläggning av v femoralis, men i dag används införingshylsor som placeras perkutant i kärlet med Seldingerteknik. Med katetrar fragmenteras eller aspireras emboliskt material från truncus pulmonalis och dess huvudstammar. Embolier i kärl med mindre diameter än 6 mm är mindre åtkomliga för tekniken, och risken för kärlskador ökar [29]. Dessa interventioner kan kombineras med lokal trombolys. Fragmentering kan åstadkommas genom manuell rotation av en »pigtail«-kateter eller dilatation med en ballongkateter, varvid mindre fragment sprids ut i perifera lungartärer med minskad resistens som följd. Är trombmassan omfattande med utfyllnad av kärlträdet finns risk att detta inte har någon effekt på grund av ökande perifer embolisering. Det kan därför vara en fördel att manuellt aspirera materialet med grov kateter (8–9 F) och handspruta.
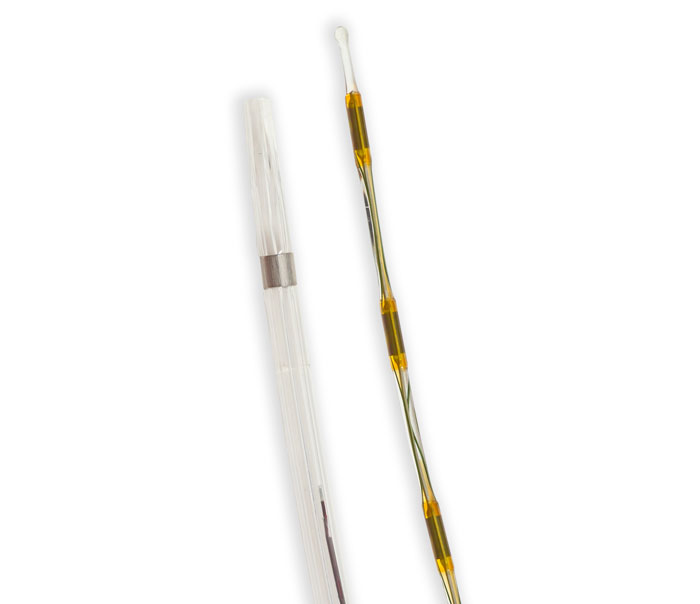
På senare tid har man utvecklat speciella katetrar som kombinerar mekanisk bearbetning och aspiration. En variant innehåller en roterande vajer, vars ände slutar med en spiral i en halvöppen stödhylsa som förs in i tromben (Figur 1). Då spiralen roterar med hög hastighet uppstår sug i hylsan, vilket möjliggör sönderdelning och aspiration av emboliskt material. Ett annat system utnyttjar den s k Venturieffekten av en högtrycksstråle med koksaltlösning som strömmar förbi insidan av ett hål i kateterspetsen och framkallar sug. Ett observandum vid långa »körningar« med just detta system är att patienten kan utveckla bradykardi med risk för asystoli på grund av frisättning av kärlaktiva substanser. Man kan även kombinera olika behandlingsprinciper genom att ge lokal trombolys via en infusionskateter som samtidigt avger ultraljud (Figur 2). Ultraljudet sönderdelar fibrinet i tromben utan att det leder till fragmentering, vilket möjliggör bättre penetration för trombolysmedlet.
Randomiserade studier saknas för jämförelse av kateterledd och annan behandling vid omfattande akut lungembolisering. I en systematisk översikt och metaanalys av artiklar från perioden 1990–2008 avseende klinisk framgång och patientsäkerhet framgick i ett sammanslaget material på 594 patienter att kliniskt positiv behandlingseffekt erhölls i 86,5 procent av fallen och att komplikationsrisken var mindre än vid systemisk trombolys [30]. Kateterledd behandling finns i flera varianter [10] men används relativt sällan i Sverige. I Lund görs 10–12 ingrepp per år, men på övriga universitetssjukhus är det mer sällsynt. Detta beror sannolikt på att man inte känner till eller tänker på metoden vid handläggning av akut lungemboli.
Kirurgisk embolektomi
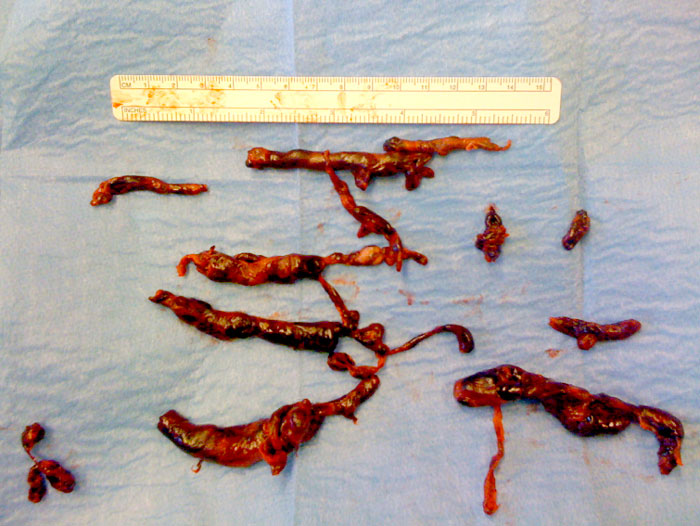
Kirurgisk behandling av akut lungemboli beskrevs av Trendelenburg 1908. Enligt den ursprungliga metoden stängs a pulmonalis av strax efter pulmonalklaffen. Då induceras ett cirkulationsstillestånd, som vid normal kroppstemperatur inte bör överstiga tre minuter. Under tiden öppnas a pulmonalis distalt om kärlklämman, och embolimaterialet utförskaffas (Figur 3). Arteriotomin stängs sedan med hjälp av en partiell kärlklämma så att blodflödet kan släppas på igen. Därefter sluts arteriotomin, och den partiella kärlklämman avlägsnas [31]. Utveckling av operationsmetoden inkluderar ocklusion av v cava superior och inferior i stället för av a pulmonalis, manuell kompression av lungorna för att lösgöra perifert inkilat embolimaterial, användning av hjärt–lungmaskin för att undvika cirkulationsstillestånd [32] samt eventuellt retrograd spolning av lungkärlbädden med hjälp av en artärlinje från hjärt–lungmaskinen som kopplas till vänster förmak [33].
En serie med 42 patienter som opererats för lungemboli utan hjärt–lungmaskin publicerades 1981 [34] med en sjukhusmortalitet på 55 procent. Den viktigaste riskfaktorn var om patienten haft hjärtstopp före operationen. Bland dessa överlevde endast en av 16, medan 18 av 26 överlevde bland dem som inte drabbats av hjärtstopp. Tillgång till hjärt–lungmaskin och annan utveckling har förbättrat prognosen påtagligt. Vid en jämförelse av publicerade resultat från tre perioder (1968–1989, 1990–1999 och 2000–2008) sågs minskande 30-dagarsmortalitet: 35, 30 och 19 procent [35]. I vissa serier har man sett ännu lägre mortalitet, bl a i Köpenhamn, där man bland 33 patienter som opererats under en 12-årsperiod nyligen kunde visa en 30-dagarsmortalitet på 6 procent [36].
Antalet jämförelser mellan kirurgisk embolektomi och primär trombolys vid lungemboli är begränsat. En icke-randomiserad studie av patienter i chock visade en trend mot högre mortalitet, ökad risk för allvarlig blödning och ökad risk för recidiv av lungemboli för farmakologiskt behandlade patienter [37]. En icke-randomiserad jämförelse mellan åtgärder efter ineffektiv primär trombolys visade att av 488 patienter var 40 (8 procent) fortsatt hemodynamiskt påverkade 24–36 timmar efter primär trombolys. 14 av dem opererades och 26 erhöll upprepad trombolys. Resultaten var signifikant bättre i den kirurgiskt behandlade gruppen: lägre mortalitet och färre allvarliga blödningar [38]. Dessa resultat talar för att kirurgisk embolektomi är ett viktigt behandlingsalternativ. Det saknas studier som jämför kateterledd behandling med kirurgisk embolektomi. Vid kirurgisk embolektomi nås trombmassor belägna i andra eller tredje förgreningen av lungartären. Kirurgisk embolektomi bör övervägas som första handsalternativ vid förekomst av intrakardiell trombmassa.
ECMO
Vid akut lungemboli är hemodynamisk påverkan eller hjärtstillestånd trots behandling med inotropa läkemedel förenat med hög mortalitet [8]. I en sådan situation kan extrakorporeal membranoxygenering (ECMO) vara till hjälp.
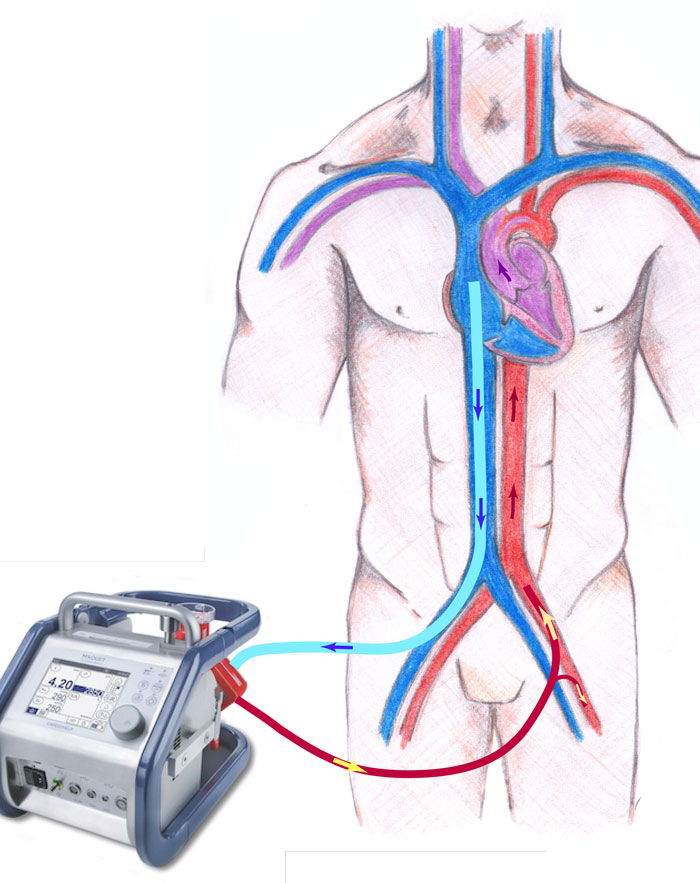
Vanligen används en veno-arteriell ECMO-krets i vilken blodet sugs ut från höger förmak, syresätts och återförs i en stor artär (Figur 4). Pump och oxygenator arbetar således parallellt med hjärta och lungor och kan ta över hela eller delar av cirkulationen. Enstaka patienter kan vid lungemboli i stället få kraftig respiratorisk svikt utan större högerkammarpåverkan, varvid veno-venös ECMO kan användas. Då dras blodet ut och ges tillbaka i närheten av höger förmak och syresätts på så sätt innan det kommer till lungan. Denna form av ECMO ger inte något stöd till cirkulationen. Det går oftast relativt snabbt att kanylera kärlen, hitta bra lägen för de ganska grova ECMO-slangarna och starta systemet. Patienter som löper hög risk att behöva ECMO på cirkulatorisk grund kan förberedas med artärnål och tunn central venkateter (CVK) i a respektive v femoralis.
Kliniska studier av ECMO-behandling vid lungemboli är begränsade till retrospektiva fallserier med 10–20 patienter med en överlevnad på 60–85 procent [39-43]. Patienterna var i kardiogen chock eller hade hjärtstillestånd före ECMO-behandlingen. Nästan alla dödsfall skedde de första dygnen, men de som överlevde intensivvårdstiden hade god långtidsprognos. Både kirurgisk embolektomi och katerburen behandling utförd med patienten på ECMO gav gott resultat [41, 42]. Man har även funnit att autolys och heparinbehandling ofta löser upp omfattande lungembolier eller flyttar dem till mer perifera artärgrenar inom 48–72 timmar [39, 43].
Extracorpororeal Life Support Organization (ELSO) rekommenderar kirurgisk embolektomi enbart om patientens hjärt–lungfunktion inte återhämtat sig efter två dygn på ECMO [44]. Ett skäl till tidigare kirurgi är komplikationer av ECMO-behandlingen. Vid Sahlgrenska universitetssjukhuset har under det senaste året två patienter behandlats med ECMO i fem dygn till följd av akut lungemboli som krävt HLR. Ingen av dem behövde genomgå kirurgi eller kateterburen intervention utan förbättrades snabbt och skrevs ut till vårdavdelning (Fakta 1). ECMO har även tillämpats postoperativt vid ett komplicerat förlopp efter kirurgi för kronisk lungembolism.
Handläggning
Intravenös trombolys ska användas i första hand, men alternativ måste finnas om sådan bedöms kontraindicerad eller inte har tillräcklig effekt. European Society of Cardiology rekommenderade 2008 [45] kirurgisk embolektomi i sådana fall. Kateterburen fragmentering anges som alternativ endast om tillgång till kirurgi saknas. American Heart Association angav 2011 [46] att såväl kateterburen fragmentering som kirurgi kan övervägas när trombolys bedöms vara kontraindicerad. Riktlinjer från American College of Chest Physicians 2012 [23] likställer kateterburen behandling och kirurgi vid kontraindicerad eller misslyckad trombolys samt vid progredierande chock.
Socialstyrelsens nationella riktlinjer från 2004 [47] saknar alternativ till farmakologisk behandling. Behandlingsprogrammet för Stockholms läns landsting [48] innehåller kirurgisk embolektomi men inte kateterledd behandling. Vårdprogrammet för Region Skåne [49] beskriver kateterburen fragmentering som ett alternativ men specificerar inte kirurgi som ett annat (kontakt med toraxkirurg omnämns). ECMO tas inte upp i något av nämnda vårdprogram.
Det finns behov av en samlad bild av de olika alternativens plats i behandlingen av hemodynamiskt påverkade patienter med lungemboli. Algoritmen i Figur 5 används på Sahlgrenska universitetssjukhuset och visar behandlingsalternativ inklusive ECMO. Delar av den finns publicerad i Västra Götalandsregionens vårdprogram för venös tromboembolism [50]. Även om icke-farmakologisk behandling bara kan utföras där resursen finns medger modern ambulanssjukvård att fler patienter kan komma i fråga för dessa behandlingsalternativ. En patient på ett sjukhus utan toraxkirurgi eller möjlighet till radiologisk intervention kan stabiliseras av ett mobilt ECMO-team och sedan transporteras under säkra former. Valet av metod bör sedan ske utifrån patientrelaterade faktorer, tillgänglig expertis och emboliernas utbredning. Med ökad kännedom om alternativen kan förhoppningsvis fler patienter med kritisk lungemboli räddas. I litteraturen om behandling av massiv eller kritisk lungembolism återfinns randomiserade studier endast för jämförelse mellan intravenös trombolys och antikoagulantia eller placebo. Studier som jämför kateterledd behandling med kirurgisk embolektomi saknas. Vårt val av referenser har därför styrts av syftet att ge ett kliniskt perspektiv på alternativ till intravenös trombolys när sådan är kontraindicerad eller har otillräcklig effekt. Någon jämförelse i utfall mellan de olika behandlingsmetoderna kan inte göras utan vidare studier. Randomiserade studier är svåra att genomföra i en situation som snabbt kan leda cirkulationsstillestånd vid längre tidsutdräkt.
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
Fakta 1. Fallbeskrivningar
Fall 1 rör en 40-årig icke-rökande kvinna med lindriga astmatiska besvär och heterozygot APC-resistens som hade skrivits ut efter en diskbråcksoperation i ländryggen för vilken hon inte erhållit trombosprofylax. Hon kom i ambulans till sjukhuset 10 dagar efter operationen efter att ha fått andningsbesvär och svimmat i hemmet. På akuten var hon vaken men dyspnoisk, ångestfylld och kallsvettig. Saturation på pulsoximetri var 83 procent vid luftandning, andningsfrekvensen var hög och blodtrycket 90/70 mm Hg. EKG visade sinustakykardi 140/min och tecken till högerkammarbelastning. Akut DT torax visade massiv central lungemboli med misstänkt tromb i höger förmak. Patienten togs direkt till IVA, där ultraljud visade kraftig högerpåverkan. Då patienten nyss genomgått ryggkirurgi bedömdes trombolys kontraindicerad. I samråd med toraxkirurg beslutades om kirurgisk embolektomi. Vid nedsövningen försämrades patienten akut med systoliskt tryck på 30 mm Hg och anslöts skyndsamt till hjärt–lungmaskin. Rikligt med trombmassor kunde extraheras direkt ur höger förmak och a pulmonalis (Figur 3), och ytterligare utbyte erhölls genom manuell kompression av lungorna och embolektomi med Fogartykateter. Postoperativ högerkammarsvikt föranledde inotropt stöd i några dagar, men patienten återhämtade sig och kunde lämna sjukhuset två veckor efter operationen.
Fall 2 rör en 57-årig rökande man med obesitas, hypertoni och tablettbehandlad diabetes som inkom i ambulans efter kollaps i hemmet. Han hade haft ont i vaden i en månad och dyspné i en vecka med kraftig försämring senaste dygnet. Han var blek men vaken, andningsfrekvensen var 32/min och blodtrycket 80/60 mm Hg. Pulsoximetri visade 83 procent på luftandning och 99 procent med syrgas 15 l/min. EKG visade sinustakykardi 124/min och T-negativisering i V1–V3. Blodgasanalys visade PaO2 15,4 kPa, PaCO2 3,2 kPa, pH 7,27 och basöverskott –10. S-laktat var 7,0 mmol/l. Man misstänkte lungemboli och gav heparin 10 000 E iv. Därefter genomfördes DT torax, som visade omfattande bilateral lungembolisering, stor sadelembolus och tecken på uttalad högerkammarbelastning. Patienten togs till IVA, där man påbörjade iv trombolys, men strax därefter inträffade cirkulationsstillestånd med pulslös elektrisk aktivitet. Efter kortvarig hjärtmassage och iv adrenalin återkom en pulsgivande men instabil rytm, och resterande trombolysdos gavs skyndsamt. Toraxkirurg anlade venoarteriell ECMO med transportabelt aggregat. Patienten flyttas till TIVA, där fortsatt trombolys gavs lokalt via kateter i a pulmonalis. Kateterledd fragmentering av tromberna diskuterades men kom inte till stånd på grund av brist på katetrar. Behandling fortsattes med heparininfusion, situationen stabiliserades och ECMO kunde avvecklas efter sex dagar. Lokala hematom uppkom vid katetrarnas insticksställen, men patienten återhämtade sig till tidigare fysisk funktionsnivå.
Fall 3 rör en 50-årig rökande man med alkoholproblem och svårbehandlad ulcerös kolit som sökte akut för dyspné och bröstsmärta. Han var vaken och klar. Blodtrycket var 118/80 mm Hg, pulsen 113/min och saturationen 93 procent med syrgas 4 l/min. Patienten hade haft DVT och lungemboli flera gånger, och redan vid första episoden påvisades protein S-brist som ärftlig riskfaktor. Bidragande orsak till recidiven var skov av ulcerosan och bristfällig kontroll av antikoagulationen. Patienten lades in och fick lågmolekylärt heparin, men flyttades efter några dygn till HIA på grund av bröstsmärta och cirkulatorisk påverkan. Ekokardiografi visade en dilaterad högerkammare, PA-trycket var 65 mm Hg och DT torax visade progress av kroniska embolier, mest i höger lungartär, samt en ny tromb i truncus. Man avstod från trombolys på grund av ulcerosan men startade heparininfusion. Nästa dag hade dock den pulmonella hypertensionen ökat till 80 mm Hg, och höger kammare visade nedsatt rörlighet. I samråd med toraxkirurg och radiolog beslöt man att pröva kateterburen fragmentering och lokal trombolys. Färska tromber centralt och på vänster sida kunde elimineras, men i höger lungartär fanns stora trombmassor som inte kunde påverkas. Blodflödet till mellersta och apikala delar av höger lunga var starkt reducerat. Efter interventionen mättes något lägre högerkammartryck, men patienten blev alltmer hypoxisk och lades in på IVA, där stigande tryck mättes med lungkateter. Man bibehöll full heparinisering och försökte minska resistensen i lungartärerna med epoprostenol och peroral tillförsel av sildenafil, men syresättningen försämrades alltmer. Efter nytt samråd beslöts om kirurgisk embolektomi av det mer organiserade embolimaterialet. Trots framgångsrikt ingrepp kvarstod uttalad högerkammarsvikt, som hindrade avveckling av hjärt–lungmaskin. Patienten lades i ECMO medan man försökte sänka trycken farmakologiskt igen, men detta misslyckades. Till slut måste ECMO-behandlingen avvecklas och patienten avled i persisterande pulmonell hypertension med högerkammarsvikt.