Järnbrist och anemi med järnbrist är globala hälsoproblem som innebär nedsatt livskvalitet och försämrad prognos hos patienter med kroniska sjukdomar.
Fynd av järnbrist ska föranleda överväganden angående bakomliggande orsak.
Kronisk inflammation leder via ökad hepcidinsyntes i levern till blockerad frisättning av järn från tarmen och depåer.
Järnbrist i avsaknad av samtidig inflammation behandlas med peroralt järn hos individer med frisk tarm.
Vid intolerans för peroralt järn, kronisk tarmsjukdom och samtidig inflammation är intravenös järnterapi förstahandsval.
Intravenös järnterapi med moderna preparat är säker med låg frekvens biverkningar. Infusionsanvisningen måste följas. Intravenöst järn ges i doser av 1 gram, upp till beräknat järndeficit.
Effektiv järnterapi ska leda till normalisering av Hb och återfyllnad av järndepåerna. Vid kroniska järnförluster ska behandlingen följas och upprepade doser ges vid behov.
Anemi definieras som hemoglobinnivå lägre än nedre referensgränsen: för icke-gravida kvinnor 120 g/l och för män 130 g/l [1, 2]. Anemi är ett globalt problem med fler än 2 miljarder drabbade, och järnbristanemi föreligger hos cirka 50 procent [1, 3].
Huvudorsakerna till järnbristanemi är undernäring med bristande intag av järn samt blodförluster från digestionskanalen och menstruationer. Järnbrist förekommer även isolerat eller som förstadium till anemi. Det finns stora geografiska skillnader i förekomsten av järnbrist och järnbristanemi. Vid en rad sjukdomar som cancer, kronisk njursjukdom, reumatiska sjukdomar och kronisk inflammatorisk tarmsjukdom är anemi med järnbrist vanligt [4, 5], Fakta 1.
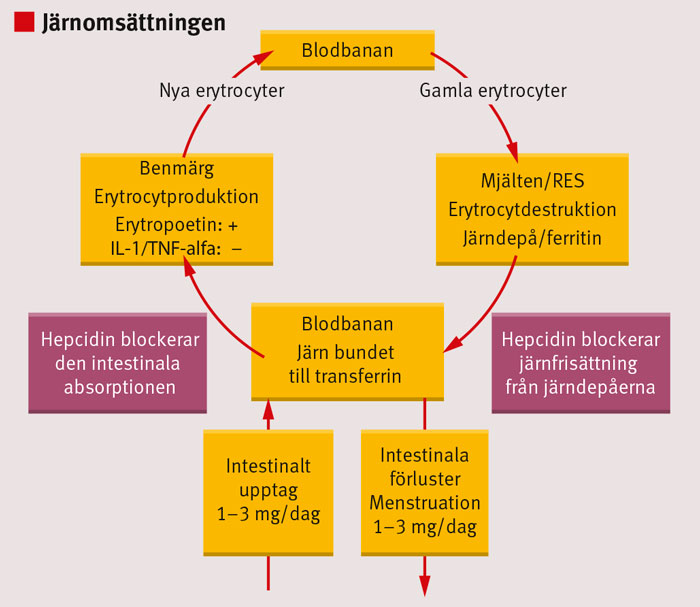
Järnomsättning vid erytrocytproduktion och nedbrytning
En vuxen person har i genomsnitt 2–6 g järn i kroppen, beroende på kroppsvikt. Av det finns 70 procent i erytrocyternas hemoglobin och 10 procent i enzymer och myoglobin, medan cirkulerande järn i plasma bara utgör 1 promille (3–4 mg). Järn bundet till ferritin i hepatocyter och makrofager (järndepåerna) utgör 20 procent av människans totala järninnehåll [4].
Järnupptaget sker huvudsakligen i duodenum och proximala jejunum. Järn transporteras till blodet från enterocyterna via ferroportin och binds sedan till transportproteinet transferrin (2 järnatomer per transferrinmolekyl) [6, 7]. Det transferrinbundna järnet förmedlas via blodet till kroppens olika celler, men framför allt till benmärgen. Vid varje given tidpunkt finns 3–4 mg järn i plasman med en effektiv recirkulation så att 20–30 mg järn transporteras varje dygn från tarmen och järndepåerna till erytropoesen i benmärgen. Det är makrofagernas fagocytos och nedbrytning av gamla erytrocyter som levererar den allra största delen av detta järn [8, 9]. Det finns ingen reglering av de normala järnförlusterna, som i normalfallet är ekvivalenta med upptaget från tarmen. Inflödet av järn till det cirkulerande transferrinet kommer således från tre källor: 1) recirkulation av järn från fagocyterade erytrocyter i makrofager (helt dominerande), 2) från järndepåer i hepatocyter samt 3) från intestinal järnabsorption (Figur 1).
Peptiden hepcidin, som bildas i levern, spelar en avgörande roll för järnomsättningen via reglering av järnupptaget från tarmen och frisättning av järn från depåerna [4, 9]. Syntesen av hepcidin i levern regleras av transferrinets järnmättnad så att hepcidinsyntesen ökar vid järnöverskott och minskar vid järnbrist. Membranbundet ferroportin finns på hepatocyter, makrofager och enterocyter. Hepcidin binds till ferroportin varefter komplexet ferroportin–hepcidin internaliseras och degraderas. Härigenom stängs den cellulära järnpassagen så att järntransporten till transferrin reduceras. Vid inflammation bildas IL (interleukin)-6, vilket leder till ökad syntes av hepcidin. Ökade hepcidinnivåer medför nedsatt järnfrisättning från depåer och tarm. Vid inflammation, oavsett orsak, uppstår således en funktionell järnbrist, med otillräcklig tillförsel av järn till erytropoesen i benmärgen.
Mekanismer bakom anemi och järnbristanemi
Patogenesen vid anemi är ofta multifaktoriell och kan indelas i störningar avseende produktion, destruktion eller förluster av erytrocyter. Anemi uppkommer vid en obalans mellan produktionen av erytrocyter i förhållande till nedbrytning och förluster [4, 10, 11].
Nedsatt produktion förekommer vid benmärgssjukdomar samt vid brist på byggstenar som järn, kobalaminer eller folat. Erytropoesen är även nedsatt vid inflammation/infektion (inflammationsanemi) på grund av ökad apoptos av erytrocytförstadier samt nedsatt effekt av erytropoetin i benmärgen sekundärt till påverkan av cytokinerna TNF (tumörnekrosfaktor), IL-1 och IFN (interferon)-gamma. Vid kronisk inflammation är dessutom frisättningen av järn från depåerna blockerad. Direkt benmärgspåverkan vid hematologiska sjukdomar, malign benmärgsinfiltration vid metastaserande cancer samt cytostatikabehandling och strålning medför anemi genom nedsatt erytrocytproduktion. Anemi på grund av nedsatt erytropoes karakteriseras av nedsatt antal retikulocyter.
Vid ökad destruktion av erytrocyter (hemolys) eller ökad förlust av erytrocyter (blödning) blir patienten anemisk om den kompensatoriskt ökade erytropoesen inte är tillräcklig. Anemi på grund av ökad destruktion eller förlust av erytrocyter karakteriseras av ökat antal retikulocyter, under förutsättning att erytropoesen kompensatoriskt kan öka (frisk benmärg och tillräcklig tillgång på byggstenar).
Ofta föreligger en kombination av olika orsaker till anemi, Tabell I [10, 11]. Järnbrist ses även då ett ökat järnbehov inte tillgodoses, som vid behandling med erytropoetin, ökad tillväxt (pubertet) eller graviditet.
Laboratoriediagnostik av järnbristanemi
Järnbristanemi karakteriseras av hypokroma, mikrocytära och storleksvarierande erytrocyter. Analys av ferritin är mest utslagsgivande vid diagnostik av järnbrist [4, 7, 8, 12]. Ett μg/l ferritin motsvarar 8 mg järn i depåerna. Eftersom ferritin är en akutfasreaktant ska det alltid värderas med hänsyn till eventuell samtidig inflammation genom analys av CRP. Låga ferritinnivåer är patognomona för reducerade eller tomma järndepåer. Nivåer <10 μg/l innebär helt tömda järndepåer.
Det saknas konsensus om brytpunkt för åtgärd vid järnbrist. Om brytpunkten sätts vid nedre referensområdesgränsen, 15–25 μg/l beroende på analysmetod, blir sensitiviteten för att påvisa järnbrist låg. Om brytpunkten i stället sätts högre, runt 30 μg/l, visar en rad studier att sensitiviteten ökar betydligt, med bara en liten reduktion av specificiteten [13, 14]. Som diskriminationsvärde för järnbrist utan samtidig inflammation (normalt CRP) används därför i Skandinavien ferritin <30 g/l. Vid samtidig inflammation (förhöjt CRP) är ferritinnivåer mellan 30–200 förenliga med järnbrist. Ferritin >200 talar emot samtidig järnbrist, oavsett CRP-nivåer [8, 10, 11]. Analys av transferrinmättnad har värde för diagnostiken. En nivå <20 procent är förenlig med järnbrist. Däremot har isolerad analys av järn eller transferrin inget värde. Diagnostiken av järnbrist kan skärpas genom analys av löslig transferrinreceptor (transferrin receptor fragment), vilka avspeglar antal celler med stort järnbehov. Nivån är således förhöjd vid järnbrist. Retikulocyternas innehåll av hemoglobin ger en ögonblicksbild av järntillgängligheten i benmärgen. Dessa analyser är dock ännu ej allmänt tillgängliga.
Sammantaget utgör analys av hemoglobin, ferritin och CRP hörnstenar i diagnostiken av anemi med järnbrist, som innefattar järnbristanemi samt kombinerad inflammatorisk anemi och järnbrist, Fakta 2.
Behandling med järn
Järnbrist och anemi med järnbrist är inga självständiga sjukdomsentiteter. Man ska alltid eftersöka bakomliggande orsak och försöka behandla den. Dessutom ska järnbristen substitueras [6, 11, 15, 16]. Målet för behandlingen är dels att normalisera hemoglobinnivån, dels att återfylla järndepåerna, vilka utgör cirka 10 mg järn per kg kroppsvikt. Peroral järnbehandling är förstahandsval såvida det inte föreligger inflammation som hämmar den intestinala järnabsorptionen, eller om patienten har malabsorption av annan orsak. Vanligen rekommenderas 100–200 mg elementärt järn (ferrosalt) fördelat på 1–2 dagliga doser [6]. Lägre doser kan också vara verksamma om patienten får mycket gastrointestinala biverkningar (illamående, buksmärtor, diarré/förstoppning) av behandlingen. Om peroral behandling är framgångsrik, ökar benmärgsproduktionen av erytrocyter med retikulocytos efter en vecka och normalisering av hemoglobinnivån sker inom 6–12 veckor. Återfyllnad av järndepåerna kräver ytterligare cirka 12 veckors järnbehandling [12, 15]. Det innebär sammanlagt 5–6 månaders behandling med peroralt järn innan hemoglobinnivån normaliserats och järnförråden återfyllts. Eftersom gastrointestinala biverkningar är vanliga är det viktigt att behandlingen följs upp och att uppmärksamhet ägnas patienternas följsamhet till den givna ordinationen.
Intravenös järnsubstitution används vid grav järnbristanemi (Hb < 100 g/l), vid samtidig tarmsjukdom, vid inflammatoriska tillstånd och då den perorala behandlingen inte tolereras eller inte leder till att behandlingsmålen uppnås [17, 18]. De tillgängliga intravenösa järnpreparaten är likvärdiga. De mest använda, ferrikarboximaltos och järnisomaltosid, kan ges i doser av 1 g intravenöst under 15–60 minuter till vuxna. Det totala järnbehovet (mg) vid anemi med järnbrist kan uppskattas [16] med utgångspunkt från aktuellt Hb och mål-Hb (g/l):
Totalt järnbehov (mg) = 0,2×kroppsvikt (kg)×(mål-Hb – aktuellt Hb) + depåjärn (10×kroppsvikt)
Det totala järnbehovet kan även beräknas översiktligt. Vid järnbrist utan samtidig anemi föreligger ett deficit på cirka 1 g. Vid måttlig eller mera uttalad anemi är behovet av järn 2–4 g, med det största behovet vid samtidig inflammation. Behandlingsresultatet utvärderas efter tillförsel av den uppskattade mängden järn. Oftast kan behandlingsmålen uppnås inom en månad. Risken för överbehandling är liten; mycket vanligare är underskattning av behovet. Allvarliga biverkningar är ovanliga vid behandling med moderna intravenösa järnpreparat, men det är viktigt att följa infusionsanvisningarna och ha beredskap för överkänslighetsreaktioner. Enligt den europeiska läkemedelsmyndigheten EMA 2013 registrerades 10 respektive 20 allvarliga reaktioner av överkänslighetsnatur per 100 000 behandlingar med ferrikarboximaltos respektive järnisomaltosid. Endast 1 dödsfall observerades [19].
Blodtransfusion är mycket sällan indicerat vid järnbristanemi. Eftersom intravenös järnbehandling ger snabb stegring av Hb, är den ofta tillräcklig under förutsättning att Hb är >70 g/l och att patienten inte uppvisar tecken på kritisk ischemi eller hypovolemi. Med denna strategi kan till exempel patienter med obskyr gastrointestinal blödning oftast bibehålla tillfredsställande Hb-nivåer genom upprepade infusioner av järn.
Potentiella bindningar eller jävsförhållanden: Jens F Dahlerup har uppburit föreläsararvoden från Viforpharma och Pharmacosmos. Björn Moum och Stefan Lindgren har uppburit föreläsararvoden och konsultarvoden från Viforpharma och Pharmacosmos. Författarna ingår i Nordic Anaemia Working Group, vars möten får finansiellt stöd från Viforpharma.
Fakta 1.
Anemi. Definieras med utgångspunkt från blodkoncentrationen av hemoglobin. Mindre än 130 g/l (8,1 mmol/l) för män och mindre än 120 g/l (7,4 mmol/l) för icke-gravida kvinnor.
Järnbrist. Nedsatt järninnehåll i kroppen, främst värderat med ferritin.
Järnbristanemi. Anemi som orsakas av nedsatt erytropoes vid låga/tomma järndepåer.
Inflammationsanemi (anemia of chronic disease). Anemi som orsakas av nedsatt järnupptag samt bristande frisättning av järn från depåer.
Blandad inflammatorisk anemi och järnbristanemi. Anemi pga inflammation och samtidig järnbrist.
Anemi med järnbrist. Järnbristanemi eller blandad inflammatorisk anemi och järnbristanemi.
Fakta 2. Laboratoriediagnostik av järnbristanemi
Anemi med ferritin <30 μg/l, oavsett CRP-nivå: järnbristanemi
Anemi med ferritin >30 μg/l och normalt CRP: anemi av annan orsak
Anemi med ferritin <200 μg/l och förhöjt CRP: sannolikt kombinerad inflammatorisk anemi och järnbrist
Anemi med ferritin >200 μg/l och förhöjt CRP: sannolikt inflammatorisk anemi