Molekylära läkemedel i cancerterapi, som antikroppar och kinashämmare, har använts sedan ett tiotal år. Unikt för dessa är inte bara att de är kostsamma utan också att de bara fungerar på vissa individer trots till synes samma tumörmorfologi. Urskiljning av patienter som förväntas svara på behandling sker genom att undersöka unika genetiska och proteinkemiska biomarkörer i patientens tumörceller. Dessa kan vara specifika genamplifieringar (till exempel HER2 i bröstcancer) eller mutationer i specifika gener (till exempel EGFR i lungcancer). Ibland betyder mutation att patienten förväntas svara på behandling, andra gånger inte, beroende på gen, typ av mutation och läkemedel.
Vem ska då hålla ordning på vilka molekylärbiologiska biomarkörer som ska testas vid olika maligniteter, och vem ska tolka resultatet? Är det klinikern som beställer analysen, patologen som utför den diagnostiska analysen eller genetikern, som tekniskt ofta ansvarar för analysen? Givetvis bör alla inblandade ha kunskap om analyserna. Den behandlande läkaren beställer analysen, men de som utför och ansvarar för analysen på de molekylärpatologiska laboratorierna bör vara de som i sitt utlåtande också kan svara på hur resultatet bör tydas. I vissa laboratorier görs detta av den diagnostiserande patologen, i andra av den laborativt ansvariga molekylärgenetikern. Det är därefter den behandlande läkaren som beslutar om patienten är lämplig för behandling eller inte, oavsett utlåtande från molekylärpatologin. Kliniska ställningstaganden rörande bieffekter och patientens allmäntillstånd bör vara avgörande för behandlingsval.
För att arbeta tidseffektivt för patienten och laboratorieeffektivt bör man då det är tillämpligt och möjligt redan vid morfologisk diagnos överväga möjligheten att utföra molekylärgenetisk/biokemisk analys på provet. Detta arbetssätt kallas ofta reflextestning och fungerar väl i till exempel bröstcancerdiagnostiken, där en immunhistokemisk (IHK) HER2-analys är standard för att vägleda om ett prov bör undersökas vidare för HER2-amplifiering med in situ-hybridisering (ISH).
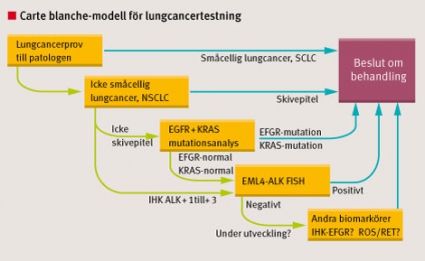
För lungtumörer är valen fler mellan vilka ytterligare molekylärbiologiska analyser som bör utföras efter konstaterad malignitet. Det finns flera olika läkemedel, och dessa har ibland olika prediktiva biomarkörer. För bästa respons med några av läkemedlen (EGFR-TKI) bör tumören uppvisa unika mutationer i EGFR-genen, och för andra typer (ALK-inhibitorer) bör en unik kromosomförändring, EML4-ALK-fusion, påvisas.
För att optimera patientomvårdnaden och det laborativa omhändertagandet bör lungläkare/onkolog redan vid misstanke om malignitet vid provtagningstillfället i remissen ge patologen »Carte Blanche« att utföra vidare molekylärbiologisk analys om tumören är av en viss typ (Figur 1). Materialtillgången är ofta begränsad vid lungcancerdiagnostik, och det är därför viktigt att provet räcker till alla nödvändiga undersökningar. Om vi inom molekylär patologi får tillgång till materialet redan i samband med morfologisk diagnos/IHK-diagnos kan vi ofta optimera vårt arbetsflöde för att få materialet att räcka längre.
För att inte minska patienters och klinkers möjligheter till test föreslår jag att nätverket för Svenska molekylär patologi, kanske tillsammans med Svenska lungcancerstudiegruppen, fortsätter att samla information om korrelationen mellan EML4–ALK-fusion och mutationsstatus på EGFR och KRAS innan man använder KRAS-data som negativ prediktor för vidare test. Initialt får vi utföra en viss övertestning för att kvalitetssäkra arbetssättet. Denna kostnad bör inte debiteras fullt ut, utan utföras som kvalitetssäkring inom respektive enhet. Internationella studier talar dock för att samtidig förekomst av endera EGFR- eller KRAS-mutation och EML4-ALK-fusion är ovanlig vid lungcancer [1], men en nationell övertygelse är viktig. Det behövs även en utvärdering av vilken ALK-antikropp som ska användas för IHK-analysen.
Andelen molekylära läkemedel som kräver molekylärbiologiska biomarkörundersökningar kommer med all sannolikhet att öka. För att kunna identifiera rätt patient för rätt behandling och kunna optimera provsvarstider och labbkostnader krävs ett effektivt arbetssätt. Kostnaderna för analyserna hamnar i dag ofta på inremitterande enhet. Vi har inom laboratoriemedicin en skyldighet att på ett kostnadseffektivt sätt genom utföra adekvata analyser i rätt ordningsföljd. Den föreslagna carte blanche-modellen, där inremitterande läkare redan på remissen till patologen godkänner fortsatt molekylärbiologisk undersökning på patientprovet, är inte unik i Sverige. Den har tidigare föreslagits av forskare inom lungfältet och används i liknande varianter i USA [2, 3]. Nu är det upp till oss att använda den.
Publicerad:
Läkartidningen 23/2012
Lakartidningen.se