Den senaste tiden har ett flertal översikter angående effekten av antidepressiva läkemedel publicerats. I Tandvårds- och läkemedelsförmånsverkets (TLV:s) genomgång av läkemedel mot depression [1] som offentliggjordes i början av januari 2009 baseras den hälsoekonomiska analysen och slutsatserna till stor del på en metaanalys av 85 studier med direkta jämförelser mellan olika antidepressiva läkemedel. I slutet av samma månad publicerade Lancet en liknande metaanalys av 117 studier [2]. Samtidigt kom en mindre metaanalys (63 studier) som jämförde venlafaxin med andra antidepressiva substanser [3]. Resultaten av dessa analyser är inte sinsemellan helt överensstämmande och skiljer sig från de slutsatser som tidigare dragits av SBU och Läkemedelsverket, vilka senast kommit till uttryck i en översikt av 56 placebokontrollerade studier av antidepressiva läkemedel [4]. Syftet är här att diskutera dessa skillnader och deras eventuella relevans för valet av antidepressiv behandling.
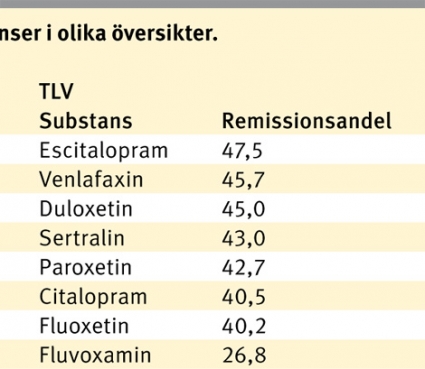
De olika metaanalyserna/översikterna är olika omfattande beträffande urvalet av substanser. Läkemedelsverkets översikt begränsar sig till de två mest använda klasserna av antidepressiva substanser, selektiva serotoninåterupptagshämmare (SSRI) och serotonin- och noradrenalinåterupptagshämmare (SNRI), totalt åtta substanser. Metaanalysen i Lancet omfattar ytterligare fyra nyare substanser medan TLV därutöver inkluderar flera tricykliska antidepressiva. I venlafaxinartikeln, som har ett mer begränsat syfte, jämförs venlafaxin med 15 andra substanser medan inga jämförelser görs mellan dessa. Som utfallsmått använder Läkemedelsverket och analysen i Lancet responsfrekvens, med respons definierad som minst 50 procents reduktion av den initiala symtompoängen mätt med Hamilton Depression Rating Scale (HDRS) eller Montgomery–Åsberg Depression Rating Scale (MADRS). I Läkemedelsverkets uppskattning av responsfrekvensen är placeboresponsen fråndragen. TLV använder sig av remissionsfrekvens, med remission definierad som HRDS ≤7 eller 8, eller MADRS ≤12. I venlafaxinartikeln analyseras både respons- och remissionsdata. Resultatredovisningen (Tabell I) och diskussionen begränsar sig här i första hand till den största gemensamma delmängden substanser (SSRI och SNRI) i de tre mer generella översikterna.
Den mest iögonenfallande skillnaden mellan översikterna är att escitalopram har cirka 7 procentenheter högre respons-/remissionsfrekvens än fluoxetin i Lancets och TLV:s analyser av studier med aktiv kontroll medan skillnaden är cirka 5 procentenheter i motsatt riktning i Läkemedelsverkets analys av placebokontrollerade studier. Noterbart är även att fluvoxamin faller ut relativt bra i Lancet-analysen jämfört med de andra analyserna.
Lancet- och TLV-översikterna redovisar även metaanalyser avseende tolerabilitet uttryckt som andelen behandlingsavbrott, totalt respektive på grund av biverkan. I båda fallen hade escitalopram och sertralin lägst andel avbrott. Överlag var dock skillnaderna mellan substanser relativt små.
Efter en sammanvägning av effekt, tolerans och pris förs sertralin i Lancet fram som ett tänkbart förstahandsalternativ vid måttlig till svår egentlig depression, medan escitalopram trots det högre priset faller ut som det mest kostnadseffektiva alternativet i TLV:s hälsoekonomiska analys. Läkemedelsverket, som inte tar hänsyn till priset, anser i sin genomgång att de observerade skillnaderna i placebojusterade responsfrekvenser inte är så stora (med undantag av fluvox-amin) att någon substans bör rekommenderas framför de övriga.
Huvudresultatet i venlafaxinanalysen, att SSRI är numeriskt sämre än venlafaxin, är på gruppnivå förenligt med resultaten i Tabell I. För enskilda substanser håller den slutsatsen endast för paroxetin och i viss mån för fluoxetin medan antalet studier är allför begränsat för slutsatser om övriga SSRI-substanser.
Publikationsbias. I metaanalyser som helt eller delvis baseras på publikt tillgängliga studier finns alltid risk för bias på grund av selektiv publicering, vilket uppstår då den som har det reella ansvaret avstår från att publicera studier med mindre fördelaktiga resultat. Även i studier som publiceras finns risk för bias genom selektiv rapportering, dvs när man ur den mängd av analyser som görs i varje studie väljer att rapportera de mer fördelaktiga.
Av de här diskuterade översikterna är det bara Läkemedelsverkets som inte påverkats av vare sig selektiv publicering eller selektiv rapportering. Metaanalyserna för de olika substanserna är baserade på samtliga placebokontrollerade studier som utförts inför ansökan om godkännande för respektive substans. Vidare har värderingen av de ingående studierna gjorts med tillgång till fullständiga studierapporter och studieprotokoll samt med möjlighet att utföra eller begära de kompletterande analyser som myndigheten funnit motiverade. Oftast har det sistnämnda gällt alternativa sätt att hantera bortfallet.
Såväl TLV som författarna till Lancet-artikeln har försökt minimera risken för potentiell publikationsbias. TLV lyckades med direkt förfrågan hos de aktuella läkemedelsföretagen, möjligen i kraft av att vara en myndighet, inkludera ytterligare 34 studier. Författarna till Lancet-artikeln sökte på företagens webbplatser och identifierade 15 opublicerade studier som uppfyllde inklusionskriterierna. För de elva substanser som är gemensamma för TLV:s genomgång och metaanalysen i Lancet identifierades totalt 124 studier. Fördelningen av dessa på de två analyserna framgår av Tabell II.
De 17 studier i TLV:s genomgång som inte ingår i metaanalysen i Lancet torde vare ett utslag av selektiv publicering och en mindre lyckad strategi för att identifiera opublicerade studier hos de berörda företagen. Exempelvis saknas en opublicerad studie som rapporterar högre responsfrekvens för citalopram än för escitalopram.
Att 54 studier som finns med i Lancet-artikeln saknas hos TLV torde bero på valet av utfallsvariabel och potentiellt vara ett resultat av selektiv rapportering. Till skillnad från responsfrekvens är det mindre vanligt att rapportera remissionsfrekvens, särskilt i äldre studier. Det kan då finnas en tendens att rapportera remissionsdata när de faller ut mer fördelaktigt. Bland Läkemedelsverkets placebokontrollerade studier ingår 25 studier med två aktiva substanser. Om dessa hade rapporterat remissionsdata och inkluderats i TLV:s analys skulle, med det rimliga antagandet att respons- och remissionsfrekvens är högt korrelerade, utfallet ha blivit bättre för paroxetin och fluoxetin. Bland de studier som saknar remissionsdata finns två jämförelser mellan citalopram och escitalopram. Någon skillnad i responsfrekvens sågs inte i dessa studier.
De skilda utfallen för sertralin och duloxetin i de två metaanalyserna kan till en del bero på att 14 sertralinstudier som finns med i Lancet saknas hos TLV och att tre duloxetinstudier i TLV:s analys saknas i Lancets.
Hantering av bortfall. I publicerade studier av antidepressiva läkemedel redovisas oftast respons-/remissionsresultat från analyser där bortfallet har hanterats enligt principen last observation carried forward, LOCF. Det innebär att en patient som uppnått respons/remission och därefter avbryter studien t ex på grund av intolerans anses ha uppnått respons/remmission i analysen trots att det är ett behandlingsmisslyckande. En annan princip som används är observed cases (OC), i vilken endast patienter med en mätning vid den primära analystidpunkten inkluderas. Båda dessa principer (LOCF och OC) tenderar att gynna aktiv behandling i placebokontrollerade studier, varför Läkemedelsverkets analys dels inkluderar alla randomiserade patienter som påbörjat behandling, dels räknar alla patienter som avbryter behandlingen som behandlingsmisslyckanden vare sig de uppnått respons/remission eller inte före avbrottet.
I studier som jämför två aktiva läkemedel tenderar LOCF och OC att gynna det läkemedel som har fler behandlingsavbrott, särskilt om orsaken är biverkningar. Det kan ha lett till att utfallet för fluvoxamin, duloxetin, paroxetin och venlafaxin har överskattats något hos TLV och i Lancet. Ett potentiellt problem är den möjlighet som efter avslutad studie och inför publiceringen ges att välja mellan olika alternativa analyser av bortfallet. TLV och författarna till Lancet-artikeln har i de flesta fall varit tvungna att acceptera den analys som sponsorn valt att rapportera.
Sponsorbias. Flera analyser av publicerade studier som jämför två aktiva behandlingar har visat på att det sponsrande företagets läkemedel tenderar att få ett bättre utfall [5, 6]. Flera mekanismer kan förklara en sådan tendens. Det företag som initierar studien bestämmer de doser som ska studeras, såväl för det egna läkemedlet som för jämförelseläkemedlet. Det är då vanligt att inte medge titrering av kontrollbehandlingen till dess fulla potential. Det sponsrande företaget bestämmer i regel om eventuell publicering. Det finns således utrymme för selektiv publicering och selektiv rapportering, t ex val av utfallsvariabel (respons eller remission) och princip för att hantera bortfallet.
I studier med aktiv kontroll jämförs ofta ett nytt läkemedel med ett etablerat på initiativ av tillverkaren av det nya läkemedlet, ofta som ett led i marknadsföringen. Det innebär för de här aktuella antidepressiva läkemedlen att en eventuell sponsorbias skulle gynna de nyare substanserna (escitalopram, duloxetin och i viss mån sertralin) på bekostnad av de äldre (fluoxetin, paroxetin och citalopram), och således till en del kunna förklara de skillnader mellan substanser som ses i TLV:s genomgång och i analysen i Lancet och även skillnaden jämfört med Läkemedelsverkets analys.
Direkta och/eller indirekta jämförelser. TLV och författarna till Lancet-artikeln använder en relativt ny statistisk metod för att med såväl direkta som indirekta jämförelser jämföra alla aktuella substanser med varandra. Fördelen med detta är dels att man kan jämföra substanser för vilka det inte finns någon direkt jämförelse, dels att man får bättre precision i skattningarna. Nackdelen är att en eventuell bias i en jämförelse påverkar alla andra jämförelser. I ett flertal känslighetsanalyser, bl a en med enbart direkta jämförelser, visar TLV att det inte har varit något större problem. Även i Lancet redovisas relativt konsistenta resultat i en analys baserad på enbart direkta jämförelser.
I den mån man försöker sig på jämförelser mellan substanser utifrån Läkemedelsverkets metaanalyser ska man vara medveten om att det rör sig om helt indirekta jämförelser via placebo. Den kritik som vid sådana jämförelser tar fasta på att studierna utförts under tjugo års tid och att placeboresponsen har ökat över tid är dock mindre relevant eftersom responsen på aktiv behandling ökat i samma grad. Ett problem kan vara att studiepopulationerna har förändrats över tid, men det gäller naturligtvis även studierna med aktiva jämförelser.
Slutsats. Läkemedelsverket har i sitt yttrande till TLV inte haft några invändningar mot dess beslut i förmånsfrågan och syftet har här inte varit att ompröva denna inställning. Däremot har vi ansett det viktigt att ge Läkemedelsverkets syn på de diskussioner om val av förstahandsläkemedel för behandling av depression som föranletts av TLV:s metaanalys och metaanalysen i Lancet.
I de här diskuterade analyserna jämförs de mest använda antidepressiva läkemedlen. Ansatserna skiljer sig åt beträffande val av utfallsmått (respons-, remissionsfrekvens, placebojusterad responsfrekvens), kontrollbehandling (placebo, aktiv kontroll) och statistisk metod. De placebokontrollerade studierna i Läkemedelsverkets genomgång är utförda före godkännandet med syftet att visa på en antidepressiv effekt till nytta för patienter som besväras av episoder av egentlig depression. Studierna med direkta jämförelserna mellan olika läkemedel som inkluderats i TLV:s och Lancet-artikelns metaanalyser är till största delen utförda efter godkännandet. De är ofta inte initierade av något primärt vetenskapligt eller kliniskt intresse utan är främst ett inslag i marknadsföringen. Det är osäkert om de tillför något utöver vad som är känt vid godkännandet.
Skillnaden såväl inom som mellan analyserna är relativt små (upp till 5–7 procentenheter) och kan mycket väl vara ett utslag av de potentiella systematiska fel av olika orsaker som har diskuterats ovan och alltid kan förekomma i metaanalyser. Dessa systematiska fel kan inte kontrolleras statistiskt i den meningen att de nödvändigtvis minskar med storleken på metaanalysen.
Mot denna bakgrund finner vi att de skillnader som ses i någon av de här diskuterade metaanalyserna inte är så stora att något bland de mest använda antidepressiva läkemedlen av effektskäl bör rekommenderas som förstahandsalternativ framför de övriga.