Sammanfattat
Endotelceller i tumörkärl uttrycker en rad molekyler som förefaller vara specifika för tumörer, kanske även för just den aktuella tumören, och som inte finns på vanliga endotelceller.
Då endast några få sådana molekyler är kända är det viktigt att försöka finna fler för att använda dem för tumördiagnostik och för att kunna ge specifik och riktad behandling mot kärlen i tumören och därmed mot själva tumören.
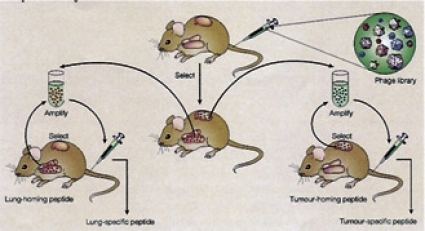
Genmanipulerade fager, dvs enkla virus som inte är patogena för människan, vars yta är dekorerad med slumpvis genererade korta peptider av olika sekvenser, kan användas för detta ändamål. Efter intravenös injektion binder några peptider till komplementära strukturer på endotelcellerna. Därefter kan man identifiera de tumörspecifika kärlmarkörerna.
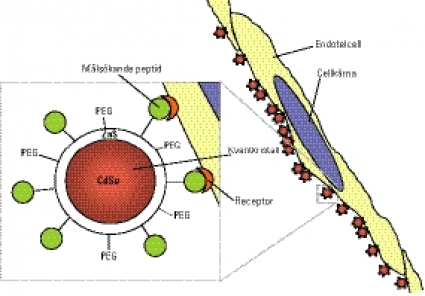
Denna teknik, målsökning eller targeting, är ett nytt sätt att identifiera hittills okända tumörmarkörer i blodkärl. Specifika peptider som konjugerats till nanopartiklar, tex »quantum dots«, ytterst små kulor av halvledarmaterial som på grund av optiska egenskaper kan lokaliseras med ultraviolett ljus, kan användas för diagnostik. Cytostatika kan kopplas till de målsökande peptiderna och på så sätt användas för att ge riktad tumörbehandling.
Angiogenes betyder nybildning av kärl. Det sker fysiologiskt i kroppen, dels när själva kärlträdet blir till hos embryot (vaskulogenes), dels då kroppen behöver nya kärl, tex vid tillväxt, sårläkning och menstruation [1]. När en vävnads behov av syre och näring ökar startar angiogenesen. Så sker vid klassiska ischemiska sjukdomar som claudicatio, infarkt och stroke men även vid andra patologiska tillstånd som diabetesretinopati, obstruktiv lungsjukdom och reumatoid artrit [2, 3]. Blodkärl är nödvändiga för cellers ämnesomsättning, och celler längre bort än 100–200 µm från blodkärl blir hypoxiska och dör [4]. Detta gör angiogenes till en förutsättning även för tumörtillväxt, då tumörceller också behöver näring för att överleva. Därför är intresset stort för att påverka angiogenesen, antingen öka den vid ischemiska tillstånd eller minska den vid tex cancer.
Det finns flera principiellt olika sätt att hämma angiogenesen. Man kan använda antikroppar eller farmaka mot tillväxtfaktorer och deras receptorer eller mot signalkopplingsproteiner, tex tyrosinkinaser. Proliferation av endotelceller kan hämmas även på andra sätt, tex med antikroppar eller små molekyler som binder och blockerar endotelcellernas förankringsproteiner, främst integriner [4]. Ett tredje sätt är att använda proteashämmare, som förhindrar den nedbrytning av extracellulär matrix som behövs för att utväxande kärl ska få plats. För mer information om angiogenes och hur man hämmar den hänvisar vi till översiktsartiklar [1, 2, 4, 5].
Minst 20 angiogenetiska inhibitorer (här kallade angiostatika) är nu under klinisk prövning. Målet är att man ska använda dessa läkemedel antingen ensamma eller (och det är troligare) som komplement till sedvanlig kemoterapi. Tanken är att tumörkärl är lättare att angripa med angiostatiska medel, eftersom endotelceller är genetiskt stabila, till skillnad från tumörceller. Det är då mindre risk för den resistensutveckling gentemot läkemedel som man ser hos de genetiskt instabila tumörcellerna [6]. Biverkningar av angiostatika är också få, och man slipper kemoterapins allvarliga sidoeffekter, tex benmärgsdepression, gastrointestinala besvär och håravfall [7].
Angiostatisk behandling är dock inte utan sina egna svårigheter. En sådan är att cancerkärl som täcks av pericyter kan vara mer svårbehandlade, eftersom de är färdigbildade [8]. Ju »mognare« ett kärl är i sin uppbyggnad, mätt som hög grad av pericytbeklädning, desto svårare kan det bli att påverka kärlet med angiostatisk behandling. Det är också möjligt att tumörer kan selektera fram maligna celler som är mindre beroende av ett fungerande kärlträd, dvs de tolererar hypoxi bättre [9]. För översikt av pågående kliniska prövningar med angiostatiska medel, se National Cancer Institute [10].
För att angiostatisk behandling ska lyckas måste vi öka vår kunskap om de molekyler som uttrycks på de endotelceller som befinner sig i en tumör och som därför är mer eller mindre specifika för just tumörkärl. Idag känner vi till endast ett fåtal sådana markörer.
En helt ny metod att hitta sådana molekyler på tumörkärl, målsökning eller targeting, har öppnat dörren för nya metoder att hitta och behandla tumörer och metastaser. Då målsökning/targeting representerar ett nytt sätt att lösa komplexa biologiska problem vill vi presentera principen här.
Principen är att märka ut mål
Vid angiogenes uttrycks under begränsad tid vissa markörer på endotelceller och pericyter. Dessa markörer är ofta tillväxtfaktorer och deras receptorer, eller celladhesionsmolekyler, och tillhörande ligander. Ett nytt sätt att leta efter dem är att använda korta och slumpmässigt konstruerade peptider, uttryckta på ytan av bakteriofager (fortsättningsvis kallade fager). Man talar ofta om att fagens yta är dekorerad med en peptid. En samling av fager, var och en med en unik peptid på ytan, kallas ett fagbibliotek (från engelskans phage display library). När de sprutas in intravenöst söker de sig via blodströmmen till sina mål och fäster om de hittar en komplementär peptidsekvens. Peptiden på fagens yta kan sedan identifieras. Framsteg har under senare tid gjorts för att dels konstruera slumpmässiga peptidbibliotek, dels förbättra screeningmetoderna, dvs metoder att hitta en unikt dekorerad fag i biblioteket eller i vävnaderna [11].
Detta uppsökande av »vaskulära mål och adresser«, targeting, kan i framtiden komma att användas dels i diagnostiskt syfte, dvs för att lokalisera en tumör eller metastaser, dels för behandling där läkemedel kan ackumuleras i tumören. På så sätt får behandlingen en mer lokal effekt i tumören, och resten av kroppen skonas [12].
Fager och fagbibliotek
En fag är ett mycket enkelt virus med färre än ett dussin gener. Den infekterar och förökar sig endast i vissa bakteriestammar och är således inte direkt patogen för människan. Genom genetisk manipulation av fagers arvsmassa kan man få fagen att producera peptider eller antikroppar, som uttrycks på fagens yta.
Det första peptidbiblioteket konstruerades för att hitta bindningsställen på isolerade immunglobuliner, men samma teknik har använts för att hitta peptider för andra receptorer (celladhesionsmolekyler, proteaser, cellcykelregulatorer, onkoproteiner, tumörsuppressorproteiner mfl) [11]. Dessa fagburna peptidbibliotek har givit helt nya möjligheter att studera angiogenes och andra aspekter av vaskulär mångfald. Även andra typer av bibliotek används enligt samma princip men med lite olika teknik, tex fagbibliotek som uttrycker antikroppar [13] och s k bakteriodisplaybibliotek [14]. För ytterligare information hänvisas till Dyax Corporation [15].
Dirigera läkemedel rätt
Målsökande peptider kan användas även för behandling, som bärare av farmaka. Cytostatika som kopplas ihop med den målsökande peptiden kan dirigeras till och ackumuleras i tumören och verka lokalt, med minimal påverkan på resten av kroppen [12]. In vivo-studier på möss har genomförts där kemoterapeutiska substanser har kopplats till uppsökande peptider och visats reducera tumörtillväxt och förlänga överlevnaden [16-19].
Ett exempel är peptiden RGD-4C, som selektivt binder till adhesionsmolekylerna anb3 och anb5. Dessa adhesionsmolekyler kallas för integriner och uttrycks i särskilt stor mängd i tumörkärl [20]. Integriner hjälper celler att haka i varandra vid tillväxt. De är inte bara markörer för angiogenes utan också funktionellt viktiga i angiogenesprocessen [12]. När RDG-4C kopplades till doxorubicin, ett vanligt cytostatikum, förstärktes anticancereffekten och toxiciteten sjönk jämfört med vid konventionellt tillfört doxorubicin [16].
Forskning bedrivs också om hur man med hjälp av målsökning kan få radioaktiva komponenter och gener att dirigeras in i cellen med hjälp av internaliserade receptorer och orsaka skada inifrån [12]. Som exempel kan nämnas F3, en peptid som söker sig direkt till cellkärnan i tumörendotelceller, vilket gör den mycket intressant i forskning om cytostatikaleverans in i cellkärnan men även i genterapiforskning [21]. F3 binder sig även till nukleolin på cellytan [22]. Vi vet inte hur många målmolekyler som finns på människans kärl [23]. De flesta försök har gjorts på djur. Dock har ett försök med målsökning hittills rapporterats ha utförts på en människa. Ett slumpmässigt peptidbibliotek sprutades in hos en terminalt sjuk patient, och efter 15 minuter togs vävnadsbiopsier för att kunna påvisa fager i olika organ. Försöket antyder att interleukin-11-receptorn är en prostataspecifik kärlreceptor [24].
Ett annat sätt att målsöka tumörkärl är att dirigera den tumörnekrotiska faktorn TNF eller melfalan, kopplat till en antikropp, som binder till kärlets fibronektin [25]. Slutligen har man använt sk proteomik, som kan påvisa nya peptider i isolerade celler eller vävnader.
Avbildning med högre precision
Ett mål är att avbilda tumörer och metastaser radiologiskt, med högre precision än vad som är möjligt idag, med hjälp av uppsökande peptider. Ett försök är rapporterat, där radioaktivt märkta RGD-innehållande peptider binder till anb3-integriner [26]. Dessa kan sedan lokaliseras med hjälp av gammakamera. Med denna teknik skulle primärtumör och metastaser (innehållande anb3-integriner) kunna påvisas på ett mycket tidigt stadium. Man skulle också kunna följa effekten av angiostatisk terapi.
Nanopartiklar
Målsökande peptider kan även användas till att bära nanopartiklar, dvs partiklar i nanostorlek (10 nm i diameter). Som bevis på att detta fungerar kopplades peptider till ytan på »quantum dots«, ytterst små kulor av halvledarmaterial. Dessa kulor har unika optiska egenskaper, tex stark luminiscens som kan ställas in på önskad våglängd som svar på ultraviolett ljus. Därmed kan partiklarna lokaliseras, vare sig det är i en biopsi eller i ett helt organ eller i en individ. Det lyser där de fastnat! Några av de peptider som används vid denna teknik är GFE, som binder sig specifikt till lungendotel, ovan nämnda F3, som binder till angiogenetiska endotelceller och olika typer av tumörceller [21], och LyP-1, som fäster vid lymfendotel i tumörer [27] (Figur 2).
Målsökning har även kombinerats med genterapi. Det visades i ett experiment där man fäste en gen med angiostatisk effekt på nanopartiklar, som via en fagpeptid band till anb3-integriner på tumörkärl [28]. På så sätt kunde man dirigera genterapin till just det kärl man ville nå och koncentrera behandlingen mångfalt.
Konklusion
Principen att det går att behandla cancer med angiostatisk terapi har nyligen bevisats. En antikropp riktad mot tillväxtfaktorn vascular endothelial growth factor (VEGF) hämmade tillväxten av metastaserande njurcancer och koloncancer [29, 30]. Amerikanska Food and Drug Administration (FDA) har godkänt denna antikropp för cancerbehandling.
En annan användning av målsökande teknologi har nyligen lanserats. Med hjälp av ett fagbibliotek identifierades endotel i fettväv. Till denna peptid kopplade man därefter på en apoptosbefrämjande peptid. När peptidkomplexet injicerades på djur magrade de rejält! Det förefaller som om denna form av målsökning av kärl i fettväv kan användas som ny bantningsmetod – i alla fall för möss [31].
Arbete pågår nu för att hitta molekylära profiler vid andra sjukdomar än cancer och som kan nås via blodströmmen, tex autoimmuna tillstånd och ateroskleros. Målet är att i den vaskulära molekylära mångfalden hitta markörer i kärl, vaskulära adresser, för framtida förbättringar av diagnostik och behandling.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.