Sammanfattat
GLP-1 (glukagonlik peptid 1) är ett inkretinhormon som frisätts vid varje måltid.
GLP-1 stimulerar insulinsekretionen, hämmar glukagonsekretionen, förlångsammar ventrikeltömningen och ger mättnadskänsla.
Sammantaget har GLP-1 en glukossänkande effekt.
GLP-1 sänker blodglukos och HbA1c när det ges till patienter med typ 2-diabetes. Risken för hypoglykemi är mycket liten.
GLP-1 bryts snabbt och effektivt ned av enzymet dipeptidylpeptidas 4 (DPP-4); halveringstiden för hormonet är 2 minuter.
Två strategier har utvecklats för att kliniskt kunna utnyttja den goda effekten av GLP-1: dels GLP-1-receptoragonister som har lång halveringstid genom att vara resistenta mot DPP-4, dels DPP-4-hämmare som leder till förlängning av halveringstiden av endogent frisatt GLP-1.
Substanser utvecklade ur båda dessa strategier är idag föremål för kliniska studier på fas 3-nivå.
Under flera år har preklinisk, experimentell och klinisk forskning studerat en ny typ av farmakologisk behandling av typ 2-diabetes. Denna behandling bygger på tarmhormonet glukagonlik peptid 1 (GLP-1) och dess potenta effekter, vilka sammantagna sänker blodsockret. I denna artikel sammanfattas de bakomliggande experimentella och de inledande kliniska studierna.
GLP-1 är ett inkretinhormon. Ett sådant hormon frisätts från tarmen i samband med måltid och stimulerar insulinsekretionen. Inkretinkonceptet introducerades redan år 1929 [1]. Då det började vara möjligt att mäta insulin kunde man på 1960-talet visa att intag av glukos oralt eller genom tarmsond leder till kraftig ökning av insulinnivån i plasma som tecken på stimulerad insulinsekretion. Däremot ökar intravenöst givet glukos insulinnivån i mindre grad, trots att glukosnivån i det fallet ökar till högre nivåer [2, 3].
Skillnaden förklaras av de frisatta inkretinerna, som stimulerar insulinsekretionen. Mer än 70 procent av insulinstegringen efter tillförsel av oralt glukos förklaras av andra faktorer än förhöjt blodglukos [4]. Idag menar man att det är GLP-1 tillsammans med GIP (glukosberoende insulinfrisättande peptid) som är de viktiga inkretinhormonerna [5]. Vid typ 2-diabetes är denna inkretineffekt nedsatt [4]. Detta beror på att frisättningen av GLP-1 är nedsatt vid diabetes [6] och att GIPs insulinfrisättande effekt synes vara defekt vid diabetes [7].
Hormonets struktur och effekter
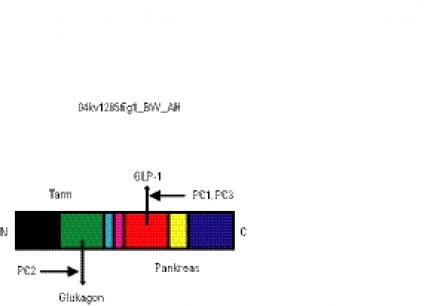
GLP-1 beskrevs 1982. Hormonet är en produkt av proglukagon i L-cellerna i tarmen [8]. Proglukagon uttrycks både i tarmens L-celler och i pankreasöarnas alfaceller men processas olika i dessa celler. Sålunda är det GLP-1 som är produkten av proglukagon i tarmen, medan det är glukagon som är produkten i pankreasöarna [9]. Denna skillnad beror på väv-nadsspecifikt uttryck av en enzymfamilj kallad prokonvertas (PC). PC1 och PC3 uttrycks i L-cellerna i tarmen, medan PC2 uttrycks i alfacellerna i pankreasöarna. Under inverkan av dessa prokonvertas spjälkas proglukagon till sina respektive slutprodukter. Detta visas schematiskt i Figur 1. GLP-1 är en peptid med 30 aminosyror. Hälften av dessa är identiska med sekvensen i glukagon. Härav har GLP-1 fått sitt namn: glukagonlik peptid.
GLP-1 frisätts från tarmen till blodbanan efter måltid. En huvudeffekt av GLP-1 är att stimulera insulinsekretionen. Detta sker främst genom aktivering av en G-proteinkopplad receptor på betacellerna. Delvis sker denna effekt även genom att GLP-1 aktiverar nerver, som i sin tur stimulerar insulinsekretionen [10, 11]. Den insulinsekretionsstimulerande effekten av GLP-1 visades först av Holst och medarbetare i perfunderad grispankreas. De fann att GLP-1 är extremt potent att utöva denna effekt samtidigt som effekten är glukosberoende [12]. Denna effekt påvisades tidigt även i djurexperimentella försök in vivo [13]. I början av 1990-talet visades också att GLP-1 kan utöva en direkteffekt på pankreasöarna, vilken medieras av cykliskt AMP och intracellulärt kalcium [14, 15]. Ett viktigt fynd är att effekten är glukosberoende. Detta betyder att risken för hypoglykemi är liten då en patient behandlas med GLP-1.
Nyare djurexperimentella studier har visat att GLP-1 har mer djupgående effekter på betacellerna i pankreasöarna än att stimulera insulinsekretionen. Sålunda stimuleras såväl uttrycket av insulingenen som insulinsyntesen; även bildning av nya betaceller stimuleras samtidigt som apoptos (programmerad celldöd) hämmas. Sammantaget leder detta till att antalet betaceller ökar [16]. Det bör dock poängteras att dessa fynd endast har påvisats i djurexperimentella studier och i humana pankreasöar [17], men inte i kliniska studier. Om GLP-1 emellertid visas öka betacellsmassan i kliniska studier hos människa har GLP-1 två effekter som riktar sig direkt mot de viktiga defekterna i pankreasöarna vid diabetessjukdomen: minskad betacellsmassa och minskad insulinsekretion.
Även på människa har GLP-1 visats ha potent insulinfrisättande effekt, då administration av peptiden ger en potent glukosberoende stimulering av insulinsekretionen [18-21]. Denna effekt är av stor fysiologisk relevans i samband med födointag, vilket visats genom att insulinfrisättningen efter tillförsel av oralt glukos hämmas av en GLP-1-receptorantagonist [22]. I djurexperimentella studier har också visats att möss med genetisk deletion av GLP-1-receptorn har nedsatt glukostolerans till följd av nedsatt insulinsekretion [23].
Vid typ 2-diabetes är glukagonnivån ofta förhöjd. Detta beror på att glukagonsekretionen från alfacellerna i pankreasöarna är ökad. En viktig reglermekanism av glukagonsekretionen är att denna supprimeras av den förhöjda glukosnivån. Vid diabetes däremot, liksom vid nedsatt glukostolerans, är denna effekt av glukos nedsatt, varigenom glukagonnivån är oproportionerligt hög [24]. Detta underhåller hyperglykemin, eftersom glukagon ökar glukosfrisättningen från levern. En viktig funktion av GLP-1 är att hämma glukagonsekretionen. Detta har visats i perfunderad grispankreas, in vivo på djur och efter exogen administration till människa [12, 13, 25]. Effekten av GLP-1 att inte bara öka insulinsekretionen utan även hämma glukagonsekretionen innebär sålunda att GLP-1 förmår normalisera hela ö-funktionen vid diabetes, inte enbart betacellsdefekten.
GLP-1 har även visats ha ytterligare effekter av potentiellt värde vid behandling av typ 2-diabetes. Sålunda har GLP-1 visats förlångsamma magsäckstömningen och stimulera mättnadskänslan [26-31]. Den första effekten innebär att efter en måltid blir glukosstegringen förlångsammad om GLP-1-nivån är förhöjd. Den andra effekten innebär att födointaget blir mindre, vilket kan sänka kroppsvikten på sikt.
GLP-1-receptorn uttrycks dessutom i ett flertal andra organ, såsom centrala nervsystemet, lunga, njurar och hjärta. GLP-1-bindning sker även till muskel, fettväv och lever. En centralnervös effekt av GLP-1 kan förklara den aptitnedsättande effekten, liksom också delvis den ökade insulinsekretionen [10, 11].
Intressant är även att GLP-1 har visats öka insulinkänsligheten. Detta är viktigt, eftersom insulinresistens är en viktig faktor för utveckling av typ 2-diabetes. Denna effekt av GLP-1 kan vara en direkteffekt på perifera målorgan för insulin, men den kan också vara en indirekt effekt till följd av sänkt glukosnivå. Nyligen har också visats att GLP-1-receptorn uttrycks i endotelceller och att GLP-1 kan förbättra endotelfunktionen hos patienter med diabetes [32].
Antidiabetisk effekt
GLP-1 har således flera olika effekter, vilka sammantagna är av värde vid behandling av diabetes (Fakta 1). En inledande studie som visade möjligheten att använda GLP-1 i diabetesbehandling utfördes i slutet av 1980-talet. Patienter med typ2-diabetes erhöll en intravenös infusion av GLP-1 tillsammans med en måltid. Därvid erhölls en antidiabetisk effekt. Denna studie redovisades vid den europeiska diabeteskongressen i Köpenhamn 1990 [33] och publicerades i artikelform 1992 [34].
Fortsatta studier på 1990-talet visade i olika patientgrupper och under olika betingelser att såväl intravenöst som subkutant eller buckalt givet GLP-1 verkligen är antidiabetogent [35-38]. År 2002 undersöktes långtidseffekt av subkutant givet GLP-1-dropp hos patienter med typ 2-diabetes. Man fann att GLP-1 hade en potent glukossänkande effekt. Sålunda hade efter 6 veckors behandling HbA1c sjunkit från 9,2 till 7,9 procent samtidigt som blodglukosnivån under dygnet sjunkit markant [39]. Studien visade också att GLP-1 efter 6 veckor hade förbättrat insulinsekretionen, minskat insulinresistensen, minskat nivån av fria fettsyror och givit en viktnedgång (cirka 2 kg).
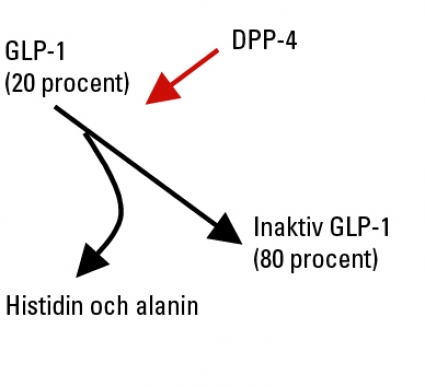
Ett grundläggande problem vid utvecklingen av GLP-1 i diabetesbehandlingen har varit att GLP-1 inaktiveras mycket snabbt i blodbanan. Detta beror på enzymet dipeptidylpeptidas 4 (DPP-4), som spjälkar de två N-terminala aminosyrorna från resten av GLP-1. Detta i sin tur medför att peptiden blir inaktiv (Figur 2). DPP-4 upptäcktes redan 1966 och är vitt spritt i kroppen med särskilt stor förekomst i lever och njurar [40]. Av stort intresse är att DPP-4 bildas i endotelceller och uttrycks på cellytan av dessa celler med sin katalytiska del inskjutande i blodbanan. Vidare har det visats att det finns en löslig, cirkulerande form av DPP-4. Därigenom kan enzymet attackera cirkulerande peptider.
Peptider med aminosyran alanin i position 2 räknat från den N-terminala änden (som GLP-1) kan klyvas av DPP-4 genom att de två N-terminala aminosyrorna spjälkas från. För GLP-1:s del innebär det en inaktivering, eftersom den kvarvarande delen av GLP-1 är inaktiv [41]. DPP-4 är mycket potent, vilket medför att halveringstiden för GLP-1 är 2 minuter. Detta medför också att under normala betingelser är aktiv GLP-1 endast cirka 20 procent av den totala plasmapoolen av GLP-1. Initialt visades detta för människa i studier av Deacon och medarbetare 1995 [42]. I en översiktsartikel från 1998 utvecklades betydelsen av detta för diabetesbehandling med GLP-1 [43].
GLP-1-baserad diabetesterapi
För att använda den potentiellt mycket framgångsrika GLP-1-baserade terapin i praktiken har två strategier utvecklats, vilka undanröjer den snabba nedbrytningen med DPP-4 (Fakta 2).
I den första strategin utvecklas GLP-1-receptoragonister (sk GLP-1-mimetika). Dessa är resistenta mot DPP-4 och har en halveringstid som är praktiskt hanterbar i en klinisk situation. Den andra strategin tar sikte på att hämma enzymet DPP-4 för att därigenom förlänga halveringstiden av endogent frisatt GLP-1.
Receptoragonister. I Sydamerika och i sydvästra USA finns ödlan Gila monster som i sin spottkörtel har toxiner, som är dödande för djur och människor som blir bitna. Genom forskning för att klarlägga dessa toxiner har en peptid identifierats, vilken fått namnet exendin 4. Denna peptid har en cirka 50-procentig strukturlikhet med GLP-1. Den har visats vara en GLP-1-receptoragonist med insulinfrisättande effekt även hos människa [44]. Varför ödlan har denna peptid i sin spottkörtel vet man inte. Peptiden är inte ödlans GLP-1, eftersom ödlan har ett GLP-1 i tarmen som har mycket stor strukturlikhet med människans GLP-1. Exendin 4 bryts inte ned av DPP-4.
Exendin 4 tillverkas numera som rekombinant peptid och har fått namnet exenatid. Den kan administreras subkutant 2 gånger per dag för att resultera i en blodsockersänkande effekt hos människa. Det görs även försök på en långverkande form av exenatid, vilken kan ha effekt under flera dagar/veckor.
Kliniska studier har visat att exenatid kan utvecklas till en tänkbar framtida diabetesbehandling. Den har visats ha god effekt på glukosmetabolismen. Sålunda har man visat att exenatid givet till patienter med HbA1c på cirka 8 procent sänker HbA1c-nivån med 0,8 procent redan efter 4 veckor. Detta sker parallellt med sänkning av de postprandiala glukosnivåerna [45].
Nyare studier har undersökt exenatid även under längre tidsperioder, upp till 1 år, med fortsatt mycket god effekt. Sänkningen av HbA1c-nivåerna är cirka 1 procent. Detta erhålls samtidigt med progredierande viktnedgång, cirka 3 kg efter 1 år. Dessutom är risken för hypoglykemi liten [46-48].
En biverkan vid behandling med exenatid är illamående, vilket upp till 30 procent av patienterna erfarit vid genomförda studier. Detta illamående synes emellertid vara övergående och av mild typ. Även antikroppar mot exenatid bildas hos en viss andel av patienterna, men dessa antikroppar synes sakna klinisk relevans.
Hypoglykemi är sällsynt som biverkan vid behandling med exenatid, liksom vid all GLP-1-baserad terapi, vilket är förklarligt eftersom effekterna av GLP-1 är glukosberoende.
En annan GLP-1-receptoragonist är liraglutid. I liraglutid har en aminosyra i GLP-1 bytts ut, och GLP-1 har dessutom försetts med en fettsyra. Denna fettsyra förhindrar att DPP-4 har effekt på liraglutid samtidigt som substansen blir albuminbunden. Härigenom kvarstår GLP-1-effekten under lång tid, eftersom liraglutid har lång halveringstid. Liraglutid kan ges subkutant 1 gång per dag med god glukossänkande effekt. Den har visats ha mycket bra antidiabetisk effekt under studier upp till 12 veckor [49-52]. Sålunda sänks HbA1c och glukosnivåerna övertygande av liraglutid, och detta sker samtidigt som risken för hypoglykemi är mycket liten. Liksom för exenatid är lindrigt, övergående illamående enda dominerande biverkan.
Både exenatid och liraglutid undersöks nu i stora kliniska studier. Ytterligare GLP-1-analoger, vilka är GLP-1-receptoragonister, är under utveckling. Exempelvis har en analog skapats där GLP-1 binds till albumin, vilket ger en mycket lång halveringstid, upp mot 10 dagar; denna analog, kallad CJC-1131, har i prekliniska försök visats vara antidiabetisk [53].
Enzymhämmare. Den andra huvudstrategin för GLP-1-baserad terapi är att hämma enzymet DPP-4 och därigenom minska inaktivering av kroppseget frisatt GLP-1. Ett underlag för denna idé är att möss som genetiskt saknar DPP-4 har förbättrad glukostolerans genom ökad sekretion av insulin i samband med måltid [54]. Redan under 1990-talet och början av 2000-talet visades att denna strategi är framgångsrik i prekliniska försök genom användande av farmakologiska DPP-4-hämmare [55-59].
I början av 2000-talet visades att konceptet fungerar även på människa. DPP-4-hämning med tablett en eller flera gånger dagligen under 4 veckor med två olika DPP-4-hämmare (NVP-DPP728 och LAF237) visades ha god antidiabetisk effekt. Sålunda sänktes glukosnivåerna, och samtidigt sågs sänkning av HbA1c-nivån med cirka 0,3–0,5 procent trots att studiernas längd endast var 4 veckor [60, 61]. Biverkningar var mycket få.
Nyligen har visats att en DPP-4-hämmare (LAF237, numera kallad vildagliptin) har god effekt i behandlingsstudier upp till 1 år med sänkning av HbA1c med 1 procent [62, 63]. Mekanistiskt har visats att LAF237, som förväntat, ökar koncentrationen av aktivt GLP-1, vilket leder till sänkta glukagonnivåer efter måltid och stimulerad insulinsekretion [61]. Även en annan DPP-4-hämmare (MK-0431) har visats ha framgångsrik antidiabetisk effekt [64]. Båda dessa hämmare studeras nu i kliniska studier.
En initial oro vid utveckling av DPP-4-hämmare var att biverkningsrisken skulle vara hög, eftersom DPP-4 inaktiverar ett stort antal peptider, såsom GLP-2, IGF-1, substans P och flera cytokiner [40]. Emellertid har hittillsvarande studier visat att biverkningsfrekvensen är mycket låg vid användande av DPP-4-hämmare. Detta kan förklaras av att dessa övriga peptider bryts ned även av andra enzymsystem, som övertar DPP-4:s roll.
En annan förklaring till den låga biverkningsförekomsten är att hämningen av DPP-4 inte är så komplett att inaktivering av dessa peptider helt motverkas. Längre tids studier är emellertid nödvändiga för att slutligt kartlägga om DPP-4-hämmare har några biverkningar.
Båda huvudstrategierna av GLP-1-baserad terapi har således visats ha god antidiabetisk effekt även efter långtidsbehandling. Det finns likheter och skillnader mellan dessa båda strategier, vilket framgår av Tabell I. Vilken strategi som kommer att bli mest användbar får framtiden utvisa. Den viktigaste faktorn för val av strategi blir den effektivitet som strategierna kan ge på lång sikt.
Den effektivitet mätt som sänkning av HbA1c som hittills framkommit är likartad mellan de båda strategierna. Jämfört med placebo sänks HbA1c således ungefär 1 procent under cirka 1 års tid vid behandling av patienter med mild sjukdom med utgångs-HbA1c omkring 7–8 procent, vilket är att betrakta som god effektivitet. Till skillnad från den mycket goda effekten på glukosmetabol reglering, främst i form av sänkning av HbA1c, har GLP-1-baserad terapi endast haft marginella effekter på blodlipider. Det skall dock noteras att direkta effekter av GLP-1 på lipidmetabolismen ännu inte genomförts. Fortsatta studier av effekten av GLP-1 på lipidmetabolismen är därför viktiga.
Preklinisk, experimentell och klinisk forskning i samverkan
Sammantaget har experimentella och kliniska studier av GLP-1-baserad terapi visat sig så framgångsrik att intresset vuxit. Idag har många läkemedelsföretag inom diabetesområdet stort intresse inom detta område. Orsaken till detta är, förutom de framgångsrika kliniska studierna, även den teoretiska underbyggnaden att GLP-1 har grundläggande antidiabetiska effekter och till och med kan påverka diabetessjukdomens orsaker.
Teoretiskt kan GLP-1-baserad terapi tänkas vara indicerad i tidigt skede av sjukdomsutvecklingen. Behandlingen kan därvid tänkas vara monoterapi eller kombinationsterapi med behandling som ökar insulinkänsligheten (metformin, tiazolidindioner).
Behandlingen kan emellertid vara av värde även i sent skede av sjukdomen. I sådana fall kan grundläggande betacellseffekter (hämning av apoptos, stimulering av insulinsyntes) utnyttjas. Förutsättning för detta resonemang är emellertid att dessa effekter även sker hos människa, vilket ännu inte visats. I dessa fall kan GLP-1-baserad terapi även vara komplement till insulinbehandling.
Vad som från forskningssynpunkt är värt att notera är att GLP-1-baserad terapi är frukten av mångårig forskning där samverkan mellan preklinisk, experimentell och klinisk forskning varit ledstjärnan. Detta framgår av Fakta 3, där de viktiga linjerna bakom utvecklingen av denna nya behandlingsstrategi sammanfattas.
*
Potentiella bindningar eller jävsförhållanden: Författaren har deltagit i en multicenterstudie av en hämmare av enzymet dipeptidylpeptidas-4 (LAF237), vilken bekostats av Novartis.