Sammanfattat
Cancer utan känd primärtumör, CUP, är förhållandevis vanligt med ca 1700 nya fall per år i Sverige.
Utredning skall innefatta adekvat tumörmaterialprovtagning för PAD samt DT torax–buk.
Prognosen är överlag dålig, men det finns undergrupper som har möjlighet till lång överlevnad, och några patienter kan till och med botas.
Om patienterna inte tillhör dessa undergrupper bör utredning samt behandling ställas i relation till möjlig patientnytta.
Ett stort antal cancerpatienter debuterar med metastasering, och trots omfattande utredning förblir åtskilliga tumörers primärursprung aldrig kända [1]. Terminologin har under åren varierat för okänd primärtumör, men internationellt har uttrycket CUP (carcinoma of unknown primary) blivit vedertaget [2]. CUP definieras således som metastatisk cancer där primärtumörens ursprung inte går att fastställa trots standardiserad utredning.
CUP är en mycket heterogen grupp av cancersjukdomar som ofta är frustrerande för såväl läkare som patient och som inte sällan leder till ett föga fruktbart, långdraget och dyrbart letande efter en primärtumör.
I litteraturen är CUP relativt väl beskrivet, men evidensgraden för olika åtgärder är ofta låg, och antalet robusta prospektiva, randomiserade studier är litet. »State-of-the art« avseende CUP jämfört med flertalet andra vanliga cancerdiagnoser baseras betydligt oftare på empiri, analogiresonemang och slutsatser från fas II-studier.
Denna artikel syftar till att förmedla en översikt över de kliniskt viktigaste aspekterna av CUP, med betoning på diagnostik och behandling.
CUP – en av de vanligare cancersjukdomarna
CUP är ingen raritet utan tvärtom ett ganska vanligt tillstånd som uppges utgöra ca 3–5 procent av all cancer [2-11]. Detta innebär att CUP är en av de vanligare cancersjukdomarna, och enligt cancerregistret 2003 rapporteras ca 1700 nya fall årligen i Sverige. CUP hamnar därför på sjunde plats på listan över de vanligaste cancerdiagnoserna [12]. Det föreligger troligtvis dessutom underrapportering, då osäkra diagnoser ofta räknas in bland andra cancersjukdomar.
Medianåldern vid diagnos är ca 60 år bland patienter inkluderade i studier, men enligt populationsbaserade data från två europeiska register är medianåldern ca 70 år [2]. Sjukdomen är marginellt vanligare bland män, och CUP bland barn är mycket ovanligt [11, 13].
Orsaken till fenomenet CUP kan man endast spekulera om. En möjlighet är att primärtumören genomgår spontanregress alternativt att primärtumören finns men är så liten att den gäckar rutindiagnostiken. Andra orsaker skulle kunna vara att tumören uppstått på en »metastatisk plats« eller att primärtumören har avlägsnats långt före CUP-diagnosen (t ex nevus/melanom).
Lokalisationen av CUP vid diagnos är i 75 procent av fallen under diafragma. Vid diagnos har CUP-patienterna ofta generella symtom som anorexi, viktnedgång och trötthet. Multipla metastaser är vanligast, men vid diagnos har ca 40 procent av patienterna endast en metastaslokal efter konventionell utredning [14].
Under det fortsatta sjukdomsförloppet kan endast ca 15 procent av patienterna tilldelas specifik cancerdiagnos och vid obduktion ca 75 procent [15]. Av dessa diagnoser svarar lung- och pankreascancer för 20 procent vardera, följt av övrig GI(gastrointestinal)-cancer, ovarial- och njurcancer (5–10 procent vardera).
Metastasmönstret vid CUP med fastställd primärtumör är ofta atypiskt. Pankreascancer är således oftare spridd till skelettet, prostatacancer har oftare visceralt engagemang, och vid lungcancer är skelettmetastaser mer ovanliga [16].
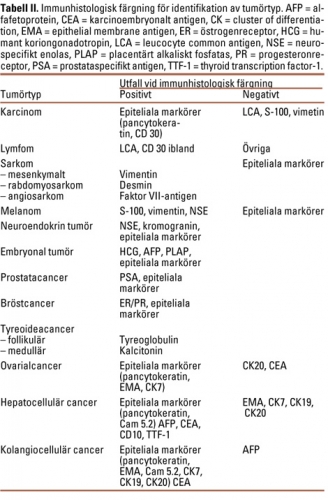
Histopatologiskt är adenokarcinom i särklass vanligast, varav de flesta är högt eller medelhögt differentierade. Skivepitelcancer och odifferentierad cancer är ovanligare (Tabell I). Efter ytterligare histopatologiska specialanalyser kan specifik undergrupp fastställas i ca 15 procent av fallen (Tabell II) [17].
Patientfall 1
En tidigare frisk, icke rökande 68-årig skogsarbetare sökte vårdcentral för en 5 cm stor tumör i vänster axill. Patienten remitterades till ett länssjukhus, och tumören exstirperades radikalt. PAD visade lymfkörtel infiltrerad med lågt differentierad skivepitelcancer, som var starkt positiv för cytokeratin 5 och 6 samt pankeratin. Tumören var dock helt negativ för cytokeratin 7, 14, PSA, S100 och östrogen- och progesteronreceptor. Varken serum-PSA eller CA 15-3 var förhöjda.
Postoperativt utreddes patienten med DT torax–buk, gastroskopi, koloskopi, crista-biopsi, bronkoskopi samt endoskopi i narkos av övre luftvägar med bilateral tonsillektomi. Samtliga undersökningar var normala.
Patienten var välmående ett år efter diagnos och hade inte några nya tumörmanifestationer. I efterhand kan man givetvis vara efterklok och bedöma att utredningen här har varit alltför omfattande med stora kostnader, vilket tagit betydande sjukvårdsresurser i anspråk. En något annorlunda utredning skulle kunna ha varit en PET-undersökning och andra, utifrån den riktade, undersökningar.
Patientfall 2
En 52-årig kvinna sökte för obehag i höger bröst, och palpatoriskt fann man endast viss svullnad. Mammografi och ultraljud visade inget anmärkningsvärt. Ultraljudsundersökning av höger axill visade en 36 mm stor lymfkörtel. Fluorodeoxiglukos(FDG)-PET-undersökning visade tydligt metabolt upptag i bröstet samt upptag i höger axill men inga tecken på fjärrmetastaser (Figur 1A och B). Biopsier från axill och bröstet visade invasiv duktal cancer. Patienten inkluderades i en neoadjuvant cytostatikastudie, där man utförde lungröntgen, ultraljud lever och skelettskintigrafi utan några patologiska fynd. Detta var således ett fall som presenterade sig som CUP, men med hjälp av modern diagnostik erhölls en specifik tumördiagnos.
Utredning
Grundprincipen är att utifrån anamnes, status, metastaslokalens läge (Tabell III) och histopatologisk undersökning av tumörvävnad rikta diagnostiska insatser för att fastställa primärtumör och behandlingsbara tillstånd [2]. Nedan ges rekommendationer avseende utredning och behandling som baseras på riktlinjer från ESMO (European Society of Medical Oncology), övrig litteratur inom området samt klinisk erfarenhet.
Utredningens viktigaste komponent är en grundlig histopatologisk undersökning av tumörmaterialet. Vad gäller övrig utredning bör den alltid ställas i relation till möjliga vinster. Därför skall man ha en ärlig och uppriktig kommunikation med patient och anhöriga om utredningsplanen med eventuell efterföljande behandling. Då prognosen i många fall är dyster och patienterna ofta är gamla med nedsatt allmäntillstånd kan man ibland överväga att helt avstå från ytterligare utredning och behandling.
Noggrann anamnes och status
Anamnes och status bör vara ambitiösare än vanligt med
speciellt riktade frågor angående tidigare genomgången kirurgi (tex nevus) och tidigare/nuvarande sjukdomar (tex inflammatorisk tarmsjukdom, infektioner). Även cancerhereditet och levnadsmönster bör efterfrågas, tex tobaks- och alkoholkonsumtion, etniskt ursprung, yrke och screeningföljsamhet.
I somatiskt status bör man särskilt beakta mammae (även män), bäcken, rektum, prostata, testiklar/yttre genitalia, lymfkörtlar samt hudkostym.
Radiologisk kartläggning och endoskopier
Radiologisk undersökning bör omfatta DT torax–buk och eventuellt bäcken samt även hals, om patologiska lymfkörtlar finns på halsen eller om det finns fynd av skivepitelcancer ovanför diafragma. Kompletterande utredningar bör göras vid vissa situationer:
–Mammografi vid adenokarcinom, axillkörtel eller lågt differentierat karcinom hos kvinna
–Endoskopi av övre luftvägar vid halskörtel
–Bronkoskopi vid supraklavikulär lymfkörtel eller småcellig cancer
–Gastroskopi vid supraklavikulär körtel (»Virchowkörtel«)
–Rekto-/proktoskopi vid inguinal körtel
–Gyn-undersökning med vaginalt ultraljud om PAD eller metastasmönster ingivit misstanke om gynekologisk cancer.
Under det senaste decenniet har utvecklingen gått starkt framåt för FDG-PET. Det har beskrivits i flera rapporter att PET i 35–60 procent av fallen med CUP kan lokalisera primärtumören där denna inte kunnat fastställas med konventionella tekniker [18, 19]. Vidare kan multipelt engagemang upptäckas hos ca 40 procent av patienterna där konventionella tekniker anger lokaliserad sjukdom. Vi föreslår att denna undersökning utförs på de patienter som har liten tumörutbredning och gott allmäntillstånd och för vilka man överväger kurativt syftande behandlingsmodaliteter, t ex levermetastaskirurgi. PET bör i sådana situationer komma in tidigt i utredningen för att undvika andra kostsamma och besvärande undersökningar. Kostnaden för PET är relativt hög, dock är den selekterade grupp av patienter som kan bli föremål för PET-undersökning relativt liten. Helkropps-MRT har visat sig vara snabbare och möjligen bättre än DT, skintigrafi etc [20, 21]. Tekniken får dock betraktas som under utveckling, vilket gör att diagnostiska för- och nackdelar ännu är tämligen lite belysta.
MRT av brösten kan utgöra ett komplement till mammografi om denna utfaller negativt hos en kvinna med engagemang av adenokarcinom i axillen och således stark misstanke om bröstcancer föreligger. I dessa fall kan MRT ofta påvisa små bröstcancrar [22].
Vidare utveckling med kombinerad PET/DT har rapporterats ytterligare kunna förbättra stadieindelning vid maligna sjukdomar samt även på så sätt haft betydelse för efterföljande behandlingsstrategi [23, 24].
Vävnadsanalys
Noggrann histopatologisk undersökning är central och bör prioriteras före extensiv radiologisk och endoskopisk undersökning för att i möjligaste mån fastställa primärtumör. Ljusmikroskopi och immunhistokemiska specialanalyser är hörnpelare vid utredning av CUP. Analyserna syftar till att indikera primärtumören och/eller CUP-typer där särskild behandling kan övervägas. Adekvat mängd tumörmaterial är essentiell för närmare klassificering av tumörtypen. Finnålspunktion tillåter endast cytologisk undersökning, vilken i allmänhet är otillräcklig i CUP-situationen. Enligt vår erfarenhet är det mest praktiskt med riktade mellannålsbiopsier. Detta förfarande har vi nyttjat sedan decennier tillbaka med mycket få komplikationer och utan dödlig utgång vid provtagningen.
Ljusmikroskopi ger en kategorisering till någon av de histopatologiska huvudgrupperna (Tabell I) och kompletteras med följande specialdiagnostik:
–Högt/medelhögt differentierat adenokarcinom hos man – PSA-färgning
–Högt/medelhögt differentierat adenokarcinom hos kvinna – ER(östrogenreceptor)/PR(progesteronreceptor)-bestämning
–Ljusmikroskopisk misstanke om karcinoid – NSE (neurospecifikt enolas), kromogranin
–Lågt differentierat karcinom/lågt differentierat adenokarcinom/lågt differentierad malign tumör.
För att få vägledning om varifrån CUP utgått bör immunfärgningar utföras enligt Tabell IV. Kompletterande analys av cytokeratin 7 och 20 kan ge betydande vägledning avseende primärtumörens lokal [25]. Det finns dock ofta en överlappning, och givet den relativt låga betydelsen av att fastställa primärtumören är den kliniska nyttan inte övertygande visad.
Blodprov och tumörmarkörer
Blodprovstagning bör omfatta Hb, LPK, trombocyter, alkaliskt fosfatas, LD, ALAT, kalcium, albumin, natrium, kalium, kreatinin och glukos.
Generellt framställs i litteraturen stort tvivel angående värdet av serumtumörmarkörer [26, 27]. Orsaken är den låga specificiteten för varje enskild markör. Undantag utgörs av PSA, som bör tas vid adenokarcinom eller lågt differentierad cancer hos man, AFP (alfafetoprotein) vid isolerat adenokarcinom i levern och B-HCG(humant koriongonadotropin)
/
AFP, som bör tas vid lågt differentierad cancer för att upptäcka eventuell germinalcellstumör. Man kan även överväga provtagning med CA 15-3 vid misstänkt bröstcancer och CA 125 vid misstänkt ovarialcancer. Dessa analyser är dock inte specifika, och tex ses en kraftig stegring av CA 125 vid peritoneal- och pleural metastasering oavsett cancersjukdom [L-O Hansson, Uppsala, pers medd, 2004]. Tumörmarkörer kan eventuellt nyttjas i senare skede för att följa behandlingseffekt [28].
Behandling och prognos
Behandlingsval baseras på utfallet av ovanstående diagnostik och är mycket varierande. Om primärtumören lokaliseras eller histopatologisk undersökning avslöjar behandlingsbar tumörtyp, t ex malignt lymfom, följer rekommenderad behandling den som tillämpas för respektive tumörgrupp. Vid lokaliserad CUP bör potentiellt botande radikalbehandling övervägas. Flertalet patienter faller inte inom dessa kategorier, varvid man får överväga palliativa åtgärder i varje enskilt fall. I Tabell V föreslås specifik behandling för olika CUP-kategorier. Det är självfallet viktigt att redan från symtomdebut tillgodose god symtomlindring, tex smärtbehandling, även om diagnos inte hunnit fastställas.
Prognosen är överlag dyster för CUP, dock föreligger det subgrupper med betydligt bättre prognos och i vissa fall även chans till långtidsöverlevnad samt i några procent bot. Populationsbaserade data från två europeiska registerstudier rapporterar medianöverlevnad på endast 3–4 månader [7, 10]. Dock har patienter som inkluderats i kliniska studier bättre prognos, där varierar medianöverlevnaden mellan 6 och 10 månader [2]. Överlevnaden kan dock vara betydligt längre, 40 månader, vid engagemang av enbart 1–2 lokaler, icke adenokarcinom, och utan engagemang i lever, skelett, binjure eller pleura. Vidare tillhör yngre patienter med gott allmäntillstånd en gynnsammare prognosgrupp [29]. Bland stora patientmaterial som behandlats i studier med platina/taxan är ett- och tvåårsöverlevnaden 45 procent respektive 20 procent [2].
Åtskilliga patienter med CUP har sänkt allmäntillstånd, stor tumörbörda och hög ålder. Som grundregel bör man överväga palliativ cytostatikabehandling endast till de patienter som till största delen är uppegående, har någorlunda bevarad organfunktion samt inte är alltför ålderstigna, och den starkaste prognostiska faktorn för de flesta cancersjukdomar är patienternas allmäntillstånd [30]. Finns det egentligen någon övre åldersgräns? I litteraturen finns tyvärr mycket begränsad information om var åldersgränsen går vid cytostatikabehandling.
Vid studier rörande prognosfaktorer har åldern i sig ingen nämnvärd betydelse för behandlingen av de flesta cancersjukdomar, dock har äldre patienter med CUP en sämre prognos. Man vet att organfunktionen blir allt sämre vid hög ålder och att äldre personer ofta får fler biverkningar och tål lägre dosintensitet. Vidare har registreringsstudierna för flertalet cytostatika endast inkluderat patienter under 75 år. Vi har därför som en grov regel att vara restriktiva med att erbjuda palliativ cytostatikabehandling till individer som är över 80 år, dock skall påpekas att den biologiska åldern troligtvis är mer adekvat än den kronologiska åldern. Självfallet kan mer påverkade och/eller äldre patienter komma i fråga för hormonell behandling såsom vid bröst- och prostatacancer.
Särskilda överväganden vid CUP i CNS
Utredningsmässigt rekommenderas DT torax och buk som vid annan CUP. Röntgenologiska studier antyder att MRT av CNS är mer specifikt än DT [31]. De vanligaste primärlokalerna vid hjärnmetastas hos vuxna är lungcancer (50 procent), bröstcancer (17 procent), CUP (12 procent), melanom (10 procent) och koloncancer (5 procent). Biopsi eller kirurgisk exstirpation är den enda säkra metoden för att fastställa en tumörmisstänkt förändrings natur. Detta gäller förstås särskilt vid isolerad förändring, då ca 10 procent inte är metastas utan antingen primär hjärntumör eller infektion. Man bör även utesluta CNS-lymfom som differentialdiagnos. Avseende behandling se Tabell V.
Andrahandsbehandling
Ytterst lite data finns om behandlingseffekter vid andra-handsbehandling. Generellt är resultaten nedslående [32, 33], och empiriskt bör denna behandling förbehållas de patienter som har tolererat och haft nytta av tidigare behandling samt har fortsatt gott allmäntillstånd med bevarad organfunktion. Vidare finns en rapport om högdoscytostatikabehandling och perifert stamcellsstöd, som inte visade någon patientnytta [34]. Gemcitabin har beskrivits ge symtomlindring hos 25 procent av patienterna utan objektiv respons på förstahandsbehandlingen [35].
Utredning med multidisciplinär kompetens
Patienter med CUP-frågeställning berör flera stora specialiteter, såsom intermedicin, kirurgi, onkologi och ortopedi. Det finns inte skäl att här peka ut hur ett optimalt omhändertagande av dessa patienter bör organiseras. Det är dock enligt vår erfarenhet inte ovanligt att utredningen av CUP-patienter blir långdragen och innehåller moment som inte är nödvändiga medan avgörande undersökningar kan saknas. Detta fördyrar, fördröjer och frustrerar och får konsekvenser för både sjukvård och patient. Utredning och behandling av CUP-patienter kan således ha mycket att vinna på att omhändertas av de läkare som har kunskap om, intresse för och erfarenhet av CUP och som har tillgång till ett multidisciplinärt nätverk. Ett sådant nätverk bör lämpligen innehålla onkologisk, patologisk, radiologisk och kirurgisk kompetens.
Framtida utveckling
Det finns goda skäl att tro att CUP-diagnosen efter hand kommer att bli ovanligare med förbättrad radiologi och där mer sofistikerade analyser av gen- och/eller proteinuttryck av tillvarataget tumörmaterial i större omfattning kommer att kunna fastställa ursprunget. Vidare finns nu data som antyder att proteomikanalys av serumprov med hög säkerhet kan fastställa primärtumör [36]. Ur utredningssynvinkel och med tanke på optimering av stadieindelning kan man spekulera över om t ex en enda undersökning med PET med eller utan kombination av DT samt riktad biopsi kan ersätta all annan utredning.
*
Potentiella bindningar eller jävsförhållanden: Inga uppgivna.